植物乳杆菌CCFM8724对致龋双菌生物膜的抑制作用
2020-07-22秦苏佳徐晚晴张秋香赵建新张灏陈卫
秦苏佳,徐晚晴,张秋香,赵建新,张灏,陈卫
(江南大学 食品学院,江苏 无锡,214122)
龋病是世界范围内最常见的儿童和成人口腔细菌性传染病之一。其中,幼儿龋病(early childhood caries, ECC)是婴幼儿特别是学龄前儿童患龋的一种,发展迅猛,可导致乳牙快速、侵袭性损坏,不仅造成牙髓疼痛,而且影响恒牙的发育和全身健康[1-2]。
牙菌斑生物膜的形成是龋病发生的先决条件[3]。变异链球菌(Streptococcusmutans)是公认的主要致龋细菌,但最近研究发现,除了变异链球菌外,在患有龋齿的幼儿的牙菌斑生物膜中也经常检测到白色念珠菌(Candidaalbicans)[4-5]。变异链球菌产生的葡萄糖基转移酶(glucosyltransferase,GTFs)可与白色念珠菌细胞壁上的甘露聚糖黏附,将其募集到早期生物膜上[6-7]。FALSETTA的动物模型也证明了它们的协同作用增强了生物膜的毒力,导致类似ECC的猖獗性龋病的发生[8]。
传统的防治龋齿手段有机械治疗、抗生素、天然植物提取物疗法。机械疗法受人为意愿限制,效果较为表面;大部分的抗生素会破坏菌群的正常生态,同时增强致病菌的耐药性[9]。近年,天然植物提取物的防龋研究取得了一定进展。饶瑞瑛等[10]研究表明,白芨提取物对变异链球菌有抑菌和抑制生物膜形成的作用,且生物膜活性随使用药物浓度的上升而降低。PHILIP等[11]研究发现,蔓越莓提取物能显著降低变异链球菌和白色念珠菌双菌生物膜的代谢活性和产酸性,并破坏双菌生物膜的结构。王小玉等[12]研究发现,柠檬精油能够显著降低变异链球菌和白色念珠菌在双菌生物膜中的存活率并抑制双菌生物膜的形成。然而植物提取物作用机制复杂且尚不明确,加之本身味道的限制,也难以使大众普遍接受[13]。
乳酸菌作为对人体有益的活性微生物,能够从根源上破坏致龋毒力并调节口腔微生态平衡且无副作用,受到了越来越多的关注和欢迎。CIANDRINI等[14-17]在体外筛选并验证了特定乳酸菌对变异链球菌生物膜和致龋细菌生物膜的抑制作用,而乳酸菌对变异链球菌与白色念珠菌的双菌生物膜的抑制作用,少有人研究。因此,本研究在体外筛选了1株对双菌生物膜具有抑制作用的植物乳杆菌(Lactobacillusplantarum)CCFM8724,并验证了它在不同时期对双菌生物膜的破坏效果。
1 材料与方法
1.1 实验菌株
变异链球菌(Streptococcusmutans)ATCC25175;植物乳杆菌(Lactobacillusplantarum)CCFM8724分离自健康人的粪便,白色念珠菌(Candidaalbicans)50-1分离自患龋儿童的牙菌斑。
1.2 材料和试剂
MRS、YPD培养基,青岛海博生物技术有限公司;TSB培养基,美国BD Difco公司;Live/Dead®BacLightTM活死菌荧光染色试剂盒(L34856),美国Thermo Fisher公司;溶菌酶,上海生工生物工程有限公司;结晶紫、蒽酮、乙醇等化学试剂,国药集团化学试剂有限公司。
1.3 仪器设备
MLS-3750型高温高压灭菌锅,日本SANYO公司;SW-CJ-1CV型微生物操作超净工作台,安泰空气技术有限公司;隔水式恒温培养箱,上海跃进医疗器械厂;高速冷冻离心机,德国Eppendorf公司;Multiscan Go全波长酶标仪,美国Thermo Fisher公司;QUANTA 200®扫描电镜,荷兰FEI公司;LSM 710激光共聚焦显微镜,德国Zeiss公司。
1.4 实验方法
1.4.1 菌株的培养和菌悬液制备
取冻存甘油管中的乳杆菌、变异链球菌和白色念珠菌,分别在MRS、TSB和YPD平板上划线活化2次后,挑单菌落接入对应液体培养基于37 ℃下培养24 h。制备菌悬液需收集菌体,调整菌悬液浓度:乳杆菌和变异链球菌107CFU/mL,白色念珠菌106CFU/mL。
1.4.2 上清液的制备
乳杆菌液培养24 h后,培养液于12 000 r/min条件下离心10 min,上清液经0.22 μm无菌滤膜过滤后存于-20 ℃,备用。
1.4.3 生物膜量测定
于96孔板中加入变异链球菌和白色念珠菌菌悬液每孔各50 μL,在0、6、12 h加入CCFM8724上清液100 μL,37℃培养24 h。24 h上清液介导生物膜的方法:于96孔板中加入变异链球菌和白色念珠菌菌悬液每孔各50 μL,培养24 h后,用PBS清洗生物膜2遍,加入CCFM8724上清液100 μL,继续培养24 h。对照以空白MRS替代上清液。用结晶紫染色法测定生物膜量[18]。生物膜量减少率计算如公式(1)所示:
(1)
1.4.4 生物膜水不溶性胞外多糖产量测定
于24孔板中加入变异链球菌和白色念珠菌菌悬液,每孔各1 mL,在0、6、12 h加入CCFM8724上清液150 μL,37 ℃培养24 h。24 h上清液介导的方法:双菌生物膜培养24 h后,用PBS清洗生物膜2遍,加CCFM8724上清液2 mL,再培养24 h。培养结束后用1 mL PBS将生物膜洗脱,转移至1.5 mL离心管内,6 000×g离心10 min后弃上清液,重复洗3遍,根据REN等[19]的方法加入1 mL NaOH提取水不溶性胞外多糖,以蒽酮-硫酸法测定胞外多糖含量。胞外多糖减少率如公式(2)所示
胞外多糖减水率/%=
(2)
1.4.5 荧光染色观察生物膜中活死菌比例
在6孔板中放入18 mm×18 mm无菌盖玻片,加入致病菌菌悬液各2 mL,在0、6、12、24 h加入CCFM8724上清液250 μL,37 ℃培养24 h。根据Live/Dead®BacLightTM活死菌荧光染色试剂盒的操作流程将生物膜避光染色30 min,在激光共聚焦显微镜(confocal laser scanning microscope, CLSM)下观察。参考SHANG等[20]的方法在Zen 2010软件下扫描分析。
1.4.6 生物膜中致病菌活菌数计数
方法同1.4.5(在24 h加入CCFM8724上清液)。培养结束后将长有生物膜的盖玻片置于生理盐水中,超声洗脱生物膜[21],梯度稀释生物膜悬液,浇注计数。
1.4.7 扫描电镜(scanning electron microscope, SEM)观察生物膜结构变化
方法同1.4.5(在0 h加入CCFM8724菌液)。按BARBOSA等[22]的方法将生物膜制成样本后置于扫描电镜下观察。
1.4.8 乳杆菌对唾液包被羟基磷灰石脱钙量测定
将唾液包被的羟基磷灰石片(saliva-coated hydroxyapatite discs, SHA)放入6孔板中,方法同1.4.5,于0 h加入CCFM8724菌液250 μL,培养24 h后取培养液在8 000 r/min条件下离心5 min,吸取上清液,并测pH和钙离子浓度。SHA模型建立参考WU等[16]的方法,采用电感耦合等离子体质谱法(inductively coupled plasma mass spectrometry, ICP-MS)测定钙离子。钙流失比如公式(3)所示
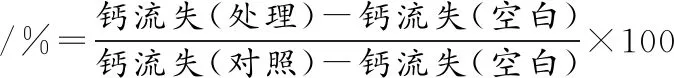
(3)
1.4.9 乳杆菌溶菌酶耐受能力测定
采用分光光度法考察CCFM8724对溶菌酶的耐受能力[23]。将乳杆菌菌悬液接种至96孔培养板,分别添加不同浓度的溶菌酶溶液使得终质量浓度分别为0.4、0.8、1.2、1.6、2.0、3.0 mg/mL。培养结束后于OD600下测吸光度。对照组用无菌水代替溶菌酶溶液。
1.4.10 统计学分析
本研究采用SPSS Statistics 25.0单因素方差(One-Way,ANOVA)对实验结果进行显著性分析。采用Graphpad Prism 8.0进行作图和分析。设置显著性水平为0.05,P<0.05表明数据分析结果呈显著性差异。
2 结果与讨论
2.1 生物膜形成量的分析
生物膜的形成阶段包含了4个关键时间点:0 h,细菌的初始黏附;6 h,细菌的初始定植;12 h,早期生物膜的形成;24 h,生物膜的成熟[24]。分别在4个关键时间点加入CCFM8724上清液进行介导,并计算不同时期介导后的生物膜成膜量和生物膜量减少率。其中生物膜形成前中期(0、6、12 h)的介导组皆以12 h组(空白MRS代替上清液)为对照。结果如图1所示,24 h对照生物膜(空白MRS代替上清液)比12 h对照生物膜在生物膜量上没有显著的增长(P<0.05);每个时间点介导都显著地减少生物膜量(P<0.05),减少率依次为89.74%、82.13%、75.35%和76.61%,减少量均>70%。表明CCFM8724在不同时间介导都能抑制双菌生物膜生成,前、中期(0~12 h)的生物膜减少量呈线性下降趋势,对24 h成熟生物膜的抑制效果也较好,与12 h介导形成的生物膜量并无显著性差别。

图1 不同时间CCFM8724介导双菌生物膜的生物膜量(a)和生物膜量减少率(b)
2.2 生物膜胞外多糖产量分析
水不溶性胞外多糖是生物膜基质的最主要成分,这些基质形成了一种三维立体的结构,富含空隙和管道系统,而微生物就被包埋在了它们自身产生的这些胞外聚合物基质中[25]。如图2显示,0、6、12 和24 h四个时间介导的胞外多糖产量与对照组有显著差异(P<0.05),依次减少率为82.19%、64.64%、46.32%,和48.47%, 其中0 h产量最少,与2.1结果一致,推测可能是由于乳杆菌上清液中的抑菌产物发挥了作用,对致病菌的初始黏附造成了影响。另外,4个时间点对生物膜水不溶性胞外多糖减少趋势与生物膜量的减少趋势大致相同。结果表明,CCFM8724在不同时间介导都能显著降低双菌生物膜胞外多糖的产量,减少生物膜基质的形成,且乳杆菌介导时间越早效果越好。

图2 蒽酮-硫酸法测定的双菌生物膜水不溶性胞外多糖量产量(a)和减少率(b)
2.3 激光共聚焦3D图分析
为了观察不同时间介导下生物膜的活性,采用双染法区分活细胞(绿色)和死细胞(红色),3D生物膜图像如图3所示。CCFM8724上清液在0 h介导后,染色并未观察到相应的细胞黏附,推测是由于乳杆菌在0 h介导时直接抑制了变异链球菌和白色念珠菌生长,影响了生物膜的形成;介导越早菌体覆盖越少,24 h介导虽然还是形成了较大面积的菌体覆盖,但是生物膜的厚度显著减少,且死菌比例大幅上升,该生物膜活性显著降低,说明CCFM8724对成熟生物膜的菌体面积减少不显著,但可以大大降低生物膜活性。与对照生物膜相比,不同介导时间的生物膜厚度均显著降低,尤其在24 h介导时生物膜厚度最低,表明CCFM8724不但降低了成熟生物膜活性还减少了生物膜中菌体的厚度。实验结果与ZHANG等[26]研究结果类似,乳杆菌能够减少生物膜菌体覆盖面积和厚度、尤其是生物膜中活死菌比例,从而降低生物膜活性。

a-24 h双菌生物膜对照组;b-6 h乳杆菌介导组;c-12 h乳杆菌介导组;d-24 h乳杆菌介导组
2.4 生物膜中致病菌计数结果分析
由于成熟生物膜对菌体的保护作用较强,许多治疗剂在作用于细菌之前就与生物膜中的胞外多糖结合,从而失去效用[27],这也是抗菌剂和抗生素在临床上防治龋齿效果不佳的原因之一。为了探究乳杆菌对生物膜中菌体的抑制效果,对24 h介导的生物膜中致病菌进行计数。结果如表1所示,双菌生物膜中变异链球菌为7.1 lg CFU/mL,显著高于CCFM8724上清液介导后的浓度4.2 lg CFU/mL(P<0.05);而CCFM8724介导后白色念珠菌浓度为3.9 lg CFU/mL,显著低于对照组6.2 lg CFU/mL(P<0.05)。

表1 生物膜中致病菌活死菌计数结果 单位:lg CFU/mL
结果表明,CCFM8724能够显著减少成熟生物膜中的致病菌数,推测CCFM8724可能通过穿透生物膜基质对致病菌发挥抑菌效果。
2.5 扫描电镜图分析
白色念珠菌是常见的条件致病菌,它的酵母态向菌丝态的转变通常增强其致病性,同时能为变异链球菌提供更多黏附位点[28]。从图4-a和图4-b的对照生物膜可以看出,生物膜具有一定厚度,呈明显的波浪状;变异链球菌呈链状排列,紧紧附着在酵母细胞上,酵母菌菌丝在凸起的生物膜基质中纵横交错。从图4-c和图4-d可以看出,与CCFM8724共培养后,生物膜厚度明显减少,结构松散,变异链球菌和白色念珠菌细胞数量骤减,没有明显的胞外基质,酵母菌菌丝也未可见。许多生物膜结构包含了环境流体可以通过的通道,这些通道通常充当输送营养物质、清除废物和作为信使分子的运输管道,生物膜结构的破坏也会影响生物膜整体的生理活性[29]。结果表明,CCFM8724破坏了致龋双菌生物膜的结构,又抑制了白色念珠菌毒力因子菌丝的形成,生物膜失去了菌丝的支撑,变异链球菌的黏附位点也大大减少,生物膜从致密的结构变得疏松且基质厚度明显减少。

a,b-对照生物膜(×1 200,×2 400);c,d-与CCFM8724共培养的生物膜(×1 200,×2 400)
2.6 乳杆菌对SHA模型脱钙分析
龋齿的发生是一个致龋生物膜中的细菌产酸对牙齿进行脱矿的过程,而此过程往往伴随着钙离子的流失。乳杆菌与SHA模型上双菌生物膜共培养,测定培养液的pH值和SHA的脱钙情况来判断乳杆菌对致龋环境中的牙齿是否有保护作用(表2)。
由表2可以看出CCFM8724与双菌生物膜共培养后显著提升了培养液的pH值,减少了生物膜的脱钙量,从口腔乳杆菌的益生特性上分析,CCFM8724对龋菌斑牙齿有一定保护作用。

表2 唾液包被羟基磷灰石的脱钙量和培养液pH
2.7 CCFM8724对溶菌酶耐受能力分析
从图5可以看出,CCFM8724在溶菌酶质量浓度为0~1.6 mg/mL时,生长情况基本不受影响,而溶菌酶质量浓度达到2.0 mg/mL时,菌体生长的吸光度值骤然减少,为对照的37.5%,可推测CCFM8724对溶菌酶耐受的临界值介于1.6~2.0 mg/mL。根据人口腔溶菌酶质量浓度为0~57 μg/mL[30],说明该乳杆菌在口腔中有一定存活能力。
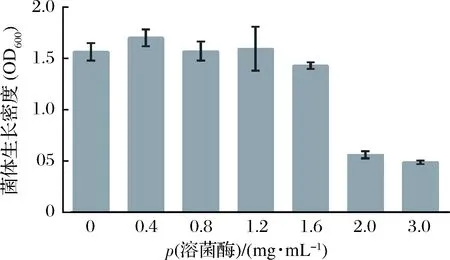
图5 CCFM8724在不同浓度溶菌酶下生长情况
3 结论
变异链球菌、白色念珠菌和乳杆菌都是口腔中常见的微生物。与肠道菌群类似,口腔菌群也处于动态平衡中,一旦动态平衡遭到破坏,致龋的微生物将成为优势菌从而形成具有致龋毒力牙菌斑生物膜。而采用益生菌疗法以乳杆菌干预致龋微生物膜的过程,即对口腔微生态的重新调整,可以让有益菌成为优势菌维持口腔健康。本研究证明,植物乳杆菌CCFM8724上清液在不同时间点介导能够减少双菌生物膜的生物膜量、水不溶性胞外多糖产量并降低生物膜活性,不仅可以显著减少初始生物膜的黏附,对24 h成熟生物膜依然有较好的抑制作用。乳杆菌与致病菌共培养后的生物膜结构明显松散、稀疏且看不见白色念珠菌的菌丝和起伏的生物膜基质,对生物膜结构的破坏作用也十分显著。综上,植物乳杆菌CCFM8724在体外实验中表现出了较好地抑制变异链球菌和白色念珠菌双菌生物膜效果,为CCFM8724在防治幼儿龋齿上的应用提供了理论依据,为进一步验证益生菌在体内的功效并开发功能益生菌产品打下基础。
