CT 灌注成像在构建胃癌术前淋巴结转移预测模型中的价值
2020-07-22黄列彬龙晚生薛慧敏陈钦贤李月月黄文斯兰勇李荣岗李青
黄列彬 龙晚生 薛慧敏 陈钦贤 李月月 黄文斯 兰勇 李荣岗 李青
胃癌是世界上常见的恶性肿瘤之一,尤其在东亚地区高发[1,2],而在我国胃癌发病率居第二位,病死率排第三位[3]。手术仍是目前治疗胃癌的重要手段,而规范合理的淋巴结清扫是胃癌根治术成功与否的关键。根据日本胃癌协会2018 年公布的第五版日本胃癌治疗指南,原则上D2 淋巴结清扫术适用于cN+或≥cT2 肿瘤,D1 或D1+淋巴结清扫术适用于cT1N0 肿瘤[4]。此外,近年来内镜下切除术越来越多的应用于早期胃癌,然而只有在区域淋巴结转移能被安全排除的情况下,才应考虑这种方式切除[5],故术前准确的判断淋巴结转移情况尤显重要。常规增强CT 主要从形态学上对淋巴结进行评估,其敏感度及特异度不高[6-8],而CT 灌注成像可通过重建灌注参数来明确反映肿瘤部位的血流动力学信息,进而反映肿瘤的生物学特性[9]。目前CT 灌注成像评估胃癌淋巴结转移的研究相对较少[10]。本研究旨在探讨基于CT灌注成像构建胃癌术前淋巴结转移预测模型是否可行。
资料与方法
1.临床资料
本研究经医院伦理委员会批准,患者均知情同意。前瞻性收集2017 年03 月~2019 年12 月本院临床怀疑为胃癌的患者107 例。
病例纳入标准:(1)患者心肝肾功能良好,能耐受高流率注射对比剂检查;(2)CT 灌注扫描前经胃镜活检病理证实胃癌;(3)CT 灌注扫描前未行任何治疗;(4)CT 灌注检查在手术前7 d 内完成;(5)CA19-9、CEA 化验检查在手术前7 d 内完成;(6)术后淋巴结检出个数大于15,且术后淋巴结转移的有无均经病理证实;(7)对山莨菪碱和碘对比剂不过敏并无相应禁忌证。病例排除标准:(1)CT 灌注图像伪影大,图像质量差;(2)经术前检查证实发生远处转移或腹腔广泛转移等无法接受手术者。
按上述标准,最后共纳入98 例胃癌患者,男50 例,女48 例(表1)。
2.检查方法
检查前准备:(1)禁食6~8 h;(2)评估患者情况,无禁忌证者,扫描前10~15 min 肌肉注射山莨菪碱(654-2)10 mg;(3)静脉留置针头;(4)检查前10 min 内口服等渗甘露醇溶液600~1000 ml 以扩张胃腔;(5)呼吸训练,扫描期间尽量屏气,对于不能坚持屏气的患者,保持缓慢平静呼吸。
扫描方法: 所有病例均采用Siemens Somatom Force CT 进行扫描,扫描时使用腹带捆绑患者腹部以减少呼吸运动。先行常规平扫(110 kV,250 mAs),以确定病变大致范围;以胃癌病灶最大径层面为中心,确定靶扫描范围,然后再以体部灌注模式(80 kV,80 mAs)进行灌注靶扫描。经静脉留置针先以5 ml/s 流率注入50 ml 对比剂(碘帕醇370 mg I/ml),随后以相同流率注入45 ml 生理盐水。对比剂注入后延迟8 s 开始扫描,共产生30个动态容积数据。
3.图像后处理
所有CT 灌注扫描数据均传至Siemens 后处理工作站Syngo.via,利用体部CT 灌注软件的肿瘤灌注(tumor)协议,采用Deconvolution 模式处理数据,先进行运动校正,后进行灌注评测得出血流量(blood flow,BF)、血容量(blood volume,BV)、平均通过时间(mean transit time,MTT)、流空时间(time to drain,TTD)、流入时间(time to start,TTS)、达峰时间(Tmax)的伪彩图。兴趣区(region of interest,ROI) 置放避开囊变坏死区,每位患者放置3 个ROI,然后取各灌注参数的平均值,ROI 均采用圆形,大小保持一致。
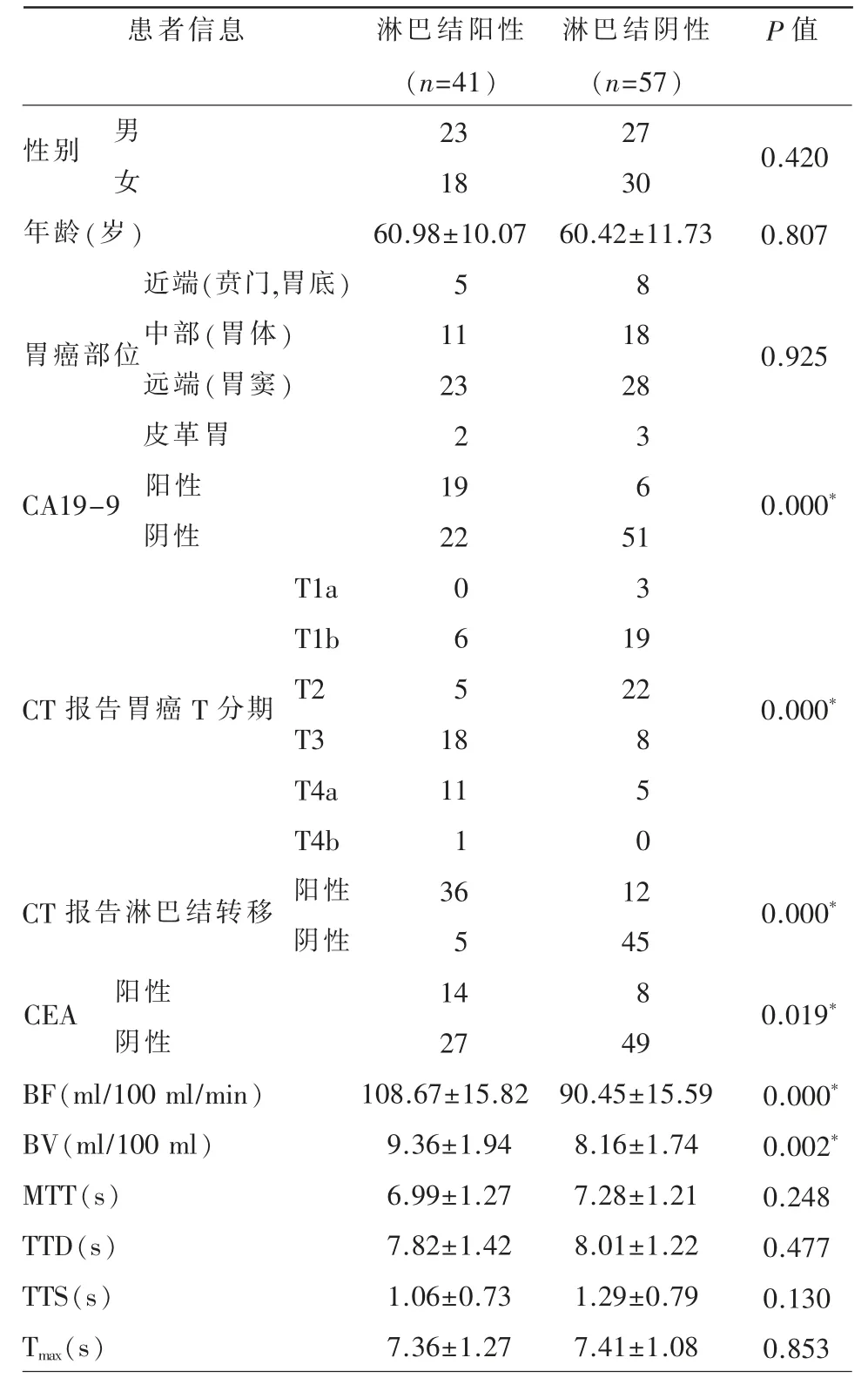
表1 淋巴结阳性组及阴性组患者的基本信息
4.病理评估
由两位有丰富胃癌病理诊断经验的医生分别独立对患者术后病理组织切片进行诊断,当意见不一致时,通过协商讨论解决分歧。
5.影像评估及标准
由两位腹部影像诊断方向的影像医生分别独立对患者的常规CT 图像进行评估,主要内容包括淋巴结转移情况及临床T 分期情况,当意见不一致时,通过协商讨论解决分歧,相应标准如下:
淋巴结转移CT 诊断标准:(1)胃周淋巴结短径大于等于6 mm;非胃周淋巴结短径大于等于8 mm;(2) 强化不均,有中央坏死;(3)多个淋巴结聚集、融合(3 枚及3 枚以上)。满足以上任何一点即CT 诊断为淋巴结转移[6]。
胃癌T 分期CT 诊断均在静脉期图像上观察,诊断标准为:T1a:与邻近的正常黏膜层相比,肿瘤表现为黏膜层的强化和/或增厚,并有完整的低密度条带层;T1b:低密度条带层的破坏(小于50%厚度);T2:低密度条带层破坏(大于50%厚度);T3:无法区分增强的胃病变和浆膜层,浆膜面光滑,与周围脏器分界清晰;T4a:浆膜面不规则或呈结节状突起和/或胃周脂肪间隙模糊和/或浆膜侧亮线征样强化;T4b:肿瘤与邻近脏器之间的脂肪层消失,并侵犯邻近器官[11]。
6.统计学分析
所有数据均用SPSS 19.0 软件包进行分析,ROC 曲线利用MedCalc软件完成。定量资料以()表示,若符合正态分布且方差齐,两组间比较用独立样本t 检验,若不符合上述条件,则采用Mann-Whitney U检验。定性资料用卡方检验进行分析。用Logistic 回归分析(向后步进:似然比)筛选胃癌淋巴结转移的独立预测因子并构建术前预测模型。采用受试者操作特征(ROC)曲线评估预测模型的价值。P<0.05 为差异具有统计学意义。
结 果
1.淋巴结阳性及阴性组患者的基本信息
本研究共纳入98 例胃癌患者,其中淋巴结阳性41 例,阴性组57 例(表1)。两组的BF、BV、CA19-9、CEA、CT 报告淋巴结转移情况、CT 报告胃癌T 分期等参数差异具有统计学意义(P<0.05)。淋巴结阳性及阴性病例灌注及病理图像分别见图1、2。
2.术前预测胃癌淋巴结转移相关因素的多因素Logistic 回归分析
以是否发生淋巴结转移为因变量,以单因素分 析 有 统 计 学 意 义 的BF、BV、CA19-9、CEA、CT报告淋巴结转移情况、CT 报告胃癌T 分期为自变量,进行多因素Logistic 回归分析(Backward 法),结果显示,共有三个因素(BF、CT 报告淋巴结状态及CT 报告胃癌T 分期)进入Logistic 回归方程(表2)。
3.预测模型的ROC 分析
预测模型ROC 分析结果显示,AUC(95% CI)为0.950(0.886~0.984),Cutoff 值为0.2727 时,敏感度92.7%,特异度86.0%(图3)。
讨 论
胃癌患者的淋巴结转移情况不仅对治疗方案的选择有重要影响,且是胃癌患者预后的独立预测因素[12],术前准确的预测淋巴结转移状态对临床治疗有重要的指导意义。
CT 是目前胃癌术前评估淋巴结的重要检查方法,其主要从形态学方面对淋巴结进行评估,且敏感度及特异度均相对较低。Fukuya 等[13]研究结果显示,常规增强CT 对胃周淋巴结的检出率及诊断淋巴结转移的敏感度均较低,对评估大于5 mm 的淋巴结转移情况的敏感度为75.2%。Saito等[6]研究亦显示出常规增强CT评估胃癌淋巴结转移的敏感度及特异度较低的情况,其研究以淋巴结短径9 mm 为阈值,诊断胃癌淋巴结转移的符合率仅70.6%,敏感度55.3%,特异度86.0%。因此,为更好的辅助临床诊疗,有必要探索一些新的敏感度及特异度均相对较高的评估方法。
CT 灌注成像不仅可观察形态学信息,而且可通过后处理重组并测量病灶部位灌注参数值,获得病灶血流动力学相关信息,进而反映肿瘤的生物学特性[9]。胃癌淋巴结转移机制复杂且受多方面因素影响,特别是原发肿瘤的异质性,其中血管生成的异质性是重要影响因素之一,可导致肿瘤不同程度恶性潜能和生物学行为,包括淋巴结转移潜能等[14]。故本研究对胃癌病灶的CT 灌注参数进行评估,研究结果显示淋巴结阳性组的BV、BF 值显著高于淋巴结阴性组(P<0.05)。BV 及BF 值分别代表了肿瘤内部的血容量及血流量,Yao 等[15]研究表明,BV、BF 值与肿瘤内部微血管密度密切相关,而微血管密度与肿瘤的组织学特征、淋巴结受累、远处转移和预后密切相关。另有研究表明,微血管密度可作为监测肿瘤血管生成的独立预测因子,并可用于评价肿瘤生长、转移情况[16]。据此推测BV、BF 值可反映肿瘤内部微血管密度情况,其值越高,肿瘤异质性及淋巴结转移潜能越高。
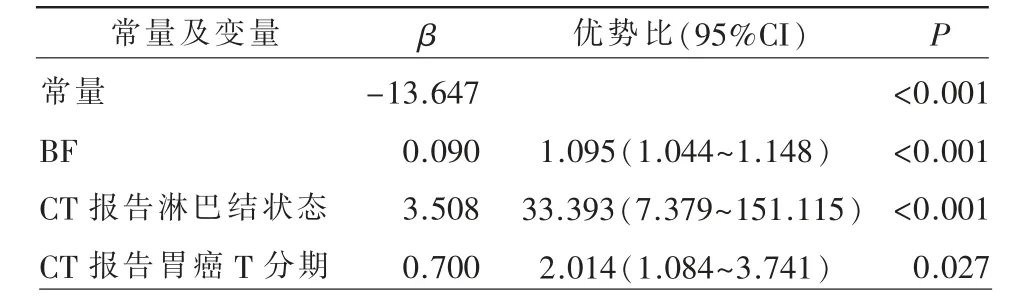
表2 多因素Logistic 回归分析及预测模型的建立
此外,本研究发现,CT 报告胃癌T 分期(临床T 分期)为术前预测胃癌淋巴结转移的独立预测因子,随着肿瘤浸润深度的增加,发生淋巴结转移的概率越高,与文献报道结果相仿[17]。本研究通过对单因素分析有意义的指标进行多因素Logistic回归分析得出BF 值、CT 报告淋巴结状态、CT 报告胃癌T 分期为术前预测胃癌淋巴结转移的独立预测因子,并构建预测模型。同时对模型进行ROC 分析,结果显示模型术前预测胃癌淋巴结转移的曲线下面积较高,其敏感度、特异度均比单纯用常规CT 报告淋巴结转移高,据此推测灌注参数可提供额外信息预测淋巴结转移。
本研究尚存不足:(1)病例数相对较少,模型的预测效能有可能被放大;(2)因手术清扫的淋巴结与CT 上显示的淋巴结难以一一对应,仅对肿瘤本身进行灌注评估,未对淋巴结进行CT 灌注参数评估。
综上所述,CT 灌注成像BF、BV 参数值与胃癌淋巴结转移相关,其中BF 值为术前预测胃癌淋巴结转移的独立预测因子,CT 灌注成像技术在构建术前预测胃癌淋巴结转移模型中有一定的价值。