miR-149-5p对变应性鼻炎小鼠Notch1表达和Treg/Th17免疫平衡的影响*
2020-07-21闫智永张爽唐桥斐
闫智永,张爽,唐桥斐
(沈阳医学院附属第二医院 耳鼻喉科,辽宁 沈阳 110002)
变应性鼻炎(allergic rhinitis, AR)是一种与免疫球蛋白E(immunoglobulin E,IgE)介导的免疫应答相关的过敏性疾病,近年AR的发病率呈上升趋势[1]。MicroRNAs(miRNAs)参与免疫细胞的产生和分化,与免疫系统疾病密切相关[2]。有文献报道,miR-149-5p基因多态性与中国儿童AR和共病性哮喘发生风险有关联[3],但参与机制不明,传统观点认为AR主要是由辅助性T细胞1(T helper cells1,Th1)/T细胞2(T helper cells2,Th2)免疫失衡引起[4-5]。伴随免疫学的快速发展,辅助性T细胞17(T helper cell 17,Th17)和调节性T细胞(regulatory cells,Treg)被发现在AR发病中扮演着重要角色[6-8]。有研究显示,神经源性位点缺口同系物蛋白(neurogenic locus notch homolog protein,Notch)通过抑制叉头状螺旋转录因子3(fork-head box p3,Foxp3)表达和Treg细胞分化促进AR发生[9],桔皮素通过抑制Notch1/Jagged1信号通路影响T细胞分化,改善AR过敏症状[10]。生物信息学预测发现,Notch1是miR-149-5p的潜在靶基因,课题组进一步采用双荧光素酶实验证实miR-149-5p和Notch1的靶向关系,说明miR-149-5p可能靶向调节Notch1参与AR发病,但对Treg/Th17细胞平衡的影响有待研究。因此,本研究拟建立BALB/c小鼠AR模型,探讨miR-149-5p对AR小鼠Notch1表达和Treg/Th17细胞平衡的影响。
1 材料与方法
1.1材料
1.1.1实验动物和细胞 6~8周龄雄性BALB/c小鼠12只,SPF级,体质量16~18 g,购于辽宁长生生物科技股份有限公司[合格证号SCXK(辽)2015-0001],于温度18~22 ℃和湿度50~60 %环境中饲养,自由摄食和饮水,适应性喂养1周;人源胚胎肾细胞株293T购自上海中乔新舟生物科技有限公司。
1.1.2主要药品和试剂 卵白蛋白(ovalbumin,OVA;美国Sigma),苏木精和SYBR Green荧光染料(中国Solarbio),曙红Y(上海生工生物),全蛋白提取试剂盒、电化学发光(electrochemiluminescence,ECL)液、一抗二抗去除液、Notch1抗体、叉头状螺旋转录因子3(fork-head box p3,Foxp3)抗体、羊抗兔IgG-HRP及内参抗体β-肌动蛋白(β-actin,沈阳万类生物),维甲酸相关核孤儿受体γt(retinoic acid-related orphan nuclear receptor γt,RORγt)抗体(中国Affinity),预染蛋白分子量标准(加拿大Fermentas),Super M-MLV RNA反转录酶(中国BioTeke公司),小鼠IgE和白细胞介素-6(interleukin 6,IL-6)酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒(中国联科生物),小鼠白细胞介素-10(interleukin 10,IL-10)ELISA试剂盒(武汉优尔生生物),荧光素酶检测试剂盒(中国凯基生物),miR-149-5p激动剂(agomir)及阴性对照由中国吉玛基因公司合成。
1.1.3主要仪器 RM2235型石蜡切片机(德国Leica),DP73型显微镜拍照系统(日本OLUMPUS),ELX-800型酶标仪(美国BIOTEK),DYY-7C型电泳仪及DYCZ-40D型转移槽(北京六一仪器厂),H-2050R型超速冷冻离心机(长沙湘仪),NW10LVF型超纯水系统(香港Heal Force),Exicycler 96型荧光定量PCR仪(韩国BIONEER),NANO 2000型紫外分光光度计(美国Thermo),SW-CJ-2FD型超净工作台(苏州净化设备)。
1.2方法
1.2.1造模及分组 12只BALB/c小鼠,取3只作为正常组(不造模),剩余9只小鼠建立AR模型,采用随机数字表法均分为模型组、miR-149-5p激动剂对照组和miR-149-5p激动剂组。模型建立:称取OVA 25 μg和氢氧化铝[Al(OH)3]2 mg,加生理盐水制备混悬液,于实验第1、7及14天对小鼠进行腹腔注射作为基础致敏(200 μL/次);第21天开始自前鼻孔给予含3% OVA的生理盐水进行局部激发(20 μL/鼻孔),连续14 d(即第21~34天);激发致敏第28~34天时,分别于OVA激发前3 h向miR-149-5p激动剂对照组小鼠鼻腔内滴入miR-149-5pagomir阴性对照(5 nmol/L,10 μL/鼻孔)[11],向miR-149-5p激动剂组组小鼠鼻腔内滴入相同剂量miR-149-5pagomir,正常组和模型组小鼠鼻滴等体积生理盐水。
1.2.2行为学评分 于末次致敏30 min内,观察记录各组小鼠流涕、鼻痒状况和打喷嚏次数,其中清涕记分原则是流至前鼻孔为1分、超出前鼻孔为2分及涕流满面为3分,鼻痒记分原则是轻搔鼻1~2次为1分、介于轻搔鼻和剧烈抓挠鼻面不止之间为2分、剧烈抓挠鼻面不止为3分,喷嚏记分原则是1~3个为1分、4~10个为2分及11个以上为3分,以上3项指标合计为总分,总分范围1~9分,超过5分说明造模成功[12]。
1.2.3实时荧光定量PCR(Real-time PCR)检测鼻黏膜组织的miR-149-5p表达 末次滴鼻后24 h腹腔注射过量戊巴比妥钠(150 mg/kg)处死各组小鼠,取鼻黏膜组织,采用TRIpure法提取总RNA,测定浓度,反转录得到cDNA,应用SYBR Green Ⅰ荧光染料技术进行Real-time PCR反应,94 ℃预变性5 min,94 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,40个循环。根据循环值(Ct)计算miR-149-5p相对表达量。Real-time PCR引物序列见表1。

表1 Real-time PCR引物序列
1.2.4苏木精/伊红染色(hematoxylin-eosin staining,HE)观察鼻黏膜组织病理学变化 末次滴鼻后24 h腹腔注射过量戊巴比妥钠(150 mg/kg)处死小鼠,取小鼠鼻中隔黏膜,10%多聚甲醛溶液固定,常规石蜡包埋,制备切片,脱蜡水化后依次放入苏木精和伊红染色液中染色,脱水透明处理切片,滴加中性树胶封片,光学显微镜观察鼻黏膜组织结构变化,200×显微镜下拍照。
1.2.5ELISA检测血清中IgE、IL-6及IL-10水平 末次滴鼻24 h后取各组小鼠眼眶静脉血1 mL,离心分离血清,采用试剂盒检测血清样本中IgE、IL-6及IL-10水平,按照说明书进行操作;制作标准曲线,根据样本光密度(optical density,OD)通过回归方程计算各指标表达量。
1.2.6蛋白免疫印迹(Western blot)检测鼻黏膜组织Notch1、RORγt及Foxp3蛋白表达 末次滴鼻后24 h腹腔注射过量戊巴比妥钠(150 mg/kg)处死小鼠,取鼻黏膜组织,加入RIPA裂解液,静置5 min,4 ℃、12 000 r/min离心10 min,收集上清液得到样本总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,取蛋白上样40 μg,十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(Polyacrylamide gel electrophoresis,PAGE)电泳,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)转印,5%(M/V)脱脂奶封闭1 h,加入一抗,4 ℃过夜孵育,洗膜后加入二抗,37 ℃孵育5 min,喷洒ECL化学发光试剂,暗室内曝光成像,分析目标条带光密度值,计算Notch1、RORγt及Foxp3蛋白相对表达量。
1.2.7双荧光素酶实验检测miR-149-5p与Notch1的靶向关系 miRDB网站预测miR-149-5p与Notch1 3′-UTR结合位点,根据结合位点构建Notch1 3′-UTR区野生型(wild type,WT)和突变型(mutant type,MUT)荧光素酶报告载体,同miR-149-5pagomir或agomir阴性对照共转染293T细胞,设置NC+Notch1(MUT)组、miR-149-5pagomir+Notch1(MUT)组、NC+Notch1(WT)组及miR-149-5pagomir+Notch1(WT)组;24孔板培养48 h,收集细胞裂解,采用双荧光素酶报告基因检测试剂盒分析各组细胞海肾(Renilla)和萤火虫(Firefly)荧光强度,以海肾荧光作为内参照,计算荧光素酶相对活性值。
1.3统计学分析
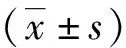
2 结果
2.1行为学评分及病理学观察
与正常组比较,模型组小鼠行为学评分明显升高,差异有统计学意义(P<0.01);与模型组比较,miR-149-5p激动剂组行为学评分明显下降,差异有统计学意义(P<0.01,表2)。HE染色结果显示,模型组和miR-149-5p激动剂对照组小鼠鼻黏膜结构紊乱,上皮不完整,有细胞脱落现象,可见大量炎性细胞浸润,基底增厚明显,采用miR-149-5p激动剂agomir干预后,小鼠鼻黏膜炎症反应减轻,只有少量炎性细胞浸润,上皮结构趋于完整(图1)。
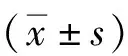
表2 各组小鼠行为学评分比较

图1 各组小鼠鼻黏膜组织HE染色(200×)
2.2鼻黏膜组织miR-149-5p表达
Real-time PCR检测结果显示,与正常组比较,模型组小鼠鼻黏膜组织中miR-149-5p的表达减少,差异有统计学意义(P<0.05);与模型组比较,miR-149-5p激动剂组小鼠鼻黏膜组织miR-149-5p的表达增加(P<0.05)。见图2。
2.3血清中IgE、IL-6及IL-10的水平
ELISA检测结果显示,与正常组比较,模型组小鼠血清IgE、IL-6水平显著升高,IL-10水平下降,差异有统计学意义(P<0.01);与模型组比较,miR-149-5p激动剂组小鼠血清中IgE、IL-6水平下降,IL-10水平升高,差异均有统计学意义(P<0.05)。见表3。
2.4Notch1、RORγt及Foxp3蛋白表达
Western blot结果显示,与正常组比较,模型组小鼠鼻黏膜组织中Notch1和RORγt蛋白的表达升高,Foxp3蛋白的表达降低,差异均有统计学意义(P<0.05);与模型组比较,miR-149-5p激动剂组小鼠鼻黏膜组织Foxp3蛋白的表达增加,Notch1和RORγt蛋白的表达减少,差异均有统计学意义(P<0.05)。见图3。

注:(1)与正常组比较,P<0.05;(2)与模型组比较,P<0.05。
2.5miR-149-5p对Notch1的调控作用
miRDB网站预测miR-149-5p与Notch1 3′-UTR存在互补位点(图4)。双荧光素酶实验结果显示,与NC+Notch1(WT)组比较,miR-149-5pagomir+Notch1(WT)组的荧光素酶相对活性降低,差异有统计学意义(P<0.05,图5),进一步验证靶向关系。
3 讨论
MicroRNAs(miRNAs)是一种小的非编码RNA分子,长度为18~22个核苷酸,在整个进化过程中高度保守[13]。目前miRNAs被认为是基因表达的基本调控机制之一,在控制细胞功能的每个方面都扮演着重要角色[14]。现已证明miR-146a、miR-199-3p及miR-466a-3p等众多miRNA在AR的发生发展中发挥了重要作用,其表达异常已被作为AR易感性分子标志物[15-16]。miR-149-5p位于2号染色体,通过调节Toll样受体(toll like receptor,TLR)、信号转导与转录活化因子3(signal transducers and activators of transduction 3,STAT3)等信号抑制炎症反应,并参与多种疾病进展,且和先天免疫功能失调有关[17-19],然而miR-149-5p在AR中的作用及影响目前尚未见文献报道。本研究采用OVA致敏建立AR小鼠模型,小鼠行为学评分结果显示,同正常组比较,AR组小鼠流涕严重,打喷嚏、搔鼻次数明显增加,Real-time PCR检测小鼠鼻黏膜组织中miR-149-5p表达,发现miR-149-5p在AR小鼠鼻黏膜组织中的表达减少,因此本研究推测miR-149-5p在AR发展中发挥重要作用。
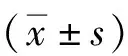
表3 各组小鼠血清IgE、IL-6及IL-10水平比较

注:(1)与正常组比较,P<0.05;(2)与模型组比较,P<0.05。

图4 miR-149-5p与Notch1的靶向关系

注:(1)与NC+Notch1(WT)组比较,P<0.05。
AR是机体接触变应原后由IgE介导的鼻炎膜非感染性炎性疾病,临床症状主要表现为鼻痒、打喷嚏和流清涕等,严重影响患者精神和心理健康[20]。本研究在已明确miR-149-5p在AR小鼠鼻黏膜组织中低表达的情况下,给予小鼠鼻滴miR-149-5p激动剂agomir,Real-time PCR结果显示miR-149-5p被有效高表达,可以进行后续研究。miR-149-5p高表达显著降低AR小鼠打喷嚏、搔鼻次数。HE和ELISA染色结果显示,miR-149-5p高表达后AR小鼠鼻黏膜炎性细胞浸润减少,血清IgE水平下降,表明miR-149-5p过表达对AR小鼠发挥治疗作用。
Notch受体是一种跨膜蛋白,由Notch1、Notch2、Notch3和Notch4四种组成[21]。在与配体结合后,受体被分泌酶蛋白酶裂解,释放胞内区域(notch intracellular domain,NICD),可以诱导下游基因转录,在癌细胞增殖、分化、器官形成等生命活动中起着至关重要的作用[22]。业已证实,Notch信号途径可促进淋巴细胞向T细胞分化,在早期T细胞发育过程中起关键性作用[23-24];更有研究发现,Notch1和Jagged1被证明在AR患者血清中的表达明显减少,与过敏原特异性免疫球蛋白E(specific immunoglobulin E,sIgE)水平呈正相关[9]。本研究采用Western blot技术分析AR小鼠鼻黏膜组织中蛋白表达情况,发现Notch1在模型组中的表达较正常组明显增多,与miR-149-5p表达呈负相关,同前述研究结果一致。
众所周知,miRNAs通过与靶基因mRNA 3′-UTR区完全或不完全互补配对结合,导致目标基因降解或翻译抑制,进而调控多种疾病的发生发生过程,这种作用机制已经在AR中被反复证明[25]。本研究通过生物信息学分析发现Notch1 3′-UTR区存在miR-149-5p反应元件(metal response element,MRE),双荧光素酶实验结果显示,与NC+Notch1(WT)组比较,miR-149-5pagomir+Notch1(WT)组的荧光素酶相对活性降低,说明miR-149-5p可能通过靶向抑制Notch1参与AR进展。
经典免疫学说认为,AR是体外环境因素作用于机体导致Th1/Th2免疫失衡而引起的以鼻黏膜Th2免疫反应为主的变应性炎症反应[26]。近年越多的研究证实,其他T细胞亚群(如Th17/Treg)细胞)也参与过敏性疾病的免疫调节过程[27],在这些群体中,Treg细胞因其在抑制其他效应细胞和炎症细胞迁移和分化中的重要作用而被广泛研究[28]。资料显示,Notch1在AR患者中的表达与Foxp3的表达呈负相关[9]。而Foxp3是Treg的特征性标志,其表达水平直接影响Treg细胞的分化和功能[29]。此外,Th17特有转录因子为RORγt,与Treg细胞在功能上相互拮抗,多项研究证实Treg/Th17细胞失衡与AR发病密切相关,提示Notch1可能通过调节Treg和Th17细胞分化影响AR发病[30]。本研究给予小鼠鼻滴miR-149-5p激动剂agomir上调miR-149-5p的表达,结果发现miR-149-5p过表达可以降低促炎因子IL-6和Th17细胞分化相关转录因子RORγt的表达,升高抗炎因子IL-10和Treg细胞分化相关转录因子Foxp3的表达,表明miR-149-5p靶向抑制Notch1后,会影响Treg/Th17细胞平衡。
综上所述,在AR小鼠模型中,miR-149-5p可以靶向抑制Notch1表达,下调RORγt抑制Th17细胞分化,上调FoxP3促进Treg细胞分化,影响Treg/Th17免疫平衡,因此miR-149-5p可能为AR的治疗提供新的方向。
