沉默Linc00152对胰腺癌细胞MIA PaCa-2侵袭及迁移的影响*
2020-07-21何美玲杨喆戴研平雷珊高晓勤
何美玲,杨喆,戴研平,雷珊,高晓勤
(1.贵州医科大学 基础医学院,贵州 贵阳 550004;2.遵义医药高等专科学校,贵州 遵义 563006)
胰腺癌作为消化系统的恶性肿瘤,是发达国家癌症相关死亡的第四大病因,患者的总体5年生存率约为8%[1]。由于胰腺癌起病隐匿,早期不易被诊断,许多患者确诊时癌细胞已经发生了转移[2]。长链非编码RNA(long non-coding RNA,lncRNA)是一类转录本长度超过200个核苷酸的RNA分子,存在于细胞核或细胞质内,不能编码蛋白质,在各种肿瘤中异常表达[3]。研究表明,lncRNA Linc00152在乳腺癌组织和细胞中均高表达,下调Linc00152可显著抑制肿瘤的增殖和转移[4];Linc00152在胶质母细胞瘤中通过miR/AKT2/NF-κB在体内体外发挥致癌作用[5];Linc00152可直接与miR-193a/b-3p结合调节CCND1的表达,从而影响肝细胞癌的进展[6]。然而,有关Linc00152在胰腺癌中的生物学功能和潜在机制却鲜有报道。本研究通过敲低胰腺癌细胞株MIA PaCa-2中Linc00152表达,探讨Linc00152对胰腺癌细胞侵袭及迁移的影响,为治疗胰腺癌建立潜在的治疗靶点提供依据。
1 材料与方法
1.1实验材料和试剂
20例配对的人胰腺癌组织及相对应癌旁组织收集于华中科技大学附属同济医院胆胰科。胰腺癌细胞株MIA PaCa-2、BxPC-3、Capan2及人胰腺正常细胞HPDE均购于美国ATCC细胞库,高糖DMEM培养基、RPMI-1640培养基、胎牛血清(FBS)、转染用OPTI-MEM培养基购自美国Gibco公司,Matrigel 基质胶购自美国BD公司,RT试剂盒、PCR相关SYBRP及逆转录试剂盒购自鼎国生物有限公司,兔抗人单克隆抗体vimentin和N-cadherin及鼠抗人GAPDH单克隆抗体均购自武汉赛威尔生物技术有限公司,LipofectamineTM2000和相关转染试剂盒购自Invitrogen公司。Linc00152的沉默RNA(siRNA)、阴性对照序列(NC)、Linc00152及GAPDH上下游引物均由上海生工生物技术有限公司设计合成。
1.2方法
1.2.1细胞培养 将MIA PaCa-2细胞和HPDE培养于高糖DMEM培养基,BxPC-3细胞和Capan2细胞培养于RPMI-1640培养基,细胞均在10% 胎牛血清、5% CO2、37 ℃的条件下培养,每2 d更换1次新鲜培养基,细胞融合度达85%左右进行传代培养。
1.2.2Linc00152的相对表达量检测 采用逆转录实时荧光定量聚合酶链式反应(RT-qPCR)法检测,Trizol法提取人胰腺癌组织、癌旁组织或各细胞株中的总RNA,按试剂盒说明书操作。经70%乙醇洗涤后的RNA加无RNA酶双蒸水水稀释,测定RNA浓度及纯度。取总RNA 1 μg,根据Takara逆转录试剂盒进行逆转录反应,采用RT-q PCR法测定Linc00152的表达水平。本研究以GAPDH为内参照,Linc00152上游引物序列为5′-AAAATCACGACTCAGCCCCC-3′、下游引物序列为5′-AATGGGAAACCGACCAGACC-3′,GAPDH上游引物序列为5′-GGAGCGAGATCCCTCCAAAAT-3′、下游引物序列为5′-GGCTGTTGTCATACTTCTCATGG-3′,以2-ΔΔCt计算分析结果。选择Linc00152的相对表达水平最高的胰腺癌细胞株进进行下一步的研究。
1.2.3细胞转染及干扰效率检测 取对数生长期MIA PaCa-2细胞(Linc00152的相对表达水平最高)胰酶消化后重悬,调整密度接种于6孔板,待细胞融合65%左右时换液。将MIA PaCa-2细胞分为Linc00152沉默组和NC组,按LipofectamineTM2000转染试剂盒说明书进行转染,Linc00152沉默组转染si-RNA抑制序列沉默Linc00152的表达,NC组转染阴性对照序列(si-NC)作为对照(NC组)。si-RNA序列为TAGGCGATACGATGCTTTA-3′,si-NC序列为TAATCGCTACGATGCACTA-3′。转染6 h后换液,继续培养42 h后,步骤同1.2.2。
1.2.4沉默Linc00152后MIA PaCa-2侵袭与迁移的细胞数 采用Transwell实验检测,侵袭实验:取已经稀释过的magtrigel基质胶50 μL加入transwell小室,置于37 ℃培养箱30 min。调整2组转染后的细胞株MIA PaCa-2密度为2×107/L,取细胞悬液200 μL接种于铺有magtrigel的上室中。上室为无血清培养基,下室为20%胎牛血清完全培养基600 μL。培养箱中继续孵育24 h后,4%多聚甲醛固定,结晶紫染色,PBS 洗净后于100倍显微镜下拍照并记数。迁移实验步骤同侵袭实验但不加magtrigel。
1.2.5沉默Linc00152后MIA PaCa-2细胞的相对划痕愈合率 采用划痕实验检测,分别将2组转染后的细胞株MIA PaCa-2细胞铺板,36 h后200 μL枪头进行划痕(枪头经高压灭菌),PBS洗净3次,换无血清培养基后100倍显微镜下观察细胞迁移情况并拍照,37 ℃、5%CO2的培养箱继续培养48 h后再次拍照,测量图片中划痕宽度,计算相对划痕愈合率。相对划痕愈合率=(平均初始划痕宽度-平均终末划痕宽度)/平均初始划痕宽度×100%。
1.2.6沉默Linc00152后MIA PaCa-2细胞vimentin和N-cadherin蛋白表达 采用Western blot法检测,蛋白裂解液分别处理2组转染后的细胞株MIA PaCa-2后提取总蛋白,BAC法测定蛋白浓度,依次制胶、上样、电泳、PVDF转膜、洗转印膜后,5%的脱脂奶粉摇床上室温封闭2 h,加入一抗4 ℃过夜。TBST洗涤3次,将PVDF膜放入二抗中室温孵育2 h,加ECL化学发光液处理,曝光后进行图像处理和灰度分析。研究设GAPDH作为内参照。
1.3统计学处理
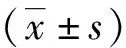
2 结果
2.1胰腺癌组织及胰腺癌细胞中Linc00152的表达水平
如图1所示,Linc00152在胰腺癌组织中表达显著高于相应的癌旁组织,差异有统计学意义(P<0.001);Linc00152在胰腺癌细胞株MIA PaCa-2、Bxpc-3及Capan2中的表达高于人胰腺正常HPDE细胞,差异具有统计学意义(P<0.05或P<0.01),且在MIA PaCa-2中表达最高。

注:与HPDE比较,(1)P<0.05;(2)P<0.01;(3)与Normal比较,P<0.001。
2.2转染si-RNA后MIA PaCa-2转染效率
沉默组转染si-RNA抑制序列沉默Linc00152表达MIA PaCa-2 48h后,结果显示,与NC组比较,Linc00152沉默组细胞中Linc00152表达明显降低,差异有统计学意义(P<0.01,图2)。表明成功转染Linc00152抑制序列下调了Linc00152的表达。

注:(1)与NC组比较,P<0.01。
2.3沉默Linc00152后MIA PaCa-2侵袭与迁移的细胞数
如图3显示,与NC组比较,沉默组侵袭及迁移的MIA PaCa-2细胞数目均明显减少,差异有统计学意义(P<0.01)。表明沉默Linc00152后胰腺癌MIA PaCa-2细胞的侵袭与迁移能力均减弱。
2.4沉默Linc00152后MIA PaCa-2细胞的相对划痕愈合率
如图4所示,沉默Linc00152 48h后,细胞的相对划痕愈合率明显比si-NC组降低,差异有统计学意义(P<0.01),表明沉默Linc00152后胰腺癌MIA PaCa-2细胞的迁移能力减弱。
2.5沉默Linc00152后MIA PaCa-2细胞vimentin及N-cadherin蛋白表达
Western blot结果显示,与NC组比较,沉默组MIA PaCa-2细胞vimentin及N-cadherin蛋白表达水平明显降低,差异有统计学意义(P<0.01)。见图5。

注:A为侵袭实验,B为迁移实验;(1)与NC组比较,P<0.01。

注:A为细胞划痕实验,B为相对划痕愈合率;(1)与NC组比较,P<0.01。

注:A为Western blot电泳结果,B为Western blot结果条形图;(1)与NC组比较,P<0.01。
3 讨论
胰腺癌是恶性程度最高的肿瘤之一,因其早期发现困难,且当前各种治疗效果有限,预后极差。虽然近年来临床手术及各种综合治疗方法有所改进,但患者5年生存率始终极低,其主要原因之一就是胰腺癌具有高度侵袭转移的恶性生物学特性,尽早明确胰腺癌侵袭转移的机制对改善其治疗现状非常必要。
LncRNA越来越受到研究者的广泛关注,研究表明,lncRNA与肿瘤的发生发展密切相关[7-11],并从多种途径上调控基因的表达水平,如转录调控、转录后调控以及表观遗传调控等[12-13]。有研究表明,Linc00152在卵巢癌细胞中下调能抑制卵巢癌细胞的细胞增殖[14],且Linc00152与多发性骨髓瘤的进展密切相关[15]。尽管Linc00152逐步被证实为多种人类恶性肿瘤形成的重要的基因表达调控器,但是其与胰腺癌侵袭、转移的关系却鲜有报道。
本研究通过RT-qPCR法检测Linc00152在胰腺癌组织及细胞中的表达,结果显示,与癌旁组织相比,Linc00152在胰腺癌组织中高表达;在几种胰腺癌细胞系中的表达情况与在胰腺癌组织中的表达情况一致,Linc00152在人正常胰腺细胞HPDE中呈低表达,而在胰腺癌细胞株MIA PaCa-2、BxPC-3及Capan2中均高表达,提示Linc00152可能参与胰腺癌的发生、发展。为了进一步研究Linc00152与胰腺癌进展的关系,本研究选择Linc00152相对表达量最高的胰腺癌细胞MIA PaCa-2作为研究细胞,通过在该细胞中沉默Linc00152表达,采用Transwell实验观察MIA PaCa-2细胞的侵袭和转移数目、采用细胞划痕实验观察MIA PaCa-2细胞的相对划痕愈合率,结果显示,沉默Linc00152后,MIA PaCa-2细胞侵袭与迁移的细胞数目均明显减少,提示沉默Linc00152可显著抑制胰腺癌细胞的迁移和侵袭。上皮间质转换(EMT)是一种赋予上皮肿瘤细胞间充质特性的过程,包括黏附性降低和运动性增加,是驱动癌症侵袭转移的重要过程,已有研究证明EMT参与肿瘤转移[16-17]。N-cadherin的异常调节与各种肿瘤的转移密切相关[18-19],vimentin是一种上皮-间质转化的中间纤维,研究证明可促进间充质细胞的迁移[20],这2个间充质标志物的增加在肿瘤转移和组织分化以及成体组织器官构成具有重要作用。为了深入了解沉默Linc00152对细胞侵袭调节的分子机制,对沉默Linc00152后胰腺癌MIA PaCa-2细胞进行了Western blot分析,结果发现沉默Linc00152可显著下调胰腺癌MIA PaCa-2细胞中vimentin及N-cadherin的表达,提示沉默Linc00152能抑制EMT进程。且同时结合Transwell小室实验和划痕实验结果,提示沉默Linc00152可能是通过下调vimentin、N-cadherin的表达从而抑制EMT进程来抑制胰腺癌的侵袭和迁移。
综上所述,本研究通过一系列体外实验确定了Linc00152对胰腺癌生物学行为的影响,结果发现沉默Linc00152可显著抑制胰腺癌细胞的体外侵袭和迁移,机制可能与vimentin和N-cadherin的表达下调有关。
