鱼腥草挥发油对多柔比星致大鼠心肌损伤的保护机制
2020-07-21吴文英尹术华宋也好李文娟
吴文英,尹术华,李 露,宋也好,李文娟
(南昌大学食品学院,江西南昌 330000)
鱼腥草(heartleaf houttuynia herb)属三白草科蕺菜的干燥地上部分,是一种药食同源的传统食材[1],在食品、药品等方面有很大的开发前景。鱼腥草化学成分较为繁多,主要由生物碱、有机酸、挥发油、多糖等多种成分组成。在这些活性成分中,鱼腥草挥发油(heartleaf houttuynia herb essential oil,HHO)被认为是其主要活性成分,主要包括甲基正壬酮、乙酸龙脑酯、棕榈酸、正癸酸等;具有抗炎、抗氧化、抗菌、抗病毒、抗肿瘤、增加免疫力等多种生物活性功能[2]。目前,房芸等[3]研究发现鱼腥草挥发油对糖尿病小鼠心肌损伤有一定的保护作用;临床上,含鱼腥草挥发油的注射液用于治疗病毒性心肌炎,可减轻病毒对心肌细胞损害,调节免疫功能,提高心脏功能,针对病毒性心肌炎及心源性休克患者[4-5]。此外,已有研究发现鱼腥草挥发油对大鼠心肌缺血再灌注损伤具有较好的保护作用[6],证实鱼腥草挥发油可能对心脏具有较好的保护作用。迈入21世纪,疾病模式已发生转变,肿瘤已经成为危害全球健康的重要杀手[7]。多柔比星(doxorubicin,DOX)是一种广谱高效抗肿瘤药物,临床疗效显著,但其严重的心脏毒性使得其应用受到了很大的限制[8]。食源性组分鱼腥草挥发油前期研究显示具有心肌保护作用,然而对DOX所致的心肌损伤的影响仍需进一步研究。
因此,本实验提取了鱼腥草挥发油,通过气相色谱质谱法(GS-MS)自带NIST库并结合保留指数鉴定其化学成分,应用SD大鼠建立DOX心肌损伤模型,研究鱼腥草挥发油对抗肿瘤药物DOX所致的心肌损伤的影响及相关作用机理。
1 材料与方法
1.1 材料与方法
鱼腥草干叶 市售;DOX 深圳万乐药业有限公司;乙醇 分析纯,西陇化工股份有限公司;维生素E(VE)、DPPH、BHT 美国Sigma公司;BCA蛋白浓度测定试剂盒 上海碧云天公司;LDH试剂盒、CAT试剂盒、MDA试剂盒 南京建成生物工程研究所有限公司;SD大鼠 (180±20) g 60只,雄性,湖南斯莱克景达实验动物有限公司,使用许可证:SCXK(湘)2016-0002。
安捷伦7890-5975气相色谱-质谱联用仪 美国Agilent公司;3K15-冷冻离心机 美国Sigma公司;SHP-150生化培养箱 上海森信实验仪器有限公司;AL-104电子天平 梅特勒-托利多仪器上海有限公司;Thermo 3001 Varioskan Flash全波长多功能酶标仪 美国Thermo公司;Milli-Q超纯水仪 美国Millipore公司;SKM型数显恒温电热套 山东鄄城华鲁电热仪器有限公司。
1.2 实验方法
1.2.1 鱼腥草挥发油的提取 参照2010年版中国药典一部附录X D挥发油测定法(甲法)提取挥发油[9],并结合文献[10]确定水蒸气蒸馏法提取鱼腥草挥发油的最佳工艺条件:鱼腥草经粉碎机粉碎成粗粉,室温下浸泡蒸馏水中10 h,料液比为1∶10,加热回流10 h。将干燥鱼腥草粉碎后,称取100 g燥鱼腥草粉末,装入2000 mL圆底烧瓶中,加蒸馏水1000 mL,混匀并浸泡10 h后,连接挥发油测定器与回流冷凝管。将整套装置放置于SKM型数显恒温电热套中,温度设置220 ℃,达到微沸状态,并保持微沸10 h,加热回流10 h后停止加热,收集挥发油。
1.2.2 鱼腥草挥发油的成分分析 采用GC-MS进行鱼腥草挥发油的成分分析[11]。精密量取1.2.1中提取得到的鱼腥草挥发油7.5 μL,加1.5 mL正己烷,并用无水硫酸钠除水,4 ℃、5000 r/min离心10 min,得到体积分数0.5%的鱼腥草挥发油待测液,通过0.22 μm有机滤膜过滤后直接进样分析。正构烷烃(C7-C30)用正己烷稀释过膜后直接进样。
GC条件:HP-5MS毛细管色谱柱(0.25 μm×250 μm×30 m),载气为高纯氦气,柱流量1.0 mL/min,进样量1 μL,分流进样,分流比20∶1,进样口温度280 ℃,升温程序:0~2 min,初温70 ℃保持2 min;2~5 min,10 ℃/min 升至100 ℃;5~16.5 min,2 ℃/min升至123 ℃;16.5~19.5 min,123 ℃保持3 min,19.5~26.9,5 ℃/min升至160 ℃;26.9~32.9 min,10 ℃/min升至220 ℃;32.9~37.9 min,2 ℃/min升至230 ℃;37.0~42.9 min,230 ℃保持5 min。
MS条件:接口温度280 ℃,电离方式为EI电离,电离能量70 eV,离子源温度230 ℃,MS四级杆温度150 ℃,溶剂延迟3 min,扫描质量范围:质荷比20~500 amu。
鱼腥草挥发油成分保留指数的测定:保留指数计算公式为[12-13]:
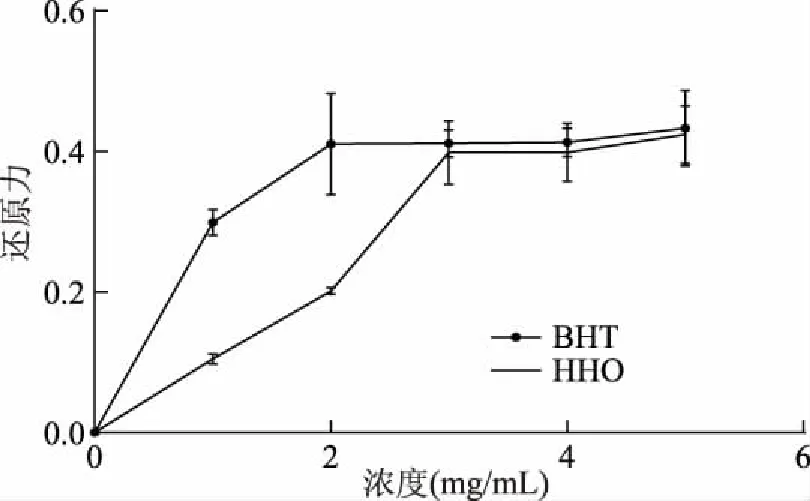
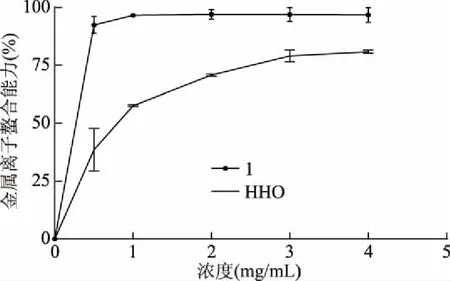
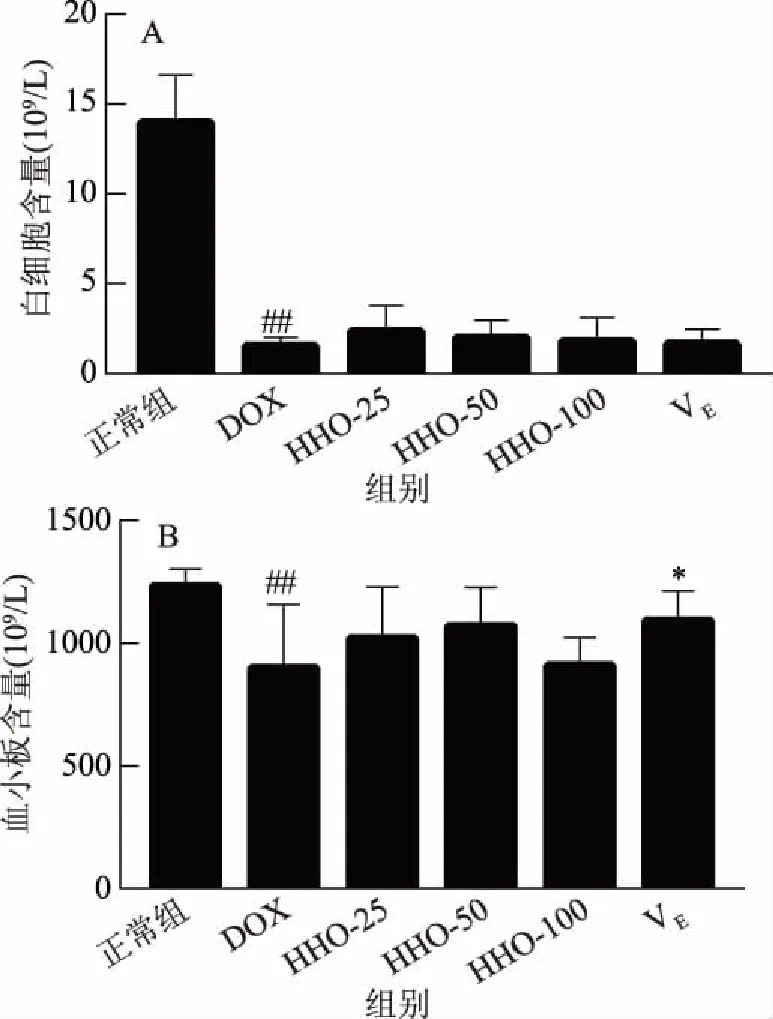
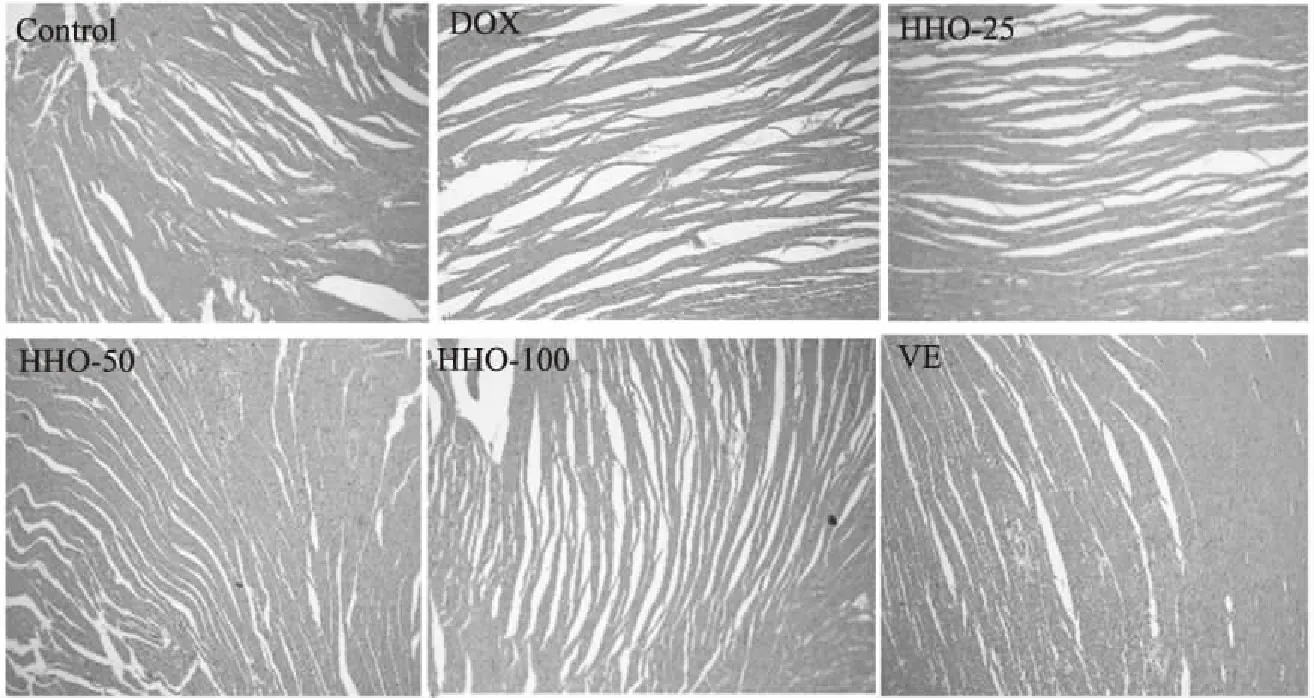
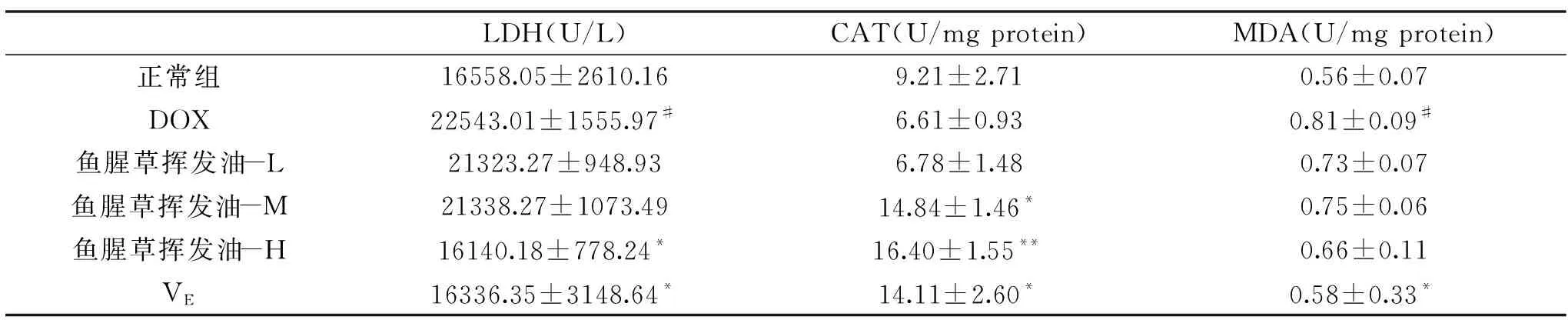
式中:RI为待测组分的保留指数;TRx为待测组分鱼腥草挥发油的保留时间;TRn和TRn+1为正构烷烃的保留时间;n和n+1分别表示正构烷烃的碳原子数;TRn 1.2.3 鱼腥草挥发油抗氧化活性的测定 1.2.3.1 对DPPH自由基的清除作用 实验参照文献略作改动[14],精密称量4.0 mg DPPH用95%乙醇溶解并定容于50 mL棕色容量瓶中,配成浓度为 2×10-4mol/L的DPPH溶液,现配现用。鱼腥草挥发油/BHT用无水乙醇稀释为0.5、1.0、5.0、10.0、15.0和20.0 mg/mL鱼腥草挥发油/BHT待测液,实验分为样品组、对照组、空白组。样品组:取0.2 mL DPPH溶液,加入0.05 mL鱼腥草挥发油/BHT待测液(0.5、1.0、5.0、10.0、15.0和20.0 mg/mL)及0.05 mL乙醇加入具塞试管中,摇匀。在避光条件下反应30 min后在517 nm下测定吸光度值A2;对照组:取0.2 mL乙醇,加入0.05 mL鱼腥草挥发油/BHT待测液(0.5、1.0、5.0、10.0、15.0和20.0 mg/mL)及0.05 mL乙醇加入具塞试管中,摇匀。在避光条件下反应30 min 后在517 nm下测定吸光度值A1;空白组:测定 0.2 mL DPPH溶液与0.1 mL无水乙醇混合液的吸光度A0,根据下列公式计算DPPH自由基清除率。 其中:I 表示清除率;A2为 0.2 mL DPPH溶液+0.05 mL鱼腥草挥发油/BHT+0.05 mL乙醇的吸光度值;A1为0.2 mL乙醇+0.05 mL鱼腥草挥发油/BHT+0.05 mL乙醇的吸光度值;A0为 0.2 mL DPPH溶液+0.1 mL乙醇的吸光度值。 1.2.3.2 还原力的测定 实验参照文献略作改动[15-16],测定前将鱼腥草挥发油/BHT用无水乙醇稀释成1.0、2.0、3.0、4.0和5.0 mg/mL浓度的鱼腥草挥发油/BHT待测液。准确移取1.0 mL 上述已配好的不同浓度的鱼腥草挥发油/BHT待测液于洁净干燥的试管中,加入0.2 mol/L磷酸盐缓冲液1.25 mL(pH=6.6)和1%的铁氰化钾溶液1.25 mL,充分混匀后于50 ℃ 恒温水浴箱中20 min,取出用流水使其快速冷却,加入1.0 mL 10%的三氯乙酸,3000 r/min 的转速离心10 min,取部分上清液0.5 mL,加入0.1%的三氯化铁溶液0.25 mL,再移取1.75 mL的蒸馏水,充分混匀后反应10 min,在吸光度为700 nm处测定其吸光度A。各组均按上述方法重复测量三次,记录吸光度值为A。 1.2.3.3 金属离子螯合能力 实验参照文献略作改动[17],实验分为样品组、对照组、空白组。鱼腥草挥发油/乙二胺四乙酸二钠用无水乙醇/双蒸水稀释成0.5、1.0、2.0、3.0和4.0 mg/mL浓度的鱼腥草挥发油/乙二胺四乙酸二钠待测液。操作步骤:样品组:取0.2 mL不同浓度的鱼腥草挥发油/乙二胺四乙酸二钠待测液于10 mL EP管中,分别加入50 μmol/L的FeSO4溶液0.2 mL和0.15 mol/L的NaCl溶液1.4 mL,再加入300 μmol/L的菲啰嗪0.2 mL后,涡旋混匀5 s,室温放置10 min,在562 nm处测定的吸光值为A2。空白组:用上述NaCl溶液代替菲咯嗪,测定吸光度A1。对照组:用蒸馏水代替鱼腥草挥发油/乙二胺四乙酸二钠待测液,测定对照管吸光度为A0。根据公式计算样品对金属铁离子的螯合活性。 其中:I金属铁离子的螯合活性;A2为样品组的吸光度值;A1为空白组的吸光度值;A0为对照组的吸光度值。 1.2.4 鱼腥草挥发油对DOX致大鼠心肌损伤的影响 1.2.4.1 鱼腥草挥发油对DOX诱导的心肌损伤模型的建立 实验分组(每组10只):生理盐水组(Control)、DOX组(DOX)、挥发油25 mg/kg+DOX组(HHO-25)、挥发油50 mg/kg+DOX组(HHO-50),挥发油100 mg/kg+DOX组(HHO-100)、VE 500 mg/kg+DOX组(VE);鱼腥草挥发油的剂量参照文献[18-19]。挥发油及VE处理:精密量取挥发油,以吐温-80作乳化剂,将其溶于生理盐水中,配成含0.5%吐温-80的挥发油储备液,临用前将母液稀释至适宜的浓度。挥发油低中高剂量分别为25、50和25 mg/kg。模型建立[20]:实验大鼠适应一周后,开始建立DOX心肌损伤模型,第1 d,生理盐水组和DOX组灌胃生理盐水,其他组灌胃相对应的鱼腥草挥发油或VE;第2 d,DOX组,挥发油低剂量+DOX组,挥发油中剂量+DOX组,挥发油高剂量+DOX组,VE+DOX组腹腔注射DOX 20 mg/kg,生理盐水组注射同剂量的生理盐水;第3和4 d灌胃方式与第1 d相同。第5 d眼球取血,处死大鼠,取肠内容物和心脏组织。 1.2.4.2 大鼠体质量的测定 动物房内温度维持在(22±2) ℃,湿度维持在55%±5%。模型建立开始前SD大鼠适应饲养1周,期间取食饮水自由,同时采用调节灯光的照明时间来达到12 h昼、12 h夜交替的条件。实验大鼠适应一周后,模型建立第一天开始每天称重,记录大鼠体质量变化。 1.2.4.3 大鼠全血血常规的测定 参照文献[21],实验结束后对大鼠进行摘眼球取血,将全血滴在含EDTA抗凝采血管中,充分混匀后,使用全自动血细胞分析仪(system-800i)进行血常规检查,并记录血液中白细胞和血小板。 1.2.4.4 心脏组织HE染色 实验结束收集心脏,生理盐水洗净,滤纸吸取表面残液,纵切取一半心脏组织用10%中性福尔马林缓冲液固定。制作心脏组织HE染色,切片脱蜡、切片复水、苏木素染色、伊红染色、脱水封片,再用倒置显微镜进行拍照。 1.2.4.5 血清中LDH活力的测定 对大鼠进行摘眼球取血,室温静置2 h,室温3000 r/min离心10 min,收集血清。然后使用BCA蛋白浓度测定试剂盒测定蛋白含量;使用LDH试剂盒测定LDH活力(U/L)。 1.2.4.6 心脏组织CAT和MDA的测定 分离大鼠心脏,制备10%心肌组织匀浆,严格按照CAT和MDA试剂盒说明书检测CAT活力和MDA含量,并使用BCA蛋白定量测定法检测蛋白质质量浓度。 1.2.4.7 大鼠盲肠内容物短链脂肪酸(SCFAs)的测定 绘制标准曲线:参照Hu等[22]已建立的色谱分析条件和方法,称取适量乙酸、丙酸、正丁酸、异丁酸、正戊酸、异戊酸等标准品于容量瓶中,定容混匀,配置成梯度混合溶液,根据对应质量浓度的色谱图,计算数据并绘制短链脂肪酸标准曲线。SCFAs的测定:准确称取100 mg盲肠内容物,冰浴操作,加入超纯水(1∶9 w/v),涡旋致充分混匀,置于超声仪超声10 min后,再冰浴静置15 min,离心(4800 g,4 ℃)20 min后吸取上清液,过0.22 μm水系滤膜,用于Agilent 7890B气相色谱仪测定,导出样品对应SCFAs峰面积,根据短链脂肪酸峰面积与浓度的标准曲线计算各样品中脂肪酸的浓度。 实验组数据用平均值±标准偏差(M±SD)的形式表示,采用SPSS 23.0软件进行统计学分析。P<0.05时,表示与比较组存在显著差异,P<0.01表示与比较组差异极显著。 正构烷烃与鱼腥草挥发油的总离子流色谱图见图1,确定鱼腥草挥发油中28种化学成分,鱼腥草挥发油的成分种类非常复杂,分析结果见表1。萜类化合物为挥发油的主要成分,具有消炎、抗菌、镇痛、及抗肿瘤等生物活性[23]。本文将28种挥发性组分进行分类,其中单萜有:(-)-4-萜品醇、α-松油醇、橙花醇、乙酸龙脑酯;倍半萜:石竹烯和氧化石竹烯;非萜类化合物:正壬醇、癸醛、壬酸、甲基正壬酮、十一醇、癸酸甲酯、正癸酸、十二酮、十一烷酸、十三酮、正十二烷酸、Espatulenol、十四酸、6,10,14-三甲基-2-十五烷酮、3,5,11,15-四甲基-3-十六烯醇、棕榈酸、棕榈酸正壬酯、十八醇、(Z,Z)-9,12-十八烷二烯酸甲酯、(E)-3,7,11,15-四甲基-2-十六碳烯-1-醇、亚麻酸、硬脂酸。用面积归一法计算各化学成分在挥发油中的相对百分含量,鉴定的主要成分有癸酸(35.63%)、棕榈酸(22.64%)、甲基正壬酮(10.42%)和乙酸龙脑酯(9.95%)等。根据文献报道[24],用水蒸气蒸馏法鉴定出的鱼腥草挥发油的主要成分有:甲基正壬酮、癸酸和乙酸龙脑酯等,和本实验鉴定出的主要成分相似,但主要成分含量有一定的差异,可能与产地、采收季节和存储时间有关。 表1 鱼腥草中挥发油化学成分及百分含量 Table 1 Chemical constituents and content of Heartleaf houttuynia herb essential oil 图1 正构烷烃、鱼腥草挥发油的总离子流色谱图Fig.1 Total ion flow chromatography of the n-alkane and Heartleaf houttuynia herb essential oil注:A:正构烷烃的总离子流色谱图;B:鱼腥草挥发油的总离子流色谱图。 2.2.1 对DPPH自由基的清除作用 考察了鱼腥草挥发油在质量浓度为0.5、1.0、5.0、10.0、15.0和20.0 mg/mL的DPPH自由基清除能力,并与阳性对照BHT作对比。结果表明,鱼腥草挥发油具有良好的清除DPPH自由基能力,且呈现出一定的剂量效应关系如图2所示,其清除DPPH自由基能力随着浓度的升高而增大。 图2 DPPH自由基清除作用Fig.2 DPPH free radical scavenging effect 2.2.2 还原力的测定 测得吸光度的值大小决定化合物还原力的强弱,如图3所示,当浓度为1~5 mg/mL时,鱼腥草挥发油对Fe3+的还原力随着浓度的增加而明显升高,说明该样品的还原力具有较强的浓度依赖性,可知鱼腥草挥发油具有较强的还原力。 图3 还原力的测定Fig.3 Reduction force determination 2.2.3 金属离子螯合能力 如图4所示,当浓度为0.5~4 mg/mL时,鱼腥草挥发油对亚铁离子螯合能力随着浓度的增加而明显升高,当浓度为4 mg/mL时,达到最大值,可知鱼腥草挥发油具有很好的螯合亚铁离子能力。 图4 金属离子螯合能力Fig.4 Chelating ability of metal ions 2.3.1 挥发油对DOX致心肌损伤大鼠体质量的影响 在心肌损伤过程中,大鼠体重变化情况是反映其健康状况的重要指标之一。体质量变化如图5所示,图5A是模型建立第1 d和第5 d的大鼠体质量,可以看出给予DOX的各组(DOX组、VE组、鱼腥草挥发油-25、-50、和-100组)大鼠体重均降低,图5B可以看出,模型组与正常组相比,大鼠体质量有极显著差异(P<0.01)。实验进程中,正常组大鼠体质量增加,而模型组体质量降低。统计学分析发现最后DOX组、VE组、鱼腥草挥发油-25、-50、和-100组的组间体重变化无显著性差异。这些结果表明DOX可引起体质量的下降,给予鱼腥草挥发油后对DOX引起的体重变化无显著影响。 图5 大鼠体质量的变化Fig.5 Changes of body mass in rats注:图A为第1 d和第5 d体质量;图B为第1 d和第5 d体质量差。与对照组比较,##表示P<0.01。 2.3.2 挥发油对DOX致心肌损伤大鼠血常规的影响 数据显示,与正常组相比,大鼠给予DOX后,表现为血小板及白细胞极显著减少(图6)。与模型组相比,大鼠给予鱼腥草挥发油后,各组白细胞和血小板有所上升,但无显著性差异,VE组血小板含量显著升高(P<0.05)。这些结果提示,鱼腥草挥发油对DOX引起的血生化紊乱无显著保护作用。 图6 大鼠血常规指标Fig.6 The routine index of rat blood注:图A为白细胞的含量;图B为血小板的含量。与对照组比较,##表示P<0.01;与模型组相比,*表示P<0.05。 2.3.3 挥发油对DOX致心肌损伤大鼠心脏微观结构的影响 心脏组织的组织病理学检查是为了进一步说明DOX诱导的心脏毒性。 本实验利用HE染色的方式,利用倒置显微镜观察心脏组织切片病理结构,观察视野如图7所示,正常组显示了正常心肌束的结构,心脏结构整齐,心肌纤维排列整齐,结构清晰且正常。模型组心肌纤维明显断裂,心肌细胞有肿胀反应,结构破坏较明显;而与模型组相比,挥发油低中高剂量组和阳性对照VE组心肌纤维排列明显整齐,纤维断裂减少,心脏结构趋于完整。综上所述,鱼腥草挥发油能有效促进DOX诱导的心肌损伤模型大鼠中心脏组织形态趋于正常化,具有心肌保护作用。 图7 大鼠心脏组织切片病理学观察(HE,×40)Fig.7 Pathological observation of rat heart biopsy(HE,×40) 2.3.4 鱼腥草挥发油对DOX损伤的心肌细胞的影响 乳酸脱氢酶(LDH)是一种常见的心肌酶,它能催化乳酸和丙酮酸之间的相互转化[47],其作为心肌诊断的标记物广泛应用于心肌损伤研究中。从表2可以看出,经DOX处理过的大鼠,其血清中LDH活力显著高于正常对照组(P<0.05),说明DOX对大鼠心肌组织损伤严重;而与模型组相比,VE阳性对照LDH活力降低(P<0.05),同时,给予鱼腥草挥发油各组LDH的活力降低,随挥发油剂量的增加而下降,鱼腥草挥发油高剂量组(P<0.05)效果最好。 表2 大鼠体内CAT、MDA和LDH的含量Table 2 Contents of CAT,MDA and LDH in rats 2.3.5 心脏组织CAT和MDA的测定 CAT能将H2O2分解成H2O和O2,使得H2O2不至于与O2在铁螯合物作用下反应生成非常有害的-OH,MDA是脂质过氧化的重要产物。如表2所示,与正常对照组相比,模型组大鼠心脏组织中CAT活性降低(P>0.05),而MDA含量升高(P<0.05);与模型组相比,中和高剂量组大鼠心脏组织中CAT活性上升(P<0.05),同时伴随着MDA含量下降但无统计学意义。另外,VE组MDA含量显著降低且CAT活性显著增加(P<0.05)。这些结果提示鱼腥草挥发油的心肌保护作用与其提高大鼠抗氧化防御能力有关。 2.3.6 鱼腥草挥发油对大鼠肠道中SCFAs的影响 SCFAs是指碳原子数目不大于6的脂肪酸,在肠道中以乙酸、丙酸和异丁酸含量居高。在生物体内SCFAs能够提供能量、调节免疫功能且对肠道细胞代谢起调控作用。本实验中各组大鼠盲肠内容物中SCFAs的含量如图8所示。与正常组相比,DOX组中乙酸、丙酸和正戊酸的浓度极显著下降(P<0.01)。与模型组相比,VE组异丁酸和异戊酸含量极显著增加(P<0.01)。然而,统计学分析显示,与模型组相比,鱼腥草挥发油各组中SCFAs的含量无显著差异,显示该挥发油对SCFAs无显著调控作用。 图8 鱼腥草挥发油对DOX诱导性心肌损伤大鼠盲肠内容物SCFAs的影响Fig.8 Effect of HHO on SCFAs of caecum contents in dox-induced myocardial injury in rats注:A为乙酸的浓度,B为丙酸的浓度,C为异丁酸的浓度,D为异戊酸的浓度,E为正戊酸的浓度;与正常组相比:#表示P<0.05,##表示P<0.01;与模型组相比:**表示P<0.01。 本实验通过水蒸气蒸馏法提取鱼腥草挥发油,GC-MS化学成分鉴定显示含有28种物质,含有萜类化合物、酯类化合物、烯烃、醇类化合物等。据报道,鱼腥草挥发油的成分主要有甲基正壬酮、月桂烯、月桂醛、葵醛和癸酸[24],而本试验所提取的鱼腥草挥发油未见月桂烯和月桂醛成分,这可能与产地、气候、土壤、采收季节、加工方法、储存时间、晒干粉碎程度等因素有关。吕都等[48]报道了鱼腥草挥发油的抗氧化活性;通过鱼腥草挥发油对清除DPPH自由基、还原力的测定和铁离子螯合能力的测定,本实验结果验证了鱼腥草挥发油具有较好的抗氧化活性。查丽[49]发现新鱼腥草素钠注射液则能清热解毒、活血化瘀,为抗病毒、消炎、解热之有效药物,且能促进肾上腺皮质功能,抗氧自由基损伤,抗血小板聚集,保护心肌细胞。然而,鱼腥草挥发油对DOX导致的心肌损伤是否有保护作用尚未见报道。因此,本实验通过腹腔注射DOX建立大鼠心肌损伤模型,研究鱼腥草挥发油对DOX诱导的大鼠心肌损伤的影响。 LDH作为心肌损伤的标志酶,在心肌损伤的进程中,表现为血清中LDH水平显著升高。本研究结果显示,与正常组相比,DOX组的大鼠血清中LDH的活性显著增加,表明大鼠的心肌受损。HE形态学观察显示大鼠腹腔注射DOX后,心肌正常结构遭到破坏。然而,DOX建立心肌损伤实验模型的过程中,同时给予鱼腥草挥发油处理后,与DOX组相比,大鼠血清中LDH活性显著下降,并且HE形态学观察显示鱼腥草挥发油能抑制DOX引起的心肌形态改变,使心肌的形态趋于正常化。这些表明鱼腥草挥发油对DOX导致的大鼠心肌损伤具有一定的保护作用,能减轻DOX介导的心脏毒性。 DOX引起心脏毒性的作用机制较为复杂,涉及到多种途径的共同作用与相互影响。在当前的研究中,以自由基反应为基础的氧化应激学说被认为是DOX致心脏毒性的重要机制[50]。于静等[51]表明具有抗氧化等作用的中药都可能对防治DOX心脏毒性有一定效果。本研究中MDA的数据显示,与正常组相比,DOX组中MAD含量显著增加,其抗氧化物酶CAT活性显著下降。进一步数据显示,鱼腥草挥发油处理大鼠后,可增加大鼠心肌组织的抗氧化防御能力,减少MDA的含量,抑制DOX介导的氧化应激的形成。同时,VE具有很强的抗氧化性,本实验数据显示大鼠给予VE后,可减轻DOX导致心肌组织的氧化应激,具有心肌保护作用。结合前期体外抗氧化实验显示,鱼腥草挥发油具有较好的抗氧化能力,这些数据表明鱼腥草挥发油的心肌保护作用的作用机理与自身的抗氧化能力密不可分。最后,根据前人研究[48,52]和本实验中的GC-MS化学成分分析,提示鱼腥草挥发油的抗氧化能力与该挥发油中主要成分有萜类化合物、脂类化合物、烯烃及醇类化合物有关。此外,已有研究发现除了抗氧化活性,鱼腥草挥发油被证实具有抗炎以及调节血脂等广泛的生物学效应[49]。众所周知,心血管疾病的病因隐匿,病程复杂,因此鱼腥草挥发油的心肌保护作用的关键机理及其靶标仍需进一步研究。最近,肠道微生物相关的研究掀起了新热潮,科学家在做抗肿瘤毒副作用研究的同时,已证实DOX对肠道内环境的危害[53]。因此,本实验进一步开展了肠道的微生物关键代谢产物SCFAs的含量研究,与正常组相比,模型组乙酸、丙酸、异丁酸、戊酸的浓度显著降低,表明DOX可引起大鼠肠道功能的下降。与模型组相比,鱼腥草挥发油各组中SCFAs含量略有增加,但无统计学意义。探究其原因:a.可能没有肠道保护作用;b.鱼腥草挥发油不属于膳食纤维,且分子量不大,在肠道中停留的时间很短;另一方面鱼腥草挥发油在体内产生的生物效能,在各个脏器中的时间周期性具有差异;本实验周期为4 d,有可能在短时间内不能高效调控SCFAs的生成。 总而言之,鱼腥草挥发油对DOX所致的大鼠心肌损伤有一定的保护作用,究其原因与鱼腥草挥发油能有效降低心肌组织氧化应激,提高抗氧化防御功能有关。本实验结果对鱼腥草挥发油开发成为新一代的防治疾病尤其是针对心血管和肿瘤的功能食品将有重要的应用价值,而且也对诠释鱼腥草的心肌保护作用有着非常积极的意义。1.3 数据处理
2 结果与分析
2.1 鱼腥草挥发油GC-MS化学成分鉴定


2.2 鱼腥草挥发油抗氧化实验

2.3 鱼腥草挥发油对DOX致大鼠心肌损伤的影响


3 讨论
