磷酸二氢钙对玉米秆灰熔融烧结特性的影响研究
2020-07-21朱有健张显显陈奕名吴学红杨海平陈汉平
朱有健,张显显,陈奕名,吴学红,杨海平,陈汉平
(1 郑州轻工业大学能源与动力工程学院,河南郑州450002; 2 华中科技大学煤燃烧国家重点实验室,湖北武汉430074)
引 言
我国秸秆资源储量丰富,每年新增秸秆量约10亿吨,其中玉米秆占约1/3。玉米秆等农作物秸秆在供热和发电领域的应用可有效推动秸秆类生物质的能源化利用,解决当前秸秆处置不当造成的各类环境问题[1]。但玉米秆中富含碱金属和硅等无机组分,在燃烧过程中易形成低熔点碱金属硅酸盐,造成灰熔融烧结等问题,严重危害锅炉的连续稳定运行[2-3]。
在燃料中掺混添加剂是一种经济高效的方式,可缓解锅炉灰熔融烧结问题。当前常见添加剂包括钙基、硫基、硅铝基和磷基添加剂[4]。其中硅铝基添加剂广泛应用于各类燃煤装置中[5]。但前期研究[6]发现在燃烧温度为800~1000℃时,高岭土和膨润土等硅铝基添加剂与玉米秆中碱金属反应活性低,对粉尘排放和灰熔融烧结的改善作用不佳。此外,Wang 等[7]的研究表明当温度高于1100℃时高岭土与碱金属的反应基本可达到平衡,而在800~900℃时二者反应程度要远低于平衡值。而生物质燃烧温度通常为800~1000℃,硅铝基添加剂在该温度范围内对生物质灰熔融改善特性表现不佳。因此需进行深入研究,探寻更为合适的添加剂以缓解生物质燃烧过程中的灰熔融烧结问题。
根据热化学平衡分析可知,磷基添加剂相比于硅铝基添加剂具有更高的碱金属反应活性[8],且燃烧后所得灰分富含磷钾等营养元素有利于灰分的后续循环利用,近年来在生物质燃烧中的应用受到愈来愈多的关注。以往文献[9-10]表明NH4H2PO4可与碱金属盐反应生成高熔点K2CaP2O7等磷酸盐,降低KCl 向气相中迁移并提高生物质灰熔点。李琳娜等[11]指出在麦秆中添加三种含磷添加剂NH4H2PO4、Ca(H2PO4)2·H2O 和Ca3(PO4)2能 反 应 生 成 高 熔 点CaK2P2O7、Ca10K(PO4)7等物质抑制麦秆底灰发生烧结。相对于NH4H2PO4和Ca(H2PO4)2·H2O,Ca3(PO4)2与碱金属的反应活性偏低[11]。此外,Grimm等[12]的研究表明磷酸对生物质灰熔点的提升效果与燃料特性尤其是灰分中(Ca+Mg)/(Na+K)比例密切相关,秸秆生物质中碱金属含量高,使用磷酸或磷酸二氢铵等添加剂时易生成富钾的磷酸盐和硅酸盐共融物,在特定情况下甚至会加剧灰熔融烧结[13]。
虽然现有研究表明[14]Ca(H2PO4)2·H2O 对改善生物质灰灰熔融效果要优于NH4H2PO4,可在一定程度上缓解生物质燃烧灰熔融烧结问题。但生物质中钾形态复杂,主要以水溶性和有机结合态钾存在,同时含有一定量的酸溶性及难溶性钾[15-16]。在燃烧过程中,不同形态钾的转化路径及其与灰分中无机矿物质的反应活性并不相同。当前磷酸二氢钙与生物质中钾盐在不同温度及不同添加比例条件下的反应产物和机理还不明确。此外,磷酸二氢钙的添加比例对玉米秆等秸秆生物质灰熔融烧结特性的影响也无相关研究。因此本文使用两种钾盐氯化钾/碳酸钾作为不同形态碱金属模化物,研究在200~900℃加热条件下磷酸二氢钙与两种钾盐的反应产物和形成机理。在此基础上,选取我国北方典型农业秸秆玉米秆为原料,研究磷酸二氢钙对玉米秆灰熔融烧结特性的影响。论文研究成果可为秸秆生物质燃烧过程中磷基添加剂的优选和反应条件的调控提供指导。
1 实验部分
1.1 实验原料
选取我国典型农业秸秆玉米秆(cornstalk,CS)为研究对象。原料经研磨、筛分后选择粒径为150~250 μm 样品,置于105℃恒温干燥箱内干燥12 h 后取出备用。玉米秆的工业分析、元素分析和热值见表1,灰化学组分见表2。选取KCl 和K2CO3(分析纯)分别作为玉米秆中水溶性和有机结合钾的模型化合物,二者均购买于上海麦克林有限公司。Ca(H2PO4)2·H2O(calcium phosphate monobasic,CPM,分析纯)购买于上海阿拉丁试剂有限公司。实验前将所有化学试剂研磨并筛分获得粒径为150~250 μm样品,置于50℃的恒温干燥箱内干燥12 h。玉米秆与Ca(H2PO4)2·H2O 按照P/K 摩尔比=1/2、1 和2 的比例进行机械混合,所得样品分别标记为CS+CPM1/2、CS+CPM1和CS+CPM2。

表1 玉米秆的工业分析、元素分析及热值Table 1 Proximate,ultimate analysis and HHV of CS

表2 玉米秆灰化学组分结果Table 2 Chemical composition of CS ash/%(mass)
1.2 模型化合物反应实验
将Ca(H2PO4)2·H2O 与KCl、K2CO3按 照P/K 摩 尔比为1/2、1、2 的比例混合均匀。使用如图1 中的固定床实验装置在空气气氛下进行加热反应,反应温度为200~900℃。反应器以10℃/min 升温速率从室温升至指定温度后,使用进样枪将样品快速推至反应器恒温区并停留1 h。实验结束后将样品冷却至室温后取出。使用电子天平(OHAUX CP213,America)称量反应前后样品的质量并利用式(1)计算样品的失重率。

式中,α表示失重率,%;m0、m1、m2分别表示钾盐、磷酸二氢钙以及二者反应后的质量,g。
1.3 灰熔融特性测试

图1 固定床实验系统示意图Fig.1 Schematic diagram of fixed bed system
根据标准GB/T 219—2008 使用灰熔点仪(5EAFⅡ,湖南长沙)测试磷酸二氢钙对玉米秆灰熔融特征温度的影响。生物质样在550℃灰化用于制备三角灰锥,之后将灰锥置于弱还原气氛下从室温加热至1500℃并根据高温下灰锥形状变化确定灰熔融特征温度:变形温度(DT)、软化温度(ST)、半球温度(HT)和流动温度(FT)。
使用图1中固定床反应器进行灰样在高温下的烧结度测试。考虑到生物质燃烧温度通常为800~1000℃[17],反应温度选取为700~1000℃。当温度升至指定温度后,使用进样枪将标准灰样快速推进反应器恒温区并反应1 h。实验结束后将冷却至室温的样品收集并储存于干燥皿用于后续的分析检测。根据如下规则[18-19]进行烧结度划分:(1)未发生烧结;(2)轻微烧结,灰颗粒结构疏松易破碎;(3)硬烧结,灰颗粒发生部分熔融;(4)严重烧结,灰样结渣且很难破碎;(5)完全熔融烧结。该方法可较为直观地获取灰样在高温下灰烧结行为。
1.4 样品表征分析
模型化合物反应后产物和灰样在700~1000℃煅烧后产物使用X 射线衍射仪(XRD,Eagle III,America)在θ-θ模式下分析样品的晶相组成,扫描角度2θ=5°~85°,扫描速度为5(°)/min。所得谱图使用HighScore Plus 软件结合ICDD (International Centre for Diffraction Data)数据库卡片分析样品的晶相组成。此外,使用场发射扫描电镜/能谱仪(FSEM/EDS,JSM-7001F,Japan)在二次电子模式下观测灰颗粒的微观形貌和化学组成。
2 结果与讨论
2.1 磷酸二氢钙与钾盐的反应特性
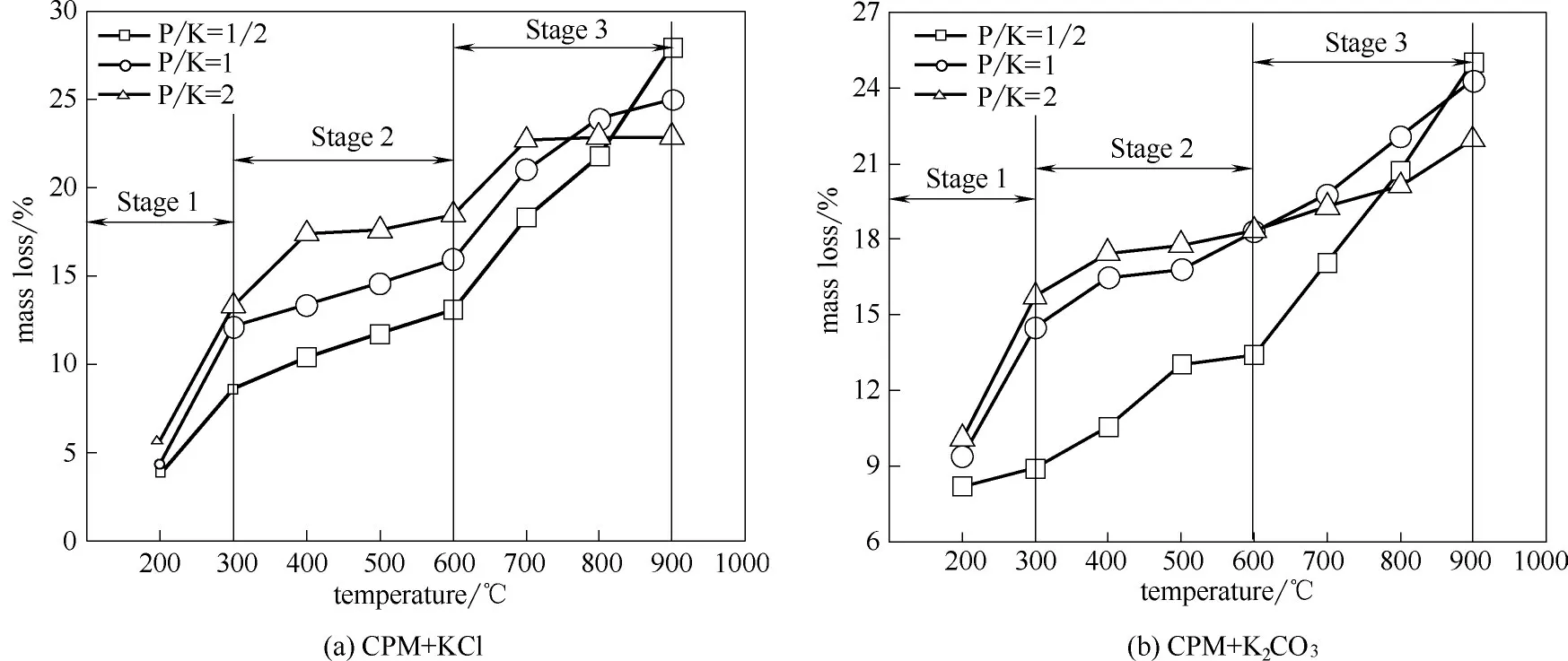
图2 CPM与钾盐在200~900℃的反应失重率变化趋势Fig.2 Mass loss rate of CPM and potassium salts at 200—900℃
2.1.1 反应失重率 不同P/K 摩尔比条件下,Ca(H2PO4)2·H2O 与钾盐在200~900℃的反应失重率如图2所示。可以看出,CPM 与KCl和K2CO3样品失重率均随温度的增加呈现上升趋势,且变化趋势相似。根据图中的失重率变化趋势,可将反应过程分为三个不同的温区:低温区(<300℃)、中温区(300~600℃)、高温区(600~900℃)。CPM 与KCl 和K2CO3在低温区的失重率分别为3%~6%和8%~10%;在中温区的失重率分别为8%~19%和9%~19%,失重率在此温度范围内随温度增加缓慢增加,随P/K 摩尔比的增加基本呈比例增加;在高温区CPM 与KCl 和K2CO3的失重率随温度变化增加显著,失重率分别为18%~23%、17%~22%。此阶段P/K 摩尔比对失重率的影响较为复杂。800℃时P/K 摩尔比对失重率影响较小,但在900℃时样品失重率随P/K 摩尔比增加呈明显降低趋势。
样品反应失重可归因于:①样品受热时CPM 的分解或钾盐的挥发;②磷酸二氢钙与钾盐反应生成气相产物释放至气相中。研究表明[20]Ca(H2PO4)2·H2O 在109℃左右加热脱水形成Ca(H2PO4)2,继续加热会进一步发生一系列复杂反应并最终在400~500℃时形成Ca(PO3)2。当温度高于700℃时,KCl 会向气相中挥发且挥发比例与该物质在气相中的饱和分压有关[21]。此外,温度高于850℃时K2CO3会分解释放CO2,在高温下也会造成质量的损失。根据计算可知,在P/K 摩尔比分别为1/2、1 和2 时,Ca(H2PO4)2·H2O 与KCl 混合物脱水的理论失重率分别为3.3%、4.5%和5.5%,其与图中低温区反应失重率基本一致,因此可以推测此阶段的失重主要是由Ca(H2PO4)2·H2O 脱 除 结 晶 水 所 致。而Ca(H2PO4)2·H2O 与K2CO3混合物在P/K 摩尔比分别为1/2、1 和2时的理论失重率分别为3.4%、4.6%和5.6%,远低于图中的失重率。这表明此时除发生Ca(H2PO4)2·H2O的脱水反应外,还应有其他反应或变化。样品在300~600℃时Ca(H2PO4)2·H2O 与KCl 或K2CO3可能发生一系列化学反应,将在后续结合XRD 结果进行深入分析。当温度高于700℃时除磷酸二氢钙与钾盐反应造成样品失重外,KCl的挥发和K2CO3的分解也会造成样品的失重,因此造成在700~900℃时失重率显著增加,并且KCl 或K2CO3含量越高(对应的P/K摩尔比低)失重率增加越显著。
2.1.2 反应产物晶相组成
(1)CPM 与KCl 的反应 不同P/K 摩尔比条件下,CPM 与KCl 反应产物的XRD 谱图如图3 所示。与前述失重率变化趋势相同,根据产物变化趋势也可将反应划分为三个阶段。低温区时物相组成主要为KCl 以及少量的Ca(H2PO4)2和CaHPO4。200℃时Ca(H2PO4)2的存在证实了该温度下主要发生的反应为Ca(H2PO4)2·H2O受热脱除结晶水。
当温度升至300℃时Ca(H2PO4)2的衍射峰消失,中温区主要的反应产物为Ca2P2O7、Ca(PO3)2、KCa(PO3)3(可视为KPO3与Ca(PO3)2的复盐)。Ca(H2PO4)2·H2O的热分解是一个非常复杂的缩聚过程最终形成晶态或非晶态的Ca(PO3)2。但在分解过程根据实验情况会生成H3PO4、CaH2P2O7、Ca3(HP2O4)2和Ca(H2P2O7)2等中间产物[22]。但未有研究表明其会通过热分解生成Ca2P2O7。因此,反应产物中Ca2P2O7的大量存在表明Ca(H2PO4)2与KCl 在此温度范围内发生了化学反应并且生成产物中包含Ca2P2O7。Pyldme 等[20]研究表明Ca(H2PO4)2与KCl(质量比为1∶1)500℃时反应产物为KPO3、Ca2P2O7和Ca(PO3)2。这与本文中温区反应产物一致,因此可推测在中温区内总反应可用式(2)表示。同时,KCa(PO3)3的峰随P/K 摩尔比的增加而增强,表明过量的CPM 加热分解生成的Ca(PO3)2与KPO3反应生成KCa(PO3)3[式(3)]。
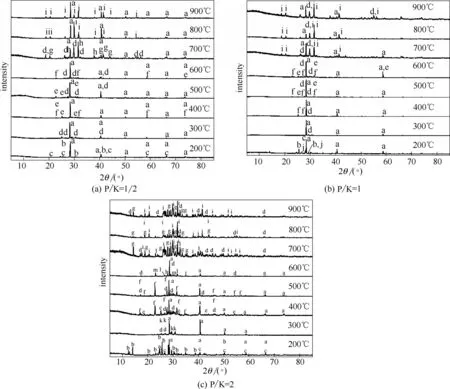
图3 CPM与KCl反应产物的XRD谱图Fig.3 XRD patterns of reaction product of CPM and KCl
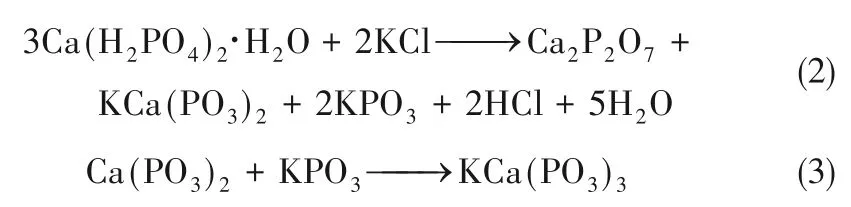
在高温区,KCa(PO3)3的衍射峰消失,主要反应产物为K2CaP2O7,并且其峰强随P/K 摩尔比增大而逐渐增强,此时反应为式(4)。根据式(4),理想情况下在P/K 摩尔比为1 时完全反应并主要生成K2CaP2O7。但在P/K=1/2 和1,900℃时依然有KCl 的衍射峰,这表明受样品混合和传质影响,此时除式(4)外仍存在其他反应,如式(2)或式(5)[23]。在P/K=2 时KCl 的衍射峰消失,过量的Ca(H2PO4)2可以与KCl 充分反应。此时KCl 的挥发受到限制,这与前述失重率结果相一致。同时在P/K=2时反应产物中有Ca2KP3O10的生成,表明当Ca(H2PO4)2过量时式(2)和式(4)会同时发生,反应生成的Ca2P2O7和KPO3可通过式(6)进一步反应生成Ca2KP3O10。

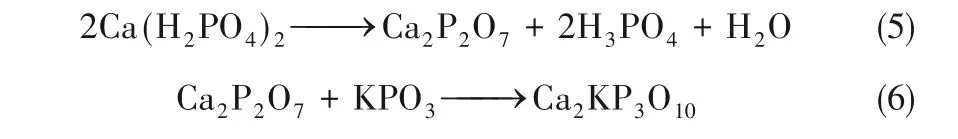
(2)CPM 与K2CO3的 反 应 Ca(H2PO4)2·H2O 与K2CO3在200~900℃内反应产物的XRD 谱图如图4所示。低温区两者的反应产物主要为K2CO3和Ca(H2PO4)2,表明此温度范围发生的主要反应也为Ca(H2PO4)2·H2O 的脱水。但从图中可以看到P/K=1/2 和1 时Ca(H2PO4)2峰较弱,考虑到此时实际失重率远高于Ca(H2PO4)2·H2O 脱水理论失重率,可以推测K2CO3的存在会促进Ca(H2PO4)2继续脱水生成无定形态产物。但具体生成产物需进一步检测分析,本文不做深入探究。
中温区反应产物主要为KCa(PO3)3和Ca2P2O7。类比Ca(H2PO4)2·H2O 与KCl 的反应,可以推断反应为式(7)。P/K=1/2和1时有部分K2CO3存在,其衍射强度随煅烧温度升高逐渐减弱。P/K=2 时,K2CO3的衍射峰消失表明K2CO3与Ca(H2PO4)2反应活性要明显高于KCl,二者在300~600℃时即可充分反应。
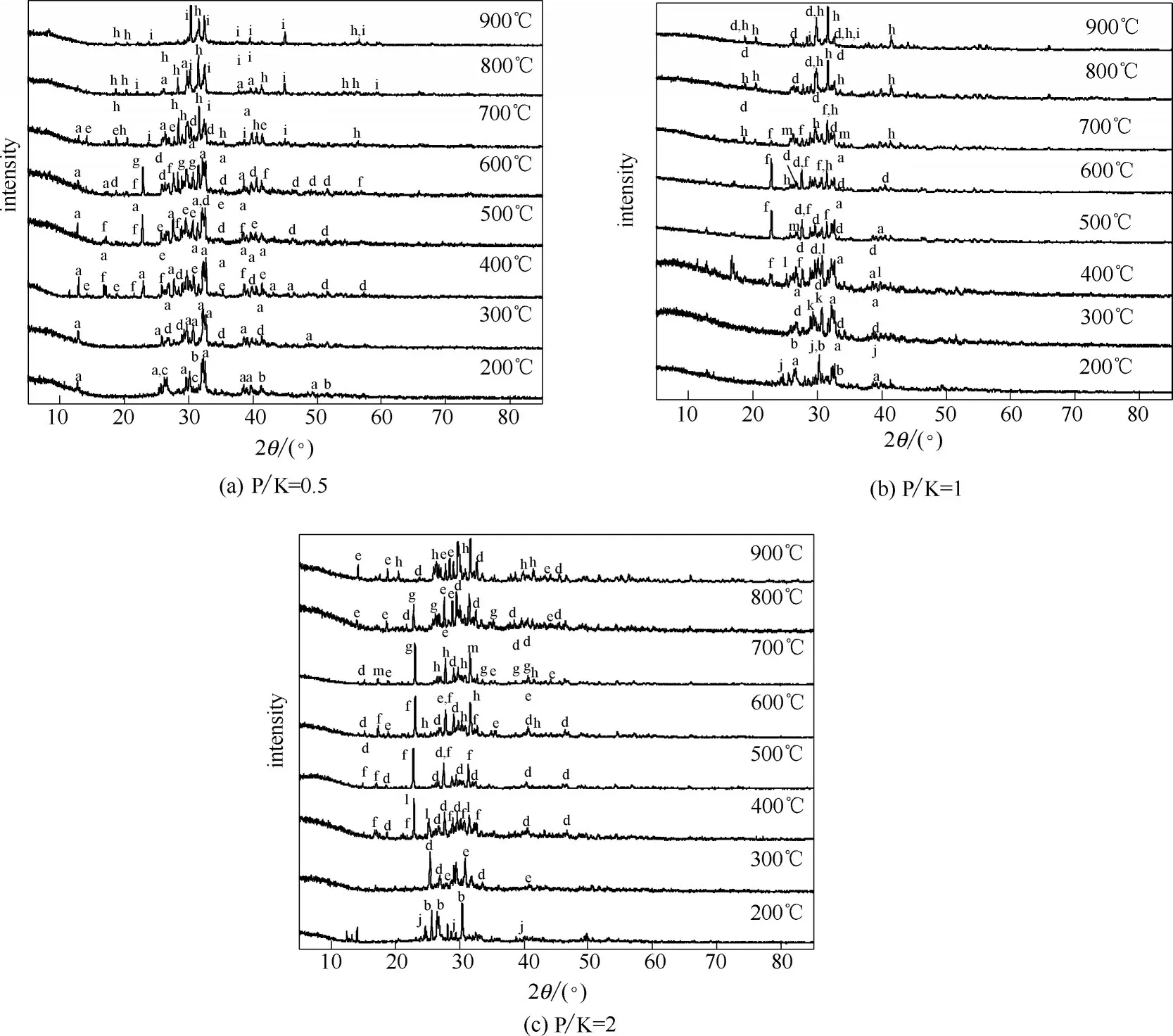
图4 CPM与K2CO3反应产物的XRD谱图Fig.4 XRD patterns of reaction product of CPM and K2CO3
在高温区,P/K=1/2 时反应产物主要为K2CaP2O7和KCaPO4,表明CPM 含量低时有利于生成KCaPO4。类比Ca(H2PO4)2·H2O 与KCl 的反应,可以推断本阶段的反应主要为式(8)和式(9)。P/K=1时,K2CaP2O7和Ca2P2O7的衍射峰逐渐增强,KCaPO4的峰强减弱,此时主要反应产物为K2CaP2O7和Ca2P2O7,仅有少量KCaPO4。P/K=2 时,有 部 分Ca2KP3O10及 少 量 的KPO3、Ca3(PO4)2生成。该现象与CPM 和KCl 反应结果相似,表明此时除Ca(H2PO4)2与K2CO3反应外还存在Ca(H2PO4)2的高温分解/水解反应,所得产物继续发生二次反应最终生成Ca2KP3O10。另一方面,可以看到在高温区产物中基本无K2CO3存在,这进一步证实K2CO3反应活性高于KCl。其与Ca(H2PO4)2在600℃即可反应生成K2CaP2O7,同时二者反应速率较快,700℃时K2CO3已完全反应。
2.2 灰熔融烧结特性
样品灰熔融特征温度如表3所示。从表中看出CS 的变形温度为963℃,1036℃即完全熔融,表明玉米秆原样在高温下可发生严重的熔融。这与以往研究中玉米秆灰分的熔融特征温度基本一致[24]。添加CPM 后灰熔融特征温度有不同程度提高,初始变形温度提高至1027~1172℃并且随P/K 摩尔比增加而增加。流动温度在P/K=1/2、1 时相比原样提高约200℃,在P/K=2 时提高了约400℃。这表明CPM 不仅提高了玉米秆的初始熔融温度,而且有效地降低了高温下的熔融速率。
可以看出,当P/K=1 时玉米杆初始变形温度可从963℃升至1146℃,该温度已高于生物质常规燃烧温度。鉴于灰熔融特征温度在预测生物质灰烧结时偏差较大,本文研究了按照P/K=1 添加CPM 时玉米秆在700~1000℃的烧结度变化趋势,结果如图5 所示。玉米秆在700℃时发生轻微烧结,当温度升至800~900℃时烧结继续恶化,1000℃时灰样完全熔融,无法从坩埚中取出。添加CPM 后,样品在700℃时所得灰分与原样无明显差别,800℃时仅有轻微烧结,900℃时发生了硬烧结,在1000℃时虽可以观测到少量的灰分发生了熔融,但此时灰样仍可轻易取出。该结果与灰熔点结果趋势相同,表明CPM 的添加可以显著提高玉米秆的熔融烧结特性。但可以看出,烧结度测试显示玉米秆在800℃即已经发生了严重的硬烧结,表明灰熔点测试结果与实际烧结温度相比要明显偏高。
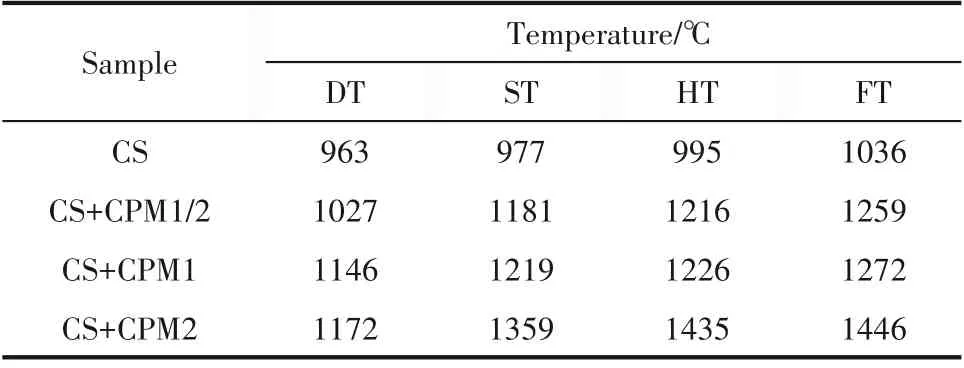
表3 样品灰熔融特征温度Table 3 Ash fusion characteristic temperature of samples

图5 样品高温下烧结度检测结果Fig.5 Sintering degree of samples at elevated temperatures
2.3 XRD晶相组成
图6 为玉米秆灰分的XRD 谱图。700 和800℃时玉米秆灰分中主要为KCl、MgO、SiO2等,在800℃还有少量的CaMgSiO4、K2SO4。900~1000℃时KCl、SiO2的衍射峰消失,灰分中仅剩余CaMgSi2O6、Ca2MgSi2O7等晶体成分。此时衍射曲线中的非晶态衍射晕环表明灰分中含有大量的非晶态物质,这是由于灰分中碱金属与SiO2反应生成熔融态的K2O·nSiO2。
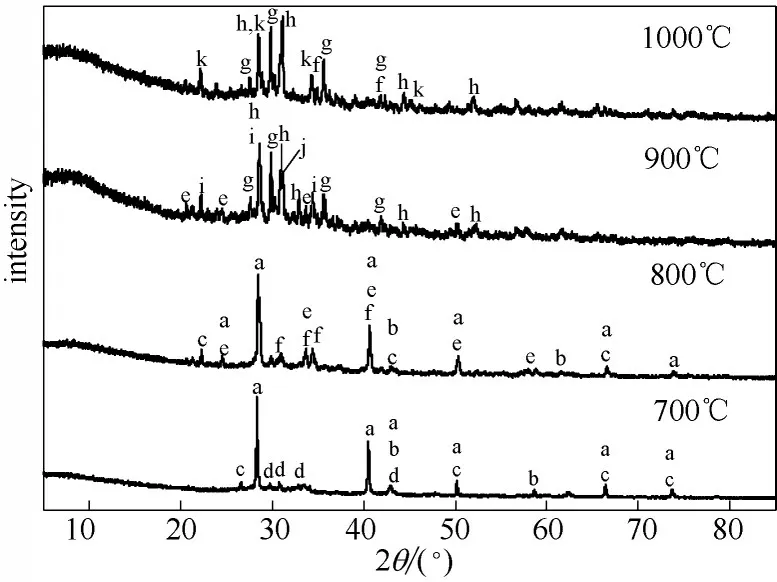
图6 玉米秆灰样XRD谱图Fig.6 XRD patterns of cornstalk ash
图7 为添加CPM 后玉米秆灰分的XRD 谱图。700℃时 灰 分 中 主 要 为KCl、Ca9MgK(PO4)7、SiO2、KCaPO4和Ca2KP3O10。800℃时KCl和KCaPO4的衍射峰消失。继续升高温度灰分组成变化不大,仅Ca9MgK(PO4)7的特征峰强度随温度升高而增加。灰分中SiO2的存在表明添加CPM 后,碱金属主要与CPM 反应形成各类磷酸盐,与SiO2反应程度降低。其中Ca2KP3O10的生成与前述模化物反应结果一致。但另一主要产物Ca9MgK(PO4)7与CPM 和模化物反应主要生成K2CaP2O7不同。Wang 等[14]发现在玉米秆中添加CPM 灰分中主要生成K2CaP4O12、K2CaP2O7、K4Ca(PO4)2以及KCaPO4,与本文中实验结果也有一定差异性,这可能是由于不同产地玉米秆成分的差异造成。从表2 中可以看到,文中所用玉米秆灰分中CaO和MgO含量相对较高,有利于形成高Ca/K比的Ca9MgK(PO4)7。在以往城市污泥与麦秆混燃研究中也发现主要产物为Ca9MgK(PO4)7[25]。

图7 添加CPM后玉米秆灰样XRD谱图Fig.7 XRD patterns of cornstalk with addition of CPM
2.4 SEM-EDS分析
玉米秆及添加CPM 后玉米秆灰在700~1000℃时的微观形貌如图8 所示,图中EDS 化学成分分析结果如表4 所示。700℃时玉米秆灰颗粒失去原有形貌呈现非均相结构,相对松散且表面粗糙。800℃时部分灰颗粒表面光滑,表明此时发生一定程度的熔融。EDS 结果表明表面光滑的灰颗粒(C1)是主要由K、Si组成的硅酸钾(K2O·nSiO2)。900℃时灰颗粒发生了明显的熔融收缩,倾向于熔融团聚为大粒径灰。同时灰分中可见一些表面粗糙的非均相灰颗粒(C2),经EDS 分析其主要由Ca、Mg 和Si 组成,这 与XRD 结 果 中 存 在 的CaMgSiO4、CaMgSi2O6、Ca2MgSi2O7相一致。1000℃时灰颗粒发生了严重的熔融烧结,所得灰颗粒呈现熔融后的均质光滑硬块状,这些灰颗粒(C3)也主要由富含钾的硅酸盐组成。

表4 典型灰颗粒EDS能谱分析Table 4 EDS analysis of typical ash particle/%(mol)
添加CPM 后灰颗粒表面形貌发生明显变化。700℃时表面较为粗糙且颗粒松散。800℃时颗粒也倾向于团聚形成大颗粒,但此时颗粒表面相对粗糙并且呈现多孔状。900℃时颗粒表面呈现轻微的熔融,但样品取出时发现颗粒之间黏结力较弱,容易破碎。1000℃时颗粒发生了熔融烧结,部分颗粒呈现明显的熔融光滑表面。DES 结果显示添加CPM后,灰颗粒(P1~P3)中Ca和P的含量明显增加,这与XRD 中Ca9MgK(PO4)7、KCaPO4、Ca2KP3O10的 存 在 相一致。
综合考虑添加剂的经济性及其对生物质抗烧结的效果,在实际工程中可以按照P/K 摩尔比为1 的比例在玉米秆中添加CPM。此时CPM 可与灰分中钾盐及其他碱土金属反应形成高熔点的Ca9MgK(PO4)7、KCaPO4和Ca2KP3O10,提 高 玉 米 秆的熔融温度。在700~1000℃的烧结度测试中发现并无严重熔融烧结问题,有效缓解了玉米秆燃烧的熔融烧结问题。此外根据EDS 结果发现添加CPM后灰分中富含钾、磷等植物生长所需营养元素,具备通过进一步加工制备磷钾复合肥的潜力,可在一定程度上降低添加剂的使用而造成的经济成本提升问题。
3 结 论
本文研究了磷酸二氢钙与不同碱金属盐的反应特性以及其对玉米秆燃烧灰熔融烧结特性的影响,主要结论如下。
(1)磷酸二氢钙与钾盐在温度高于300℃时开始反应,300~600℃反应产物以Ca2P2O7、Ca(PO3)2、KCa(PO3)3为主,700~900℃反应产物主要以K2CaP2O7为主。
(2)磷酸二氢钙与钾盐反应产物受二者掺混比例影响,与K2CO3的反应活性显著高于KCl。
(3)在玉米秆中按P/K 摩尔比为1 的比例添加磷酸二氢钙有利于形成高熔点的Ca9MgK(PO4)7、KCaPO4和Ca2KP3O10化合物,提高生物质灰熔点并有效缓解玉米秆灰熔融烧结问题。

图8 灰分样品的SEM微观形貌Fig.8 SEM image of morphologies of ash samples
