卵形鲳鲹TNFSF6的原核表达、纯化与多克隆抗体的制备
2020-07-21李海平周永灿曹贞洁
王 鹭,李海平,周永灿,,孙 云,曹贞洁
(1. 海南大学 南海海洋资源利用国家重点实验室,海南 海口 570228;2. 海南大学 海南省热带水生生物技术重点实验室, 海南 海口 570228;3. 海南大学 海洋学院,海南 海口 570228)
卵形鲳鲹(Trachinotusovatus),隶属鲈形目(Perciformes),鲹科(Carangidae),鲳鲹属(Trachinotus),俗称金鲳,是一种暖水性中上层鱼类,因其较快的生长速度及较高的经济价值而成为我国广东、海南、福建等沿海地区网箱养殖的重要海水鱼类之一.然而,随着养殖密度的提高,病害问题已成为制约卵形鲳鲹养殖业发展的瓶颈[1].面对病害的肆虐,使用传统抗生素依然是人们的首要选择.但抗生素滥用所产生的药物残留、污染环境等诸多问题,已严重威胁人类健康[2-3].因此,迫切需要通过加强对养殖对象的免疫机制研究,通过全面系统地了解卵形鲳鲹免疫系统的结构、功能及作用机制,探索建立卵形鲳鲹等水产动物疾病安全高效的免疫防治方法,推动其养殖的可持续健康发展.
肿瘤坏死因子配体(Tumor necrosis factor ligand superfamily , TNFSF)是能够诱导细胞发生凋亡、坏死、迁移、分化的一类细胞因子[4-9],主要由巨噬细胞和单核细胞产生,此外,B淋巴细胞,T淋巴细胞和成纤维细胞等也可分泌产生[10-13].研究表明在人类中已鉴定出19种肿瘤坏死因子配体成员[14],而在鱼类中有超过14种被确认[15].TNFSF6是其重要的一员,它属于Ⅱ型跨膜蛋白,由跨膜区、胞外区和胞浆区组成.研究表明,TNFSF6能够通过与其受体相结合而诱导靶细胞凋亡,促进炎症因子的产生,对肿瘤细胞具有杀伤作用[16-17],并且对于维持机体的免疫稳态至关重要[18],它除了参与细胞凋亡之外,还参与机体的非特异性免疫[19-20].目前,TNFSF6已相继在罗非鱼(Oreochromisniloticu)、牙鲆(Paralichthysolivaceus)、大头鳕(Gadusmacrocephalus)等鱼体中被克隆鉴定[21-23],但在卵形鲳鲹中尚未见报道.本研究以卵形鲳鲹为对象,对TNFSF6基因进行了克隆,并进行原核重组诱导表达而获得重组蛋白rTroTNFSF6.此外,本研究通过免疫小鼠制备了卵形鲳鲹TNFSF6多克隆抗体,这为深入研究TNFSF6的生物学功能及卵形鲳鲹的免疫调控机制奠定了基础.
1 材料与方法
1.1 实验材料
1.1.1 实验动物平均体重为(20 ± 0.8)g的健康卵形鲳鲹购自海南澄迈养殖厂,实验开始前,暂养在养殖室水温为26 ℃的充气流动海水中一周;SPF级小鼠购自海南省药物研究所,实验开始前,暂养于25 ℃恒温饲养房中.
1.1.2 质粒和菌株pET-32a载体由中国科学院海洋研究所惠赠;DH5α、EscherichiacoliBL21购自北京全式金生物公司.
1.1.3 实验试剂与仪器TransTaq-T DNA酶、pEASY-T1 Simple克隆载体购自北京全式金生物公司;DNTP、限制性内切酶SmaⅠ、EcoR V、蛋白Marker 26610购自美国Thermo公司;核酸Marker DL 2000、T4 DNA连接酶、CIAP去磷酸化酶购自北京Takara公司;胶回收试剂盒、质粒提取试剂盒购自南京诺唯赞生物公司;氨苄青霉素、BCA蛋白浓度测定试剂盒购自北京索莱宝公司;羊抗鼠IgG(HRP标记)购自美国ABclonal公司;其余试剂均为国产分析纯.
1.2 实验方法
1.2.1 引物设计根据卵形鲳鲹转录组测序获得的TNFSF6基因序列,使用SMART在线网页进行信号肽的预测,然后设计扩增引物TroTNFSF6-F/R,并在引物5′端插入酶切位点SmaⅠ(CCCGGG),引物由华大生物公司进行合成(TroTNFSF6-F: 5′-CCCGGGGCCACCATGATCAACACTTACCAGACC-3′; TroTNFSF6-R: 5′-CCCGGGCAGTTTGTACATCCCAAAGG-3′).
1.2.2 卵形鲳鲹TNFSF6基因的获得与序列分析以卵形鲳鲹cDNA第一链为模板进行TroTNFSF6基因的扩增,其中退火温度为56 ℃.将PCR产物进行纯化,并与pEASY-T1 Simple连接,转化至DH5α感受态细胞中并置于LB固体培养基培养,隔日挑取单菌落进行检测并将阳性单菌落送华大生物公司测序.
1.2.3 重组质粒的构建将测序正确的菌株与含有pET-32a载体的菌株培养至生长对数期,提取其质粒并分别进行酶切,其中含有目的基因的质粒限制性内切酶为SmaⅠ,酶切温度30 ℃,pET-32a酶切使用EcoR Ⅴ(GATATC),酶切温度为37 ℃,并使用CIAP酶对pET-32a进行去磷酸化.随后使用T4连接酶将两者酶切产物进行连接并转化至DH5α,挑取阳性单菌落送至华大生物公司测序,并提取测序正确菌株的质粒转化于BL21中,置于-80 ℃保存.
1.2.4 原核重组蛋白的诱导表达与纯化将带有重组质粒的菌株接种于5 mL 含有1‰ Amp的LB培养基中,37 ℃振荡培养至对数期,向菌液中分别加入不同浓度的IPTG,置于不同温度中诱导不同时间,其中阴性对照为不加入IPTG诱导剂诱导的菌液.诱导完成后,离心2 mL菌液以获得菌体沉淀,加入80 μL pH为8.0的Buffer B缓冲液(100 mmol/L NaH2PO4, 100 mmol/L Tris, 8 mol/L Urea)并重悬,室温震荡裂解2 h,随后12 000 × g离心20 min,取40 μL上清用于SDS-PAGE胶检测有无诱导表达.确定最佳诱导条件后并按此条件进行大量诱导,诱导完成后离心50 mL菌液以获得菌体沉淀,加入5 mL pH为8.0的40 mmol/L咪唑缓冲液(50 mmol/L NaH2PO4, 2 mol/L NaCl, 40 mmol/L Imidazole, 7 mmol/Lβ-Me, 0.1% Tween-20)并重悬,置于-80 ℃预冷的酒精中速冻10 min,随后取出置于4 ℃融化并超声破碎至菌液透明.将超声完成的菌液离心并分别处理上清与沉淀,SDS-PAGE检测样品中蛋白表达情况.使用Ni-NTA柱对重组蛋白进行纯化,并将纯化蛋白透析至PBS中,最后进行蛋白浓度测定.
1.2.5 多克隆抗体的制备将1 mL纯化的蛋白(200 μg/mL)与1 mL弗氏完全佐剂混合并震荡至乳化,然后多点皮下注射至小鼠体内,两周后使用1 mL蛋白与1 mL弗氏不完全佐剂乳化混合液注射小鼠进行二次免疫,二次免疫一周后再次使用1 mL蛋白与1 mL弗氏不完全佐剂乳化混合液注射小鼠进行三次免疫.三次免疫一周后对小鼠进行眼球取血,而后获得其血清并置于-80 ℃保存,其中阴性对照为采用相同方式向小鼠体内注射无菌PBS所获血清.
1.2.6 多克隆抗体效价检测采用间接 ELISA 法来检测制备的多克隆抗体血清的效价.首先将纯化后的重组蛋白rTroTNFSF6作为抗原包被至96孔板中,4 ℃孵育过夜后用PBST洗涤并甩干,随后向每孔中加入封闭液PBST-BSA,37 ℃孵育2~3 h,完成后向每孔加入PBST进行洗涤,对制备的多克隆抗体血清分别进行1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000稀释,并与蛋白进行抗原抗体反应,37 ℃孵育3 h,加入1∶2 000稀释的HRP标记的羊抗鼠IgG抗体稀释液作为二抗进行ELISA反应,最后加入可溶性单组分TMB底物溶液避光10 min进行颜色反应,直至溶液出现蓝色时加入 50 μL 的 2 mol / L H2SO4终止液, 以终止颜色反应,最后测定各孔在450 nm处的吸光值.
2 结 果
2.1 卵形鲳鲹TNFSF6基因的获得以卵形鲳鲹cDNA为模板,TroTNFSF6-F/R为引物对目的片段进行扩增,凝胶电泳结果显示扩增的目的条带大小与预期的687 bp一致(图1),测序结果在NCBI比对分析表明该序列为TNFSF6.TroTNFSF6共编码228个氨基酸,预测蛋白分子量约为25.5 kDa,理论等电点为8.9,SMART软件预测该蛋白不含信号肽.
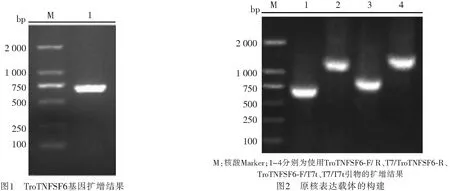
2.2 重组质粒的构建与鉴定目的片段与pET-32a载体进行连接后,使用通用引物T7/T7t对连接产物进行单菌落检测,其凝胶电泳结果见图2,目的片段插入原核表达载体的位点为EcoR Ⅴ,该位点到载体上游引物T7之间约600 bp,到载体下游引物T7 t之间约100 bp,均与扩增结果相一致,表明原核表达载体构建成功.
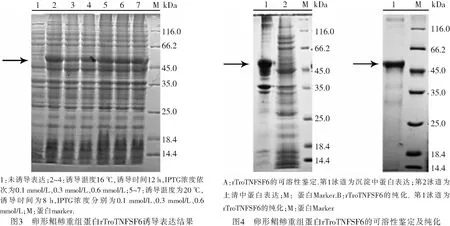
2.3 原核重组蛋白的诱导表达与纯化经DNASTAR软件预测得知,原核重组蛋白rTroTNFSF6大小约为46.5 kDa,对重组蛋白进行小量诱导摸索其最佳诱导条件,结果发现当IPTG浓度为0.6 mmol/L,于20 ℃诱导8 h时蛋白表达量最高,SDS-PAGE检测结果如图3所示.
将原核重组蛋白按照最佳诱导条件进行大量诱导并进行蛋白可溶性鉴定.结果显示,目的蛋白大多位于沉淀中,为变性蛋白(图4A).进一步对变性蛋白进行纯化,结果显示纯化得到的蛋白大小约46.5 kDa,与预测的原核重组蛋白大小一致,表明成功获得纯化的蛋白(图4B).
2.4 多克隆抗体效价检测采用间接ELISA检测多克隆抗体的效价,结果显示本研究所制备的TroTNFSF6多克隆抗体的效价较高,达到1∶32 000(表1).
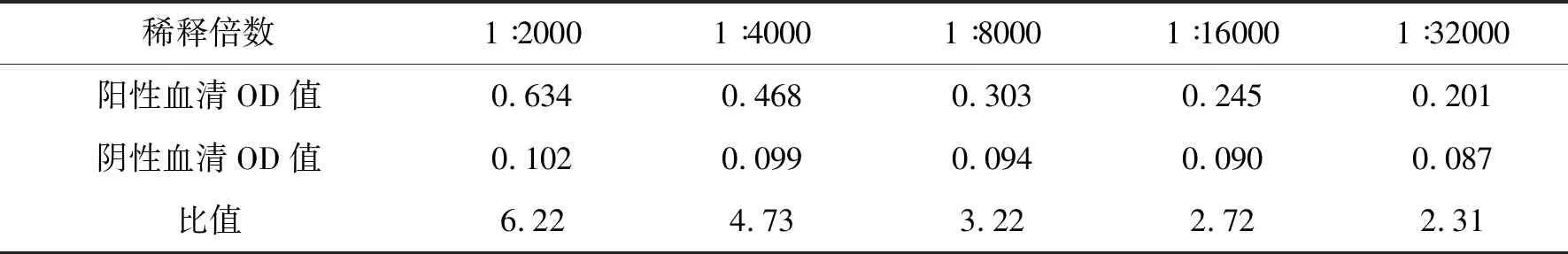
表1 ELISA检测多克隆抗体效价
3 讨 论
肿瘤坏死因子配体TNFSF6是一类Ⅱ型跨膜蛋白,具有杀伤肿瘤细胞的作用,能够参与细胞炎症、细胞凋亡、淋巴细胞稳态和组织发育等细胞信号传导途径[24-26].本研究中成功克隆了卵形鲳鲹TNFSF6基因,SMART在线网页分析显示TroTNFSF6结构中无信号肽,其中包含一个跨膜区,与关于罗非鱼和牙鲆TNFSF6的研究结果一致[21-22].TroTNFSF6共编码228个氨基酸,预测其蛋白质理论分子量为25.5 kDa.据报道,罗非鱼TNFSF6的蛋白大小为26.3 kDa[21],牙鲆的TNFSF6蛋白分子量为25.9 kDa[22],大头鳕的蛋白分子量为21.7 kDa等[23],这些均与本研究获得的卵形鲳鲹TNFSF6蛋白大小不一致,推测可能与鱼的种类及TNFSF6的低保守度有关.pET-32a是一种良好的原核表达载体,本研究中我们将TroTNFSF6序列与pET-32a连接获得重组质粒,并在BL21中进行诱导表达,实验结果表明其最适诱导温度为20 ℃,诱导时间为8 h,IPTG的最佳浓度为0.6 mmol/L.重组蛋白rTroTNFSF6的结果表明,其大小与预测的46.5 kDa一致,此外对该蛋白进行可溶性分析显示rTroTNFSF6多以包涵体的形式存在.形成包涵体的原因可能有:(1)与其氨基酸序列有关,疏水性较高的蛋白质更能够形成包涵体[27];(2)与蛋白诱导量有关,表达量越高越容易形成包涵体[28];(3)与培养条件有关,当诱导条件不佳时,容易形成包涵体[29].同时也有研究表明,包涵体中的大部分蛋白质同样拥有部分功能,可以不用重新折叠[30].利用Ni-NTA层析柱对重组蛋白进行纯化,将纯化后的蛋白与弗氏佐剂相混合,三次免疫小鼠后获得多克隆抗体,经过ELISA检测表明制备的rTroTNFSF6抗体效价高达1∶32 000,可用于后续对TroTNFSF6的功能研究.综上,本研究成功获得了TroTNFSF6多克隆抗体,为进一步研究其生物学功能以及卵形鲳鲹的免疫调控机制奠定了基础.
