分散固相萃取-气相色谱-质谱联用测定茶叶中的28种农药残留
2020-07-20赵丽农蕊瑜师真
赵丽 农蕊瑜 师真

摘要:建立测定茶叶中28种农药残留量的气相色谱-质谱联用检测方法。茶叶样品经乙腈和正己烷提取后,采用分散固相萃取方法作前处理,以N-丙基乙二胺(PSA)、Bulk Carbograph、C18EC、MgSO4吸附并净化提取液中的干扰组分,净化液经气相色谱-质谱测定,以基质内标法定量。采用本试验建立的方法,在0.002~1.000 μg/mL 范围内,28种农药的线性关系良好,相关系数r>0.995,方法检出限为0.10~5.0 μg /kg,定量限为 0.30~15.00 μg /kg。0.075、0.375、0.750 mg/kg这3个添加量的平均加标回收率为63.9%~102.9%,相对标准偏差为2.05%~7.02%。与传统的QuEChERS法相比,该方法具有操作简单、快速,试剂用量少,回收率高,准确性强等特点。
关键词:茶叶;气相色谱-质谱法;农药残留;分散固相萃取
茶叶是我国的重要经济作物,也是出口贸易的重要组成部分。但茶叶在生长过程中易受到假眼小绿叶蝉、茶刺蛾、茶橙瘿螨等病虫害的污染,茶园杂草也会吸收肥料和水分,影响茶树的正常生长,为防治病虫害和排除杂草干扰,最常用的方法就是喷洒农药。而农药的过度使用已经影响到茶叶的品质和安全问题,农药残留超标已成为制约茶叶对外贸易的重要影响因素之一[1]。我国2017年6月18日起实施的GB 2763—2016《食品安全国家标准 食品中农药最大残留限量》中对茶叶中48种农药残留制定了限量要求,相比GB 2763—2014版增加了20种。因此,建立一种快速、准确度、高效的茶叶中农药残留检测方法尤为重要。为提高检测的准确度,有效可行的样品前处理方法尤为重要。
目前,国内外对于茶叶中农药残留检测的前处理方法主要有固相萃取(SPE)法[2-3]、QuEChERS(quick,easy,cheap,effective,rugged,safe)法[4-6]、基质固相分散萃取法[7-9]等。检测方法主要有气相色谱法[10-11]、氣相色谱-串连质谱(GC-MS/MS)法[12]、液相色谱-串联质谱(LC-MS/MS)[13]法。本研究在现有文献的基础上,进一步优化前处理方法,全部前处理过程不须要进行溶剂换相和浓缩操作,以期为茶叶中多种农药残留的快速定量检测奠定基础。
1 材料与方法
1.1 材料与试剂
供试茶叶为市购食品安全风险监测样品。
试剂:敌敌畏、甲胺磷、乙酰甲胺磷、灭线磷、乐果、甲基对硫磷、甲草胺、甲霜灵、毒死蜱、粉锈宁、除草醚、异菌脲、联苯菊酯、三氟氯氰菊酯、氟氯氰菊酯、氯氰菊酯、氟氰戊菊酯、氰戊菊酯、溴氰菊酯、乙拌磷、艾氏剂、反-氯丹、α-硫丹、顺-氯丹、狄氏剂、β-硫丹、氯菊酯、阿特拉津(100 μg/mL)等,均购自中国计量科学研究院;乙腈、正己烷(色谱纯),购自美国赛默飞世尔公司;SPE N-丙基乙二胺(PSA) Packing(7.5 mg Bulk Carbograph,50.0 mg PSA,50.0 mg C18EC,150.0 mg MgSO4)净化剂(61.8 μmol/L),购自美国安捷伦公司;PSA净化剂(10~20 nmol/L)、石墨化炭黑(GCB)净化剂(120~400目)、MgSO4净化剂(50 μmol/L),均购自天津博纳艾杰尔公司。
1.2 仪器与设备
7890B-7000C气相色谱-质谱联用仪,电子天平(感量0.01 g),均质机,GM2000 Retsch涡旋机。
1.3 试验方法
1.3.1 标准溶液的配制 空白基质溶液:称取空白茶叶样品10.0 g,经提取、净化后,净化液置于4 ℃冰箱保存。
标准储备液:将1.00 mL 100 μg/mL的各试剂标准溶液转移到50 mL的容量瓶中,用正己烷定容,配制成质量浓度均为2.00 μg/mL的标准储备液,置于 4 ℃ 冰箱保存。
基质标准储备液:将0.10 mL 100 μg/mL的各试剂标准溶液转移到10 mL的容量瓶中,用空白基质溶液定容,配制成质量浓度均为1.00 μg/mL的基质标准储备液,置于4 ℃冰箱保存。
标准工作液:使用标准储备液,配制成质量浓度分别为0.002、0.005、0.010、0.020、0.050、0.100、0.200、0.500、1.000 μg/mL的系列标准工作液,待 GC-MS/MS检测。
基质标准工作液:使用基质标准储备液,配制成质量浓度分别为0.002、0.005、0.010、0.020、0.050、0.100、0.200、0.500、1.000 μg/mL的系列基质标准工作液,待GC-MS/MS检测。
内标工作液:将1.0 mL 100 μg/mL的阿特拉津内标溶液转移到5.0 mL的容量瓶中,用正己烷定容,配制成质量浓度均为20.0 μg/mL的内标工作液。
1.3.2 样品的制备 提取:称取混匀后的茶叶样品300 g,经均质机粉碎,装袋避光冷冻保存,备用。称取上述茶叶粉末2.00 g于10 mL离心管中,加入 60 μL 浓度为20.0 μg/mL的内标工作液、2.0 mL纯水、2.0 mL乙腈、3.0 mL正己烷充分混匀,涡旋振荡1 min,浸提10 min,再次涡旋振荡5 min,2 000 r/min 离心5 min,收集上清液,待净化。
净化:取提取后的上清液2.0 mL于 2 mL 净化管(7.5 mg Bulk Carbograph,50.0 mg PSA,50.0 mg C18EC,150.0 mg MgSO4)中,涡旋振荡1 min,10 000 r/min 离心5 min。取净化液经 0.45 μm 有机微孔滤膜过滤,待GC-MS/MS测定。
1.3.3 色谱条件 色谱柱:DB-5石英毛细管柱(30 m×0.32 mm,0.25 μm);进样口温度为 250 ℃;升温程序:100 ℃保持1 min,以40 ℃/min升至 160 ℃,保持0 min,以5 ℃/min升至200 ℃,保持 5 min,以8 ℃/min升至240 ℃,保持0 min,以 5 ℃/min 升至280 ℃,保持3 min,以30 ℃/min升至300 ℃,保持1 min;進样方式:不分流进样;进样体积为1 μL;载气为高纯度氦气,恒流模式,流量为 1.2 mL/min。
1.3.4 质谱条件 传输线温度为250 ℃,离子源温度为230 ℃,电离方式为电离源(EI),电子能量为70 eV,溶剂延迟时间为3.5 min;采集模式:选择离子监测(SIM)和多离子监测(MRM)模式。
2 结果与分析
2.1 质谱条件的选择
分别采用SIM和MRM模式对所检测化合物进行扫描,并寻找到2种模式下化合物的扫描参数,同时建立2种扫描模式下化合物的检测质谱方法。为保证检测的精确度和准确度,且在MRM模式下所得的信噪比较SIM模式下的信噪比高,最终选择MRM模式对样品进行定量检测。2种扫描模式的质谱参数见表1。
2.2 样品前处理方法比较
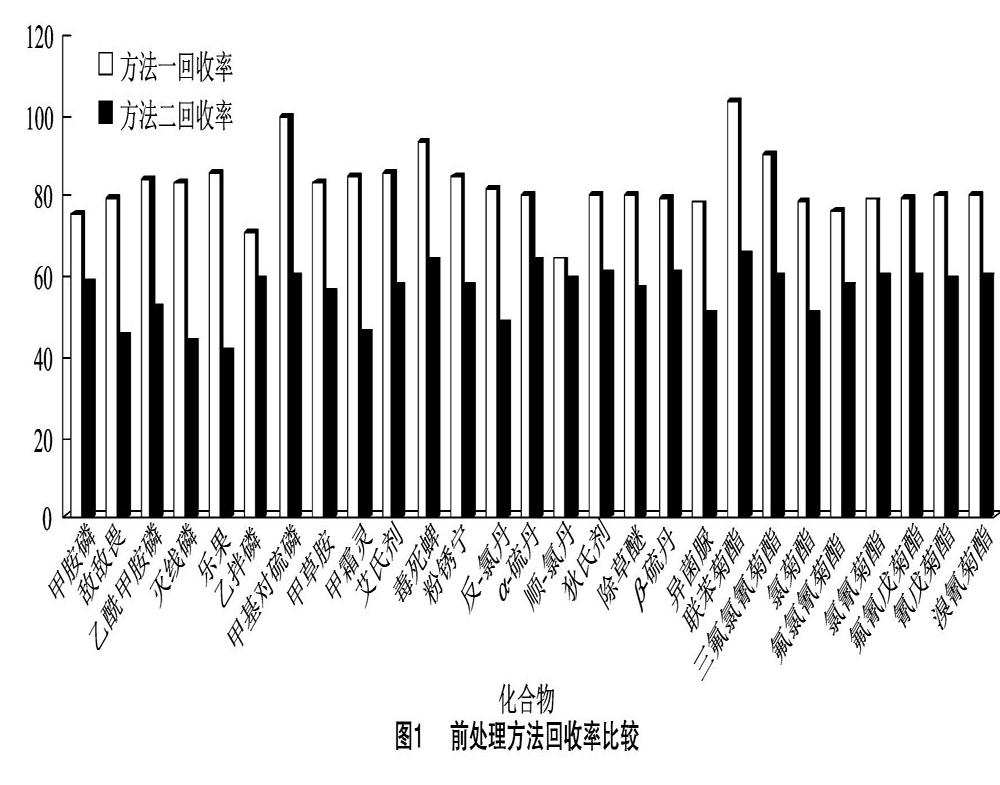
方法一:称取茶叶粉末2.00 g于10 mL离心管中,加入60 μL浓度为20 μg/mL的内标工作液、2.0 mL 纯水、2.0 mL乙腈、3.0 mL正己烷充分混匀,涡旋振荡1 min,浸提10 min,再次涡旋振荡 1 min,2 000 r/min离心5 min,收集上清液,待净化。移取2.0 mL提取液置入装有7.5 mg Bulk Carbograph、50.0 mg PSA、50.0 mg C18EC、150.0 mg MgSO4的净化管中,振荡1 min后,静置5 min,净化液经0.45 μm有机微孔滤膜过滤,待GC-MS/MS分析。
方法二:称取茶叶粉末2.00 g于10 mL离心管中,加入60 μL浓度为20 μg/mL的内标工作液、4.0 mL 纯水、3.0 mL正己烷充分混匀,涡旋振荡 1 min,浸提10 min,再次涡旋振荡1 min,2 000 r/min 离心5 min,收集上清液,待净化。移取2.0 mL提取液置入装有7.5 mg Bulk Carbograph、50.0 mg PSA、50.0 mg C18EC、150.0 mg MgSO4的净化管中,振荡1 min后,静置5 min,净化液经 0.45 μm 有机微孔滤膜过滤,待GC-MS/MS分析。
以同一基质样品做添加0.2 mg/kg的标准浓度,分别按处理方法一、方法二进行前处理。经比较,由方法一提取的样品上清液颜色比方法二颜色深,但方法一的回收率高于方法二,其回收率比较见图1。因此,选择方法一作为本次样品的前处理方法。
2.3 提取溶剂的选择
农药残留量检测中常用的提取溶剂为乙腈、乙酸乙酯、正己烷、丙酮、含1%乙酸的丙酮溶液、含1%乙酸的乙腈溶液等[14]。用乙腈提取时,茶叶提取液中的干扰组分最少,因此QuEChERS法普遍采用乙腈作为提取溶剂。乙腈极性较强,从而导致农药组分发生分裂,造成定量结果不准确。同时,用乙腈提取后直接进样,对色谱柱和检测器的损害较大,多次进样后,色谱峰发生不可逆拖尾。因此用乙腈提取时,常常须要采用浓缩、溶剂转换后才能进行检测,在一定程度上增大了农药在转换过程中的损失风险,且增大了工作人员的劳动量。因此,本试验选择乙腈和正己烷作为提取溶剂,并以上清液正己烷作为检测液,一方面能保证茶叶中的农药被充分提取,另一方面也避免了农药组分在浓缩、溶剂转换中的损失,更简化了试验步骤,也避免了浓缩、溶剂转换过程中由于试验人员的操作而引起的残留农药的损失。
2.4 基质效应考察
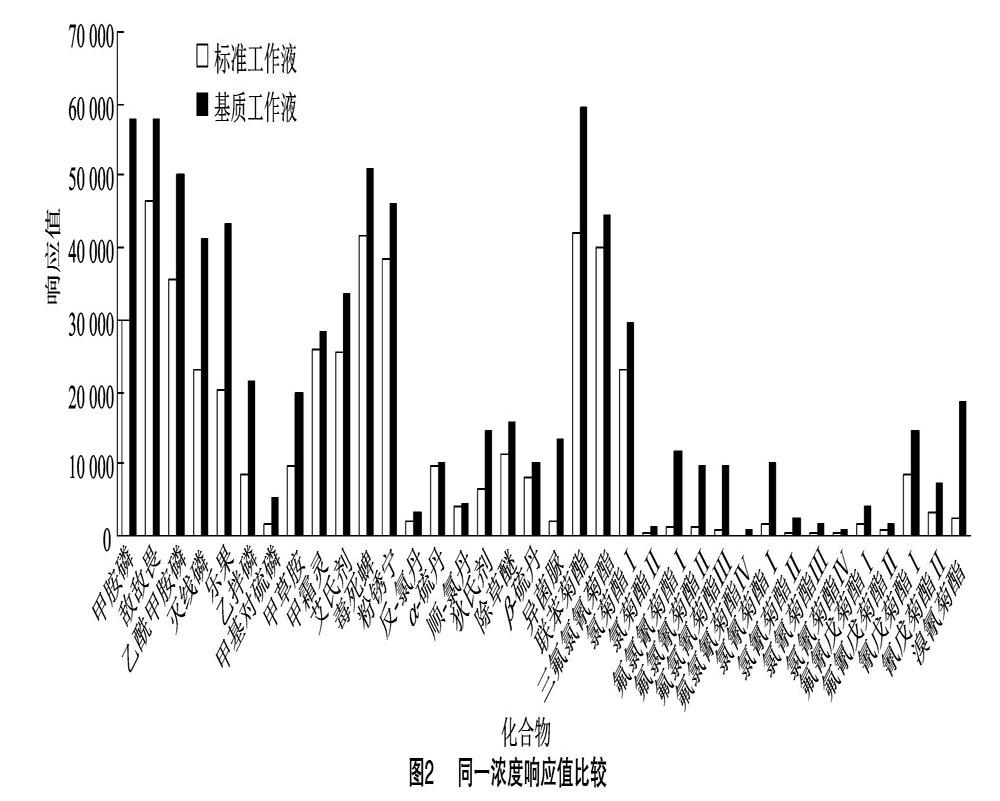
基质效应是农药残留检测中通常遇到的问题[11],茶叶样品基质成分复杂,在气相色谱-质谱法和液相色谱-串联质谱分析中,基质效应的存在不可避免,对于GC-MS/MS法测定农药残留通常有基质增强作用,而采用LC-MS/MS测定时,通常有基质抑制作用[12],通常的解决办法有用空白基质配制标准曲线[10]、稀释法和加入保护剂法[11-12]。本研究配制了茶叶基质的基质标准溶液和同浓度的溶剂标准溶液,并对同一质量浓度均为 0.50 μg/mL 的标准工作液和基质标准工作液进行对比,对基质效应进行考察,试验中以ME=Slopi/Slopo评价基质效应,其中ME为基质效应,Slopi为基质匹配标准曲线的斜率,Slopo为纯溶剂标准曲线的斜率[15],或者以如下公式进行计算:
基质效应=(基质标样峰面积-纯溶剂标样峰面积)/纯溶剂标样峰面积×100%。
基质干扰的大小即基质效应在80%以下视为强基质抑制效应,在80%~120%之间视为弱基质效应,在120%以上视为强基质增加效应[16-22]。基质效应结果见表2,浓度为0.50 μg/mL的响应值比较见图2。通过试验发现,在所检测的28种农药中,仅有8种农药的基质效应在80%~120%之间,属弱基质效应,其余都出现基质效应增强的趋势。试验采用基质匹配校准曲线对样品中的农药进行定量分析,对基质效应进行补偿,用以抵消基质效应的影响。
2.5 净化剂种类及用量的选择
茶叶中含有大量的色素、生物碱、甾醇、多酚类、水分等干扰物质。其中,水分会影响检测器的正常检测,并会对色谱柱的固定相造成化学损伤;茶多酚类物质是茶叶中的最主要干扰成分;叶绿素是茶叶中最直接可见的色素类干扰成分。因此,本研究在2 mL净化管中加入7.5 mg Bulk Carbograph、50.0 mg PSA、50.0 mg C18EC、150.0 mg MgSO4或150 mg PSA、45 mg GCB、900 mg MgSO4。对比2种净化剂对提取液中茶多酚和叶绿素的净化能力,通过分析,采用第一种净化剂净化后,28种农药的回收率的确比后者高,且净化后的样品颜色更浅。因此,采用第一种净化方式进行净化。
2.6 内标的选择
在茶叶基质干扰下,农药在前处理过程中易被吸附、降解和损失,因此采用内标法定量可以提高定量结果的准确性,本试验以阿特拉津作为内标物进行定量分析。
2.7 方法的线性范围和检出限、定量限
本试验用红茶作为空白样品,按“1.3.2”节制备基质提取液,并用基质提取液配制标准工作曲线序列。各种目标化合物响应值不同,在一定的含量范围内线性关系良好,相关系数r≥0.995。以3倍信噪比时对应的含量定位方法的检出限,为0.10~5.00 μg/kg;以10倍信噪比时对应的含量定位方法定量限,为0.30~15.00 μg/kg,方法的线性方程、检出限及定量限见表3。
2.8 方法的精密度和准确度
以样品空白进行高、中、低不同水平添加各试剂,平行6次试验,得到加标回收率为63.9%~102.9%,相对标准偏差(RSD)为2.05%~7.02%;其精密度和准确度可以满足分析要求,加标结果见表4。
2.9 实际样品测定
应用建立的分析方法对红茶、绿茶2个类别30件样品进行农药残留检测,发现在绿茶和红茶中均检出甲胺磷、毒死蜱、敌敌畏、联苯菊酯、氯菊酯、乙拌磷、甲基对硫磷等农药残留的样品,图3为绿茶中检出残留农药的多反应监测色谱图。
3 结论
本试验采用乙腈和正己烷共同作为提取溶剂,并以上清液正己烷作为检测溶液,经Bulk Carbograph、PSA、C18EC和MgSO4混合净化剂净化,以GC-MS/MS法检测,建立了检测茶叶中28种农药残留的气相色谱-质谱联用方法。本试验的方法与传统的提取方法相比,可直接使用正己烷进行提取进样,前处理更为方便,并减少了溶剂转换过程中农药成分的损失,提高了回收率。本试验的方法操作简便、快速、准确可靠,可以用作茶叶中多种农药残留量的检测方法。
参考文献:
[1]荣杰峰,韦 航,黄伙水,等. 茶叶农药残留检测的前处理新技术进展[J]. 分析测试学报,2016,35(1):8-12.
[2]Saito-Shida S,Nemoto S,Teshima R,et al. Multiresidue determination of pesticides in tea by gas chromatography-tandem mass spectrometry[J]. Journal of Environmental Science & Health Part B,2015,50(11):760-776.
[3]Hayward D G,Wong J W,Park H Y,et al. Determinations for pesticides on black,green,oolong,and white teas by gas chromatography triple-quadrupole mass spectrometry[J]. Journal of Agricultural & Food Chemistry,2015,63(37):8116-8124.
[4]潘胜东,叶美君,陈晓红,等. QuEChERS净化-超快速液相色 谱- 串联质谱法同时检测茶叶中常见的杀虫剂残留[J]. 卫生研究,2018,47(5):809-814.
[5]崔 鹏,马 晶,孙 谦,等. GC-MS/MS结合改进的QuEChERS方法测定茶叶中多农药残留[J]. 环境化学,2018,37(5):1175-1178.
[6]张秀丰,翟硕莉,杨亚君,等. 改良的QuEChERS-气相色谱-质谱联用法测定茶叶中多种农药残留[J]. 分析实验室,2018,37(5):524-528.
[7]李 玮,贾彦博,林伟杰,等. 分散固相萃取净化-气相色谱-质谱联用法测定茶叶中7种杀螨杀虫类农药残留[J]. 食品安全质量检测学报,2017,8(9):3485-3490.
[8]谭 君,文 洋,谭 斌,等. 茶叶中有机氯和拟除虫菊酯同时分析的简易前处理方法研究[J]. 现代食品科技,2017,33(2):223-229.
[9]刘家曾,宋宁慧,王艺璇,等. 基质固相分散-气相色谱/质谱联用技术测定茶叶中8种农药残留[J]. 分析科学学报,2018,34(3):337-341.
[10]黄田田,汤 桦,董晓倩,等. 多壁碳纳米管QuEChERS-气相色谱法测定茶叶中23种有机磷农药残留量[J]. 食品科学,2018,39(6):315-321.
[11]陈兴连,邵金良,方海仙,等. 气相色谱法同时快速测定茶饮料及其制品中17种有机氯、拟除虫菊酯农药残留[J]. 食品安全质量检测学报,2018,9(6):1275-1283.
[12]高艺羡,陈萍虹,聂丹丹,等. 气相色谱-串联质谱双内标法测定茶叶中53种农药残留[J]. 色谱,2018,36(6):531-540.
[13]黄超群,黄 雪,吴 娟,等. 多壁碳纳米管分散固相萃取-液相色谱-串联质谱法测定茶叶中5种烟碱类农药的残留[J]. 2018,54(5):584-590.
[14]赵小云,谢德芳. 超高效液相色谱-串联质谱对香蕉中苯醚甲环唑和噻呋酰胺农药残留的检测[J]. 江苏农业科学,2019,47(2):181-185.
[15]周 利,罗逢健,张新忠,等. 纳米竹炭分散固相萃取/超高效液相色谱-串联质谱法测定绿茶中的农药多残留[J]. 分析测试学报,2014,33(6):642-647.
[16]朱炳祺,金绍强,徐潇颖,等. 改进的QuEChERS方法结合在线凝胶色谱-气相色谱-串联质谱法测定茶叶中39种有机磷农药的含量[J]. 理化检验(化学分册),2018,54(4):433-442.
[17]张东飞,邹金梅,张朝晖,等. 液相色谱-串联质谱法测定茶叶中的11种农药残留[J]. 食品安全质量检测学报,2018,9(2):294-298.
[18]Li Y,Chen X,Fan C L,et al. Compensation for matrix effects in the gaschromatography-mass spectrometry analysis of 186 pesticides in tea matrices using analyte protectants[J]. Journal of Chromatogr A,2012,1266:131-142.
[19]Oellig C,Schwack W. Planar solid phase extraction clean-up for pesticide residue analysis in tea by liquid chromatography-mass spectrometry[J]. Journal of Chromatogr A,2012,1260:42-53.
[20]张利强,程盛华,李 琪,等. 气相色谱法测定谷物中9种有机磷农药残留量的基质效应[J]. 理化检验(化学分册),2016,52(2):136-140.
[21]Lópezfernández O,Rialotero R,Gonzálezbarreiro C,et al. Surveillance of fungicidal dithiocarbamate residues in fruits and vegetables[J]. Food Chem,2012,134(1):366-374.
[22]周 利,羅逢健,张新忠,等. 纳米竹炭分散固相萃取/超高效液相色谱-串联质谱法测定绿茶中的农药多残留[J]. 分析测试学报,2014,33(6):642-647.张 轩,李志伟,郑德聪,等. 基于模糊PID两轮拖拉机控制系统抗干扰分析[J]. 江苏农业科学,2020,48(12):216-222.
