胀果甘草发芽率测定及总RNA提取初步研究
2020-07-20努尔凯麦尔·木拉提

摘要:以胀果甘草(Glycyrrhiza inflata Batalin)种子为试验材料,通过实验室培养出甘草幼苗,利用Trizol试剂法来获取甘草叶片的总RNA,进一步通过琼脂糖凝胶电泳和测定吸光度(D值)以确定RNA浓度及纯度。试验结果表明,甘草种子的萌发率可达85%以上,采用本研究的方法可得到较纯RNA,紫外灯下可以观察到明显的28S、18S、5S的RNA条带,分光光度计测得的D值均为1.85,由此可以看出本实验室条件下培养的甘草萌发率较高,所获取的RNA完整且纯度较高。
关键词:胀果甘草;发芽率;总RNA;Trizol试剂
甘草是多年生单子叶植物,外表颜色呈红棕色,广泛分布于新疆与内蒙古地区,除此之外,在我国其他不少区域也有分布,是我国药品大词典记录的药物之一,广泛应用于医疗、日常生活以及化工等领域。甘草有3种,分别为具有抑制人类乳腺癌细胞作用的乌拉甘草(Glycyrrhiza uralensis),多应用于食品工程的胀果甘草(Glycyrrhiza inflata),常用于化工品的光果甘草(Glycyrrhiza glabra)。甘草的根和茎多作为医药品用,本试验仅利用甘草幼嫩叶片为试验研究对象[1]。
甘草根部在土壤中的生长能力强,以纵横交错的发达根系适应干旱地区的恶劣环境,具有较强的抗旱、抗寒、耐盐碱及防御风沙能力[2]。
当前研究者对甘草的研究集中于其医疗上的作用,以及其生理特性和无性生殖培育上的探究,而对于甘草耐盐性的评价与利用以及甘草耐盐基因挖掘分析等方面鲜有报道。盐碱性土壤不仅是影响新疆维吾尔自治区农业生产的因素,而且是全国农作物产量下降的主要因素。抗性资源基因的克隆与转化,可以提高目标植物的抗性,把甘草耐盐性基因转到其他农作物可以提高农作物产量,能有效降低盐碱性土壤对农作物的影响[3]。
伴随着现代克隆技术、分子生物科学、基因工程技术和基因组工程学等学科的发展,植物耐盐性基因的研究已经逐步深入[4]。专家已经证明了甘草体上存在耐盐基因并研究了耐盐性基因的功能,分析了耐盐基因性状的复杂性。耐盐基因是植物体本身具有的基因之一,大量研究证明,利用耐盐基因可看成对盐碱区域农业生产中受损农作物的有效救助方法[5]。
为充分利用我国盐碱地区的土地资源,合理增加盐渍化地区的土壤利用效率,提高农作物产量[6],本试验开展胀果甘草发芽率测定及总RNA的提取技术研究,以期为甘草耐盐性基因的克隆奠定基础,为后续的试验提供样品。
1 材料与方法
1.1 试验材料
胀果甘草(Glycyrrhiza inflata Batalin)种子购于新疆喀什地区喀什市两亚市场。由叶尔羌绿洲生态与生物资源新疆维吾尔自治区教育厅重点实验室鉴定。
1.2 试验仪器
营养钵,100 mL烧杯,500 mL烧杯,250 mL锥形瓶,研钵,CT15R型高速冷冻离心机(Hitachi公司),G13型紫分光光度计(Eppendorf),15 μL EP管,眼罩,500 mL容量瓶,DYY-6C型电泳仪(北京市六一仪器厂),电泳槽,FA2204N型电子天平,Eppendorf型10~100 μL移液器,Eppendorf型 100~1 000 μL移液枪,Eppendorf型20~200 μL移液枪,THERMO-SHAKER型超速混均器(江苏金坛仪通电子有限公司),玻璃棒,M1-2270EGC型微波炉(海尔公司),TYAB024/10型高压灭菌器(上海博讯实业有限公司),jy04S-3C凝胶成像系统(JUNYI),电子计时器,小型药勺,小刀片。
1.3 试验药品与试剂
营养土,沙土,浓硫酸,液态氮,R21086型Trizol试剂(上海源叶生物科技有限公司),氯仿溶液,异丙醇溶液,焦炭酸二乙酯粉(DEPC),乙二胺四乙酸(EDTA),Na2EDTA·2H2O,冰乙酸溶液,双蒸水溶液(去离子),溴乙锭溶液(EP染液),电泳缓冲液,75%乙醇溶液,铝锭buffer,琼脂粉,三羟甲基氨基甲烷粉(Tirs),10% TAE母液,DEPC水溶液,1%琼脂糖凝胶电泳液。
1.4 试验材料的培养及发芽率的测定
1.4.1 甘草种子的处理 把已经准备好的甘草种子在室温条件下用适量的浓硫酸浸泡40 min左右,并每隔 5 min 用玻璃棒充分搅拌1次,然后快速把浓硫酸倒掉,冲洗种子几遍,再把种子在蒸馏水中浸泡12 h。
1.4.2 甘草种子的萌发 把准备好的沙土与营养土按1 ∶ 1比例混合装在营养钵里培育种子。每钵播种50粒,覆上细土,喷水。
1.4.3 甘草种子萌发过程的观察 观察种子的萌发特征,如果营养沙土比较干要浇水,如果土壤比较湿润则喷水即可以。幼苗培育15~20 d后長到 3~4 cm 时可以用作试验材料;并计算萌发率:
萌发率=(萌发种子数÷供试种子数)×100%。
1.5 试验试剂配制
(1)75%乙醇溶液的配制:95%的乙醇溶液中按3.7 ∶ 1比例加入蒸馏水。
(2)10% TAE母液的配制:把已经称好的 24.2 g Tris、3.2 g Na2EDTA·2H2O装入500 mL烧杯中,向烧杯中倒入400 mL去离子水,充分搅拌好,用去离子水定容到500 mL后,室温保存备用,用的时候稀释10倍。
(3)DEPC水溶液的配制:按1 ∶ 1的比例,每500 mL蒸馏水中加入500 mL DEPC,配好后在室温下超净工作台上放置十几个小时,121 ℃ 灭菌30 min。
(4)1%琼脂糖凝胶电泳液的配制:称取琼脂糖粉0.24 g,加经过DEPC处理的ddH2O 12.04 mL,用微波炉加热,加热到沸腾,琼脂糖溶液颜色透明为止,保存备用,用的时候加热熔化。
1.6 甘草叶片总RNA的提取及检测
利用Trizol试剂提取植物总RNA是各种植物提取RNA使用最广泛的方法之一。
1.6.1 提取之前的准备工作 (1)首先把枪头、EP管消毒灭菌,各个玻璃仪器和试验工具烘干,避免裂解酶的污染。(2)使用Trizol试剂和溴乙锭(EB)、DEPC等毒性药品时要带手套和眼罩,要穿防护服并且在通风的条件下进行取用,避免中毒。(3)在进行每一步试验操作之前要换手套,其次在试验过程操作人员和操作旁观者,避免多说话避免外界环境中的RNA裂解酶的污染。(4)所有的试剂盒必须要用DEPC水处理灭菌后再次放在烘干箱内121 ℃进行灭菌。
1.6.2 使用Trizol试剂提取总RNA 首先在研钵内倒入少量无水乙醇,用打火机点燃消毒后,快速加入液氮,取切好的甘草叶片100~150 mg置于研钵内,再快速加入足够的液氮,研磨至粉末状态,将研磨后的样品细心加入到2个离心管中,用20~200 μL移液枪再加入Trizol试剂1 mL,分别反复充分混合后,室温放置15 min让核蛋白混合物分离,在4 ℃下12 000 r/min离心10 min,取上清液于新离心管中再加入0.2 mL的氯仿溶液盖好EP管盖子,用手剧烈摇荡离心管15 s,室温下放置 3 min,在4 ℃下12 000 r/min离心10 min,分3层再取上清液移到新的离心管,加入0.5 mL的异丙醇溶液,盖上管子室温放置10 min,在4 ℃下 12 000 r/min 离心10 min,倒掉上清液,加入75%乙醇洗涤沉淀,再倒掉上层液,然后在室温条件下插入冰片内静置 10 min 干燥多余的乙醇后,加入DEPC水溶解沉淀。把样品标好号码在-20 ℃保存待用。
1.7 RNA琼脂糖凝胶电泳
1.0%的琼脂糖在微波炉熔化,注入到已备好的电泳槽里,再用 1×TAE电泳缓冲液制作琼脂糖凝胶电泳水,加1×TAE电泳缓冲液至液面覆盖凝胶,用10~100 μL移液枪吸取含总RNA样品4 μL的铝锭bufeer缓冲液,混匀后,小心加入点样孔,然后打开电泳仪电泳开关,电压调节到100 V后,让RNA样品从负极走向正极电泳方向,大约30 min后把凝胶放入EP染液中染色 5 min,用水冲洗1次,在紫外检测灯下观察RNA电泳条带,然后用照相仪器记录好条带相,分析结果。
1.8 总RNA的D值测定及RNA得率的计算
D值测定具体步骤如下:取EP管里用10~100 μL 的移液枪取少量待测的RNA样品,用DEPC水稀释100倍,在260 nm、280 nm处调节紫外分光光度计的读数为零,再加入待测RNA样品在波长处读取D值。
RNA得率(μg/g)=D260 nm×稀释倍数×40/1 000。
2 结果与分析
2.1 种子处理和萌发过程数据处理结果
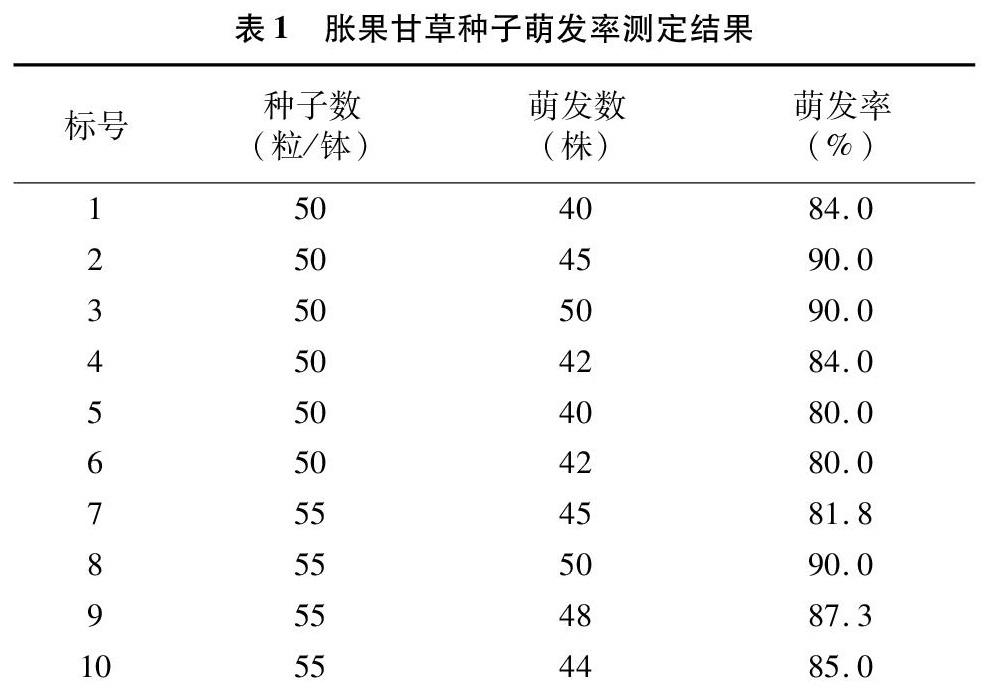
通过98%浓硫酸处理,在提供充足的光照、水、营养成分、氧气时甘草种子的萌发率可达85%以上。胀果甘草萌发率数据和萌发情况见表1。
2.2 琼脂糖凝胶电泳条带结果与分析
琼脂糖凝胶电泳法是检测植物总RNA的一种主要检测方法,从凝胶成像系统所观察的条带不仅可以判断RNA的完整性与裂解程度,也能判断出所得RNA内有没有含蛋白质、多糖,以及DNA等污染杂质成分。所获得的RNA凝胶电泳结果如图1所示。
由图1可以看到,琼脂糖平面上的3个条带,分别为28S、18S和5S,各个条带之间分层明显且无缺,没有发现拖尾现象,点样孔干净,说明获取的RNA比较完整,基本没有蛋白质、多糖、DNA等杂质污染。
2.3 总RNA吸光度(D值)检测结果与分析
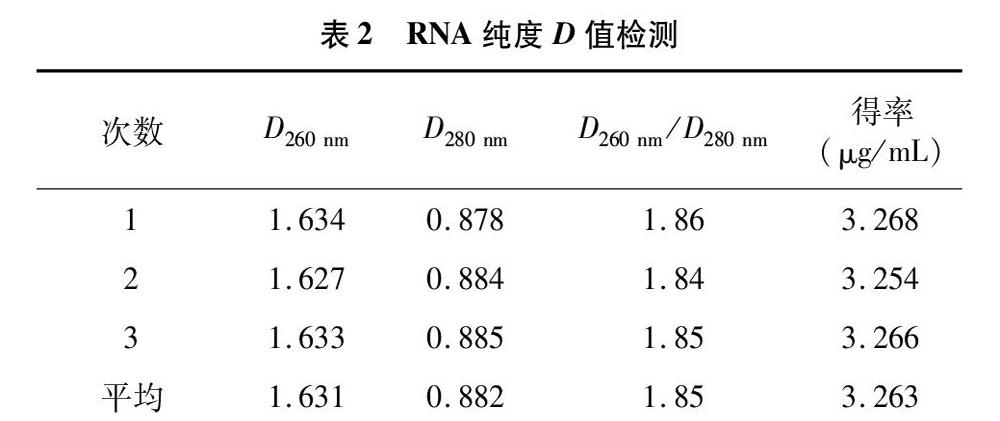
RNA样品的D260 nm/D280 nm的比值为1.8~2.0时,获得的RNA较纯。如比值比较低,说明有残余DNA或蛋白质存在或其中发生酚污染,如果比值太高说明RNA有降解。本试验中所获得的RNA的D值(表2)显示,3次所得到的D260 nm/D280 nm平均值为1.85,得率平均值为3.263 μg/mL,此值表明所获得的RNA纯度较高。
3 结论与讨论
本试验以胀果甘草种子为试验材料,在实验室条件下培养出甘草幼苗,测定甘草萌发率,利用Trizol试剂提取甘草幼苗叶片茎总RNA的提取方法。从萌发率测定结果和总RNA提取结果可以得出,经过98%浓硫酸处理,并提供充足的光照、水、营养成分、氧气时甘草种子的萌发率为可达80%以上。
对植物材料进行cDNA扩增及后续研究工作,需提取高质量、高反转录活性的总RNA[7-8]。前人已经对盐生植物材料如梭梭[9]、沙棘[10]、骆驼蓬[11]、盐芥[12]等叶片的总RNA提取研究,但是由于植物总RNA的提取具有很强的种属和组织的特异性,因此,需要根据不同物种及不同组织的特性选择或改良相应的方法。本研究采用Trizol法提取甘草叶片RNA,与已经报道的部分盐生植物的RNA提取方法不同。本试验用Trizol法提取的总RNA的D260 nm/D280 nm的值为1.85,表明提取的总RNA纯度较高。植物RNA的主要成分是28S、18S和5S rRNA,RNA有无降解及降解的程度,以及是否存在DNA、蛋白质和多糖的污染都可以从电泳胶上28S和18S rRNA的完整性来判断。本试验所提取的RNA在1.0%的非变性凝胶电泳结果显示,28S和18S的比值接近2 ∶ 1,说明RNA没有降解,可用于后续的试验。
参考文献:
[1]姚 辉. 乌拉尔甘草遗传多样性与品质评价及槲寄生的抗氧化活性成分[D]. 上海:复旦大学,2006.
[2]张爱霞. 药用甘草幼苗拒Na+部位及其拒Na+机理的研究[D]. 石河子:石河子大学,2015.
[3]张兴富. 提高农作物种子质量的作用[J]. 现代园艺,2016(18):228.
[4]杨青川,孙 彦,康俊梅. 紫花苜蓿耐盐相关基因克隆研究进展[J]. 草地学报,2005(3):253-256.
[5]周以飞,戴 艳,潘大仁,等. 花叶病毒侵染的果蔗(Badila)的基因表达[J]. 福建农林大学学报(自然科学版),2006,35(3):288-291.
[6]乔建明,王洪军,李举文,等. 土壤盐碱地现状、改良利用及盐碱治理在新疆农业发展中的意义[J]. 新疆农垦科技,2015(10):54-56.
[7]努尔凯麦尔·木拉提,王希东,帕尔哈提·阿布都克日木. 骆驼刺叶片总RNA提取方法比较[J]. 喀什师范学院学报,2013(6):44-46.
[8]Sambrook L J,Man I T,Fritsch E F. Molecular cloning[M]. NewYork:Cold Spring Harbor Laboratory Press,2004.
[9]甘晓燕,石 磊,陈虞超,等. 梭梭Na+/H+逆向转运蛋白基因克隆及分析[J]. 西北植物学报,2012,32(2):225-230.
[10]郭长奎,罗淑萍,沙依拉,等. 沙棘耐盐基因HrNHX1的克隆及3′UTR序列分析[J]. 新疆农业科学,2009,46(5):1031-1035.
[11]石庆华,代培红,许 磊. 骆驼蓬总RNA的4种提取方法比较[J]. 内蒙古农业大学学报(自然科学版),2010,13(4):152-155.
[12]蔡小宁,杨 平,賁爱玲,等. 盐芥ThNHX1基因的3′RACE[J]. 安徽农业科学,2006,34(21):5485-5486,5524.张 鑫,孙洪新,刘 月,等. 绵羊背最长肌组织中TMOD4基因表达差异研究[J]. 江苏农业科学,2020,48(12):48-52.
