hMOF对子宫内膜癌细胞生物学行为的影响
2020-07-20齐跃叶秋霖刘娟娟林蓓
齐跃,叶秋霖,刘娟娟,林蓓
(中国医科大学附属盛京医院妇产科,沈阳 110004)
子宫内膜癌是子宫内膜上皮源性恶性肿瘤,占女性生殖系统恶性肿瘤的20%~30%。近年来,其发病率和病死率呈上升趋势,发病年龄亦趋于年轻化[1]。组蛋白乙酰化修饰是重要的表观遗传学修饰之一,可通过改变某些特殊位点的组蛋白与DNA的某些区域结合的紧密性,从而改变相关基因的转录,影响转录调节[2]。组蛋白乙酰化修饰受乙酰化酶和去乙酰化酶的双重调节[3],hMOF是组蛋白乙酰化酶三大家族中MYST家族的重要成员[4],又被称为MYST1或赖氨酸乙酰转移酶8(lysine acetyltransferase 8,KAT8)。hMOF基因定位于人染色体16p11.2,编码467个氨基酸,分子量52.4×103。hMOF参与胚胎发育、维护染色体的稳定性[5]、DNA损伤修复[6-7]、转录调节等多种重要基础生命过程,hMOF表达异常亦影响多种恶性肿瘤的发生、发展和预后[8-9]。而hMOF在子宫内膜癌中的表达情况尚未见报道。本研究采用小干扰RNA(small intefering RNA,siRNA)
技术抑制子宫内膜癌细胞中hMOF的表达,检测细胞增殖、凋亡、迁移和侵袭能力的改变,为组蛋白乙酰化修饰成为子宫内膜癌新的治疗靶点提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞系:人子宫内膜癌细胞系Ishikawa购于中国科学院上海生命科学院细胞库,由盛京医院妇产科实验室保存。
1.1.2 主要试剂:hMOF鼠抗人单克隆抗体(美国GeneTex公司);GAPDH鼠抗人单克隆抗体、HRP标记山羊抗小鼠IgG、HRP标记山羊抗兔IgG(北京中杉金桥试剂公司);RPMI 1640培养基、胎牛血清(美国Gibco公司);胰酶、DMSO(美国Sigma公司);TRIzol试剂、Lipofectamine 3000转染试剂(美国Invitrogen公司);MTT(中国Solarbio公司);细胞周期试剂盒、Annexin-Ⅴ-APC/7AAD试剂盒(中国凯基公司);Transwell小室、细胞培养板、培养瓶、培养皿(美国Corning Coster公司);BCA试剂盒(上海碧云天公司);琼脂糖(美国Promega公司);PVDF膜(美国Millipore公司);hMOF siRNA 片段和空白对照片段(上海吉玛制药技术有限公司)。
1.2 实验方法
1.2.1 细胞培养:人子宫内膜癌Ishikawa细胞,在含10%胎牛血清的RPMI 1640培养基中,37 ℃、5% CO2及饱和湿度条件下进行常规培养,每2~3 d传代1次,用0.25%胰蛋白酶进行细胞消化,取指数生长期细胞用于实验。
1.2.2 细胞转染:取指数生长细胞接种于6孔板中,培养至融合度达到50%左右进行细胞转染,按照转染试剂盒说明书进行,更换Opti-MEM培养基,加入含有干扰片段1.5 μg的培养基,混匀,加入促转染试剂3.75 μL,避光室温放置5 min,加入混合好的转染复合物,摇匀,继续培养24 h,更换含有10%胎牛血清的培养基。转染72 h后检测干扰效果,使用转染48~72 h的细胞进行细胞学实验。共设3组:对照组、空白转染对照组(siRNA-NC组)和实验组(siRNAhMOF组)。
1.2.3 Western blotting检测hMOF蛋白水平:取指数生长期细胞,漂洗,加入细胞裂解液,冰上静置裂解,刮取细胞,超声波进一步裂解,离心,留取上清,采用BCA法测∶定细胞中的总蛋白浓度,按比例稀释蛋白样品,煮沸蛋白变性。配制SDS-聚丙烯酰胺凝胶,蛋白上样至孔槽中,每孔上样量为50 μg,电压为浓缩胶80 V、分离胶120 V条件下电泳。将PVDF膜在甲醇中浸泡5 min;4 ℃ 90 V电压转印1~3 h至PVDF膜。脱脂牛奶封闭,孵育一抗,hMOF鼠抗人单克隆抗体(1 ∶100),GAPDH鼠抗人单克隆抗体(1 ∶3 000),封膜,4 ℃摇床孵育过夜。室温复温,漂洗,孵育二抗,HRP标记的山羊抗小鼠IgG(1 ∶5 000)或山羊抗兔IgG(1 ∶5 000)室温摇床孵育2 h。漂洗,显色。Image J软件测目的蛋白条带相对蛋白表达量。
1.2.4 MTT法检测细胞增殖能力:取指数生长期细胞,稀释成浓度为3×103/mL的细胞悬液,接种于96孔板,每孔加入200 μL,细胞24 h充分贴壁伸展后加入小干扰试剂,继续培养,分别于1、2、3、4 d,每孔加入20 μL MTT(5 mg/mL),继续培养4 h,吸去培养液,加入150 μL DMSO,震荡10 min,酶联检测仪检测吸光度(490 nm)。每组设3个重复孔,实验重复3次,以吸光度为纵坐标制作细胞生长曲线。
1.2.5 流式细胞仪检测细胞凋亡:采用Annexin-Ⅴ-APC/7AAD双染法检测细胞凋亡,按凋亡试剂盒说明书操作,用不含EDTA的胰酶消化细胞,收集细胞沉淀,重悬细胞,先后加入5 μL APC染剂和7AAD染剂,孵育,上机检测存活、早期凋亡、晚期凋亡和死亡细胞百分比。实验重复3次。
1.2.6 划痕实验检测细胞迁移能力:取指数生长细胞接种于6孔板,融合度达90%,用移液枪头(10 μL)在孔板中心划取直线划痕,PBS轻柔冲洗,更换无血清培养基,培养24 h,分别在显微镜下观察划痕宽度并拍照。实验重复3次。
1.2.7 Transwell实验检测细胞迁移能力:Transwell小室上室内铺Matrigel胶,干燥后,下室加入500 μL 5%胎牛血清培养基,上室加入200 μL无血清培养基细胞悬液(细胞数量2×105个),37 ℃孵育72 h后取出小室。多聚甲醛固定,结晶紫染色,用棉签将上室擦净,显微镜下计数下室滤膜面浸润细胞数。实验重复3次。
1.3 统计学分析
2 结果
2.1 siRNA干扰hMOF前后子宫内膜癌细胞hMOF蛋白水平的变化
将子宫内膜癌Ishikawa细胞瞬时转染siRNA靶向干扰hMOF,Western blotting检测转染前后hMOF蛋白水平的变化,结果显示,siRNA-hMOF组与siRNANC组相比hMOF蛋白水平明显下降,差异有统计学意义(P< 0.05),表明hMOF被有效沉默。见图1。
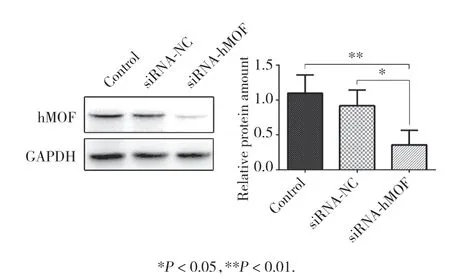
图1 Western blotting检测siRNA干扰hMOF前后Ishikawa细胞hMOF蛋白的表达水平Fig.1 Expression of hMOF before and after transfection of siRNA-hMOF in Ishikawa cells detected by Western blotting
2.2 干扰hMOF表达前后子宫内膜癌细胞增殖能力的变化
检测干扰hMOF表达前后Ishikawa细胞在不同时间点(1、2、3、4 d)的OD值,并绘制增殖曲线。MTT实验结果表明,4 d时siRNA-hMOF组与siRNA-NC组相比细胞增殖能力明显下降(P< 0.01),siRNA-NC组与对照组相比无明显差异。见图2。
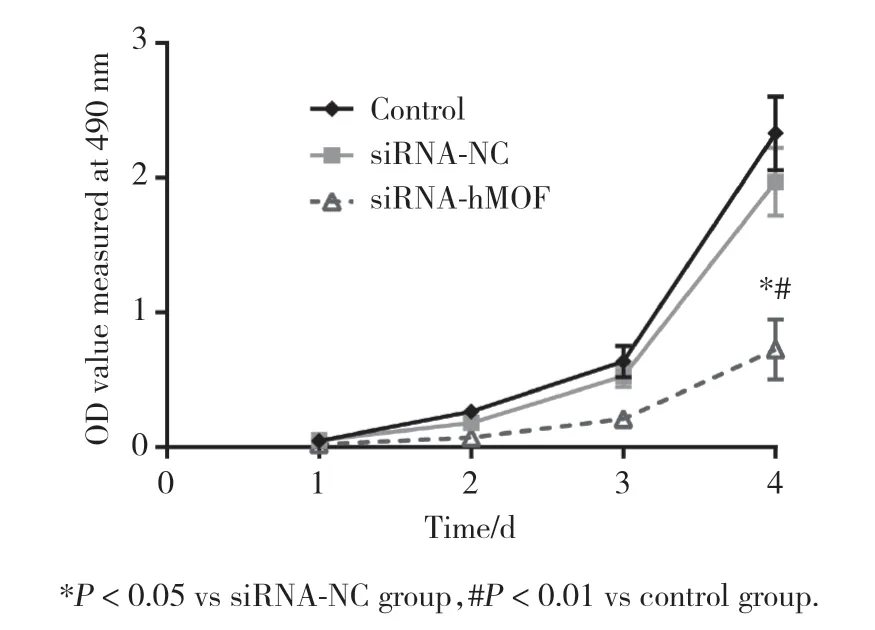
图2 MTT实验检测siRNA干扰hMOF前后Ishikawa细胞增殖能力的变化Fig.2 The proliferation ability before and after transfection of siRNA-hMOF in Ishikawa cells detected by MTT assay
2.3 干扰hMOF表达前后子宫内膜癌细胞凋亡的变化
采用流式细胞术检测干扰hMOF表达前后Ishikawa细胞凋亡的变化,结果显示,siRNA-hMOF组细胞的早期凋亡率和晚期凋亡率(分别为5.18%和8.28%)较siRNA-NC组(分别为3.83%和4.98%)均增加,差异均有统计学意义(P< 0.05)。见图3。

图3 Annexin-Ⅴ-APC/7AAD双染检测siRNA干扰hMOF前后Ishikawa细胞凋亡的变化Fig.3 The apoptosis rates before and after transfection of siRNA-hMOF in Ishikawa cells detected by Annexin-Ⅴ-APC/7AAD assay
2.4 干扰hMOF表达前后子宫内膜癌细胞迁移能力的变化
划痕实验检测结果显示,siRNA-hMOF组细胞迁移能力较siRNA-NC组明显减弱,差异有统计学意义(P< 0.05),siRNA-NC组与对照组相比无明显差异。见图4。
2.5 干扰hMOF表达前后子宫内膜癌细胞侵袭能力的变化
siRNA-hMOF组与siRNA-NC组相比穿膜细胞数明显下降,差异有统计学意义(P< 0.001),siRNA-NC组与对照组相比无明显差异。见图5。

图4 划痕实验检测siRNA干扰hMOF前后Ishikawa细胞迁移能力的变化Fig.4 The migration ability before and after transfection of siRNA-hMOF in Ishikawa cells detected by wound healing test
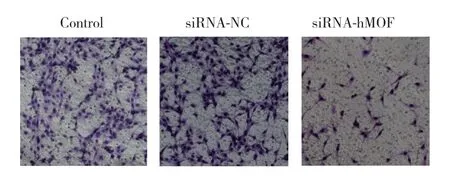
图5 Transwell实验检测siRNA干扰hMOF前后Ishikawa细胞侵袭能力的变化Fig.5 The invasion ability before and after transfection of siRNAhMOF in Ishikawa cells detected by Transwell assay
3 讨论
子宫内膜癌是女性生殖系统的三大恶性肿瘤之一,发病率呈逐年上升趋势,并且逐渐趋于年轻化,但其发病机制目前仍不十分明确,进一步研究其肿瘤恶性生物学行为的分子机制尤为重要,探寻更为有效的治疗靶点具有临床意义。
近年来,有学者逐渐发现肿瘤并非全部由基因异常引起,表观遗传学即非DNA水平改变导致的基因表达水平变化亦在肿瘤的发生、发展过程中发挥重要作用,故越来越受到重视。组蛋白乙酰化酶与组蛋白去乙酰化酶二者共同作用,维持着特殊位点的组蛋白赖氨酸残基的乙酰化水平的动态平衡,导致表观遗传学改变,从而调控某些基因的转录。hMOF是三大乙酰化酶家族中MYST家族中的重要成员。组蛋白有多个乙酰化位点,但人类的正常细胞中大约有60%的H4组蛋白仅发生16位赖氨酸单一位点的乙酰化,即多种疾病与该位点的乙酰化水平存在相关性。hMOF则能特异性乙酰化组蛋白H4K16位点[9-10],与胚胎发育、维护染色质结构[9]、染色体稳定性、转录调节[5-7]、DNA损伤修复[6]等密切相关。可见,hMOF在多种基础生理过程中起着调控作用,而hMOF酶活性的丧失可能在细胞恶性转化过程中发挥着重要作用。
已有研究表明,hMOF的表达异常与多种恶性肿瘤的发生、发展以及预后密切相关,但其在不同肿瘤中的表达并不完全相同。hMOF在某些肿瘤中表达增高,表现为致癌作用。有研究[11]发现,在非小细胞肺癌组织中hMOF和H4K16乙酰化水平较正常组织升高,hMOF能够促进非小细胞肺癌细胞增殖、迁移、黏附,并通过Skp2促进肿瘤细胞进入S期,与肿瘤进展相关。还有研究[12]发现,hMOF介导Nrf2乙酰化,促进了非小细胞肺癌细胞的增殖和耐药。前列腺癌研究[13]发现,hMOF与WDR5在雄激素受体靶基因上存在共定位,敲除hMOF基因后,显著降低了雄激素受体靶基因的表达,且降低了前列腺癌细胞增殖。口腔舌鳞状细胞癌研究[14]发现,hMOF在癌组织中呈高表达,且与不良预后相关,同时EZH2(Zeste基因增强子人类同源2)亦呈高表达,敲低hMOF降低了EZH2的表达,可见EZH2是hMOF的作用靶点之一。然而,hMOF在其他某些肿瘤中表达却降低,表现为抑癌作用。肾癌、结直肠癌和胃癌研究[15]发现,hMOF蛋白和mRNA表达水平均明显降低,与胃癌患者的生存时间存在相关性。肾透明细胞癌、乳腺癌和髓母细胞瘤研究[16-17]发现,hMOF的表达与H4K16位点的乙酰化水平均明显降低,其表达下降是髓母细胞瘤患者预后的独立危险因素。在肾透明细胞癌中,其表达还与临床分期、病理分级密切相关[18]。在肝癌组织和细胞中hMOF蛋白和mRNA水平均显著下降,hMOF低表达预示总生存和无病生存情况较差;敲低hMOF后则促进了肝癌细胞生长,过表达hMOF则抑制其生长[19]。本课题组的前期研究曾检测卵巢癌组织中hMOF的表达,在上皮性卵巢癌中,其蛋白和mRNA水平均显著降低,与分期存在密切相关;且hMOF高表达患者的生存时间明显高于低表达患者,从而说明hMOF高表达在卵巢癌中是一种保护性因素[20]。可见,hMOF在多种恶性肿瘤的发生、发展过程中发挥重要作用,但其作用并不完全相同。
hMOF在子宫内膜癌中的表达及其与肿瘤恶性生物学行为的关系尚未见报道,因此本研究在子宫内膜癌Ishikawa细胞中进行了检测,发现hMOF呈高表达,本研究又将Ishikawa细胞瞬时转染hMOF的小干扰片段,敲低hMOF后,表现为Ishikawa细胞的增殖能力明显下降,早期凋亡率和晚期凋亡率均增加。本研究发现,hMOF与子宫内膜癌细胞的增殖存在相关。敲低hMOF后,Ishikawa细胞的迁移和侵袭能力均明显下降。可见,hMOF同时又与肿瘤细胞的转移相关。
综上所述,本研究通过siRNA技术构建了hMOF低表达的子宫内膜癌细胞系,以探讨hMOF在子宫内膜癌恶性生物学行为中的作用。本研究结果提示,干扰hMOF表达后,抑制了子宫内膜癌Ishikawa细胞的增殖、迁移和侵袭,促进了细胞凋亡。可见,hMOF在子宫内膜癌的恶性进展中发挥重要作用,可能影响子宫内膜癌预后。本研究仅局限在hMOF对子宫内膜癌细胞体外恶性生物学行为的影响,与子宫内膜癌的关系及其作用机制尚有待进一步深入研究,以期为子宫内膜癌的治疗寻找新的靶点。
