芍药苷通过促进细胞自噬抑制H2O2诱导的SH-SY5Y细胞的氧化损伤
2020-07-18余婧萍宋祯彦李富周贺春香成绍武
余婧萍 宋祯彦 李富周 贺春香 成绍武

〔摘要〕 目的 研究芍藥苷对氧化损伤细胞模型的抗氧化作用和细胞自噬的调控作用。方法 以H2O2诱导的SH-SY5Y细胞系构建氧化损伤模型。实验设对照组,模型组,芍药苷低、中、高剂量组。采用MTT法检测芍药苷干预后细胞存活率;2',7'-二氯荧光素二乙酸酯(DCFH-DA)检测细胞内ROS水平;Ad-mCherry-GFP-LC3B融合蛋白腺病毒检测细胞自噬水平;Western blot检测细胞自噬相关蛋白LC3及SQSTM1/p62的表达水平。结果 250 μmol/L H2O2干预24 h后SH-SY5Y细胞存活率约55%为模型复制条件。芍药苷低、中、高剂量干预后,与模型组比较,细胞存活率呈剂量依赖性上升(P<0.05)。与对照组相比,模型组细胞内ROS水平升高,差异具有统计学意义(P<0.05);自噬溶酶体形成受阻;LC3Ⅱ及SQSTM1/p62在细胞内表达升高,差异具有统计学意义(P<0.05)。芍药苷的干预可促进自噬小体与溶酶体结合;与模型组比较,芍药苷中、高剂量组细胞内ROS水平显著下调(P<0.05);细胞内LC3Ⅱ及SQSTM1/p62的表达降低,差异具有统计学意义(P<0.05)。结论 芍药苷可通过促进细胞自噬改善H2O2诱导的SH-SY5Y细胞氧化损伤。
〔关键词〕 芍药苷;SH-SY5Y细胞;细胞自噬;LC3;SQSTM1/p62;氧化应激;过氧化氢
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.06.003
〔Abstract〕 Objective To investigate the antioxidant effect of Paeoniflorin on oxidative damage cell model and the regulation of autophagy. Methods Methyl thiazolyl tetrazolium (MTT) assay was used to determine the cell activity and to construct the H2O2-induced cell damage model with the optimal time and dose. A control group, model group and low-dose, medium-dose and high-dose paeoniflorin groups were set up. MTT method was used to detect cell viability after PF intervention. 2′,7′-Dichlorofluorescin diacetate (DCFH-DA) was used to detect ROS. Ad mCherry-GFP-LC3B fusion protein was used to detect cell autophagy, and western blot was adopted to detect the expression level of LC3 and SQSTM1/p62 after the intervention. Results After 24 h of intervention with 250 μmol/L H2O2, SH-SY5Y cell viability was about 55%, which was the copy modeling condition. After low, medium and high-dose paeoniflorin intervention on H2O2 damaged cell model, compared with the model group, the cell viability showed a dose-dependent increase (P<0.05). Compared with the control group, the intracellular ROS level of the model group increased, and the difference was statistically significant (P<0.05); autophagolysosome formation was blocked; the expression of LC3Ⅱ and SQSTM1/p62 increased, and the difference was statistically significant (P<0.05). The intervention of paeoniflorin can promote the combination of autophagosomes and lysosomes; compared with the model group, the level of ROS in the cells of the medium and high dose groups was significantly reduced (P<0.05); the expression of LC3Ⅱ and SQSTM1/p62 was reduced, and the difference was statistically significant (P<0.05). Conclusion Paeoniflorin can improve H2O2-induced oxidative damage of SH-SY5Y cells by promoting autophagy.
〔Keywords〕 paeoniflorin; SH-SY5Y; autophagy; LC3; SQSTM1/p62; oxidative stress; hydrogen peroxide
阿尔茨海默病(Alzheimers disease, AD)是一种严重的中枢神经系统退行性疾病,其起病隐匿,与年龄高度相关。临床上以进行性的认知功能障碍为主要特征,常表现为失语、失用、失认等,严重时生活不能自理。据国际阿尔兹海默症研究协会(Alzheimers Disease International,ADI)估计,世界上每3秒就会多一位痴呆患者,到2030年,全球痴呆患者总数将达到7 500万,到2050年,将达到1.3亿[1]。现已发现大约100种类型的痴呆,其中AD是目前老年人群中最常见的痴呆症形式。AD对老年人的健康危害极大,已成为世界上第五大死亡原因[2]。随着人类社会人口老龄化趋势日渐严峻,AD给社会和家庭带来的影响已经引起人类社会的高度关注。
淀粉樣前体蛋白(amyloid precursor protein,APP)的异常切割导致形成的不溶性β-淀粉样蛋白(amyloid-β,Aβ)在细胞外沉积而形成的老年斑块以及过度磷酸化的tau蛋白在细胞内形成的神经原纤维缠结(neurofbrillary tangles,NFTs)是AD的主要病理特征。这些毒性物质在脑内积聚引起海马内嗅皮层和CA1区神经细胞逐渐丢失导致认知功能障碍[3]。研究表明,在AD早期,Aβ沉积和NFTs的形成之前,大脑海马区存在活性氧(reactive oxygen species,ROS)增多等氧化损伤特征[4],且能促进tau蛋白磷酸化和NFTs的形成[5]。氧化应激是由于自由基和活性氧大量表达,氧化程度超出细胞清除能力而导致氧化系统与抗氧化系统失衡引起的。ROS形成是氧正常代谢的天然副产物,并且在细胞信号传导和体内平衡中具有重要作用,参与细胞的代谢与稳态调节;而过量的ROS累积会引起脂质、蛋白质和核酸的氧化损伤,导致细胞功能障碍和细胞死亡[6]。H2O2是一种非常重要的活性氧,可导致细胞内蛋白、核酸以及脂类代谢产物不同形式的氧化改变,然后触发细胞死亡[7]。此外,适量ROS可以激活细胞自噬,但大量ROS在细胞内累积会阻碍细胞自噬的发生。AD和自噬之间存在联系,自噬功能障碍可能会促进AD的发病。研究表明,自噬体的无效降解在AD的病理过程中占有重要作用。通常,自噬泡(autophagic vacuoles,AVs)在正常大脑中很少见,但在AD患者的大脑中却增加;此外,细胞自噬参与线粒体降解过程以维持细胞能量代谢平衡,研究表明AD脑内存在能量代谢异常可能与自噬-溶酶体途径异常导致细胞内受损线粒体的降解不足有关[8]。AD早期存在的氧化应激状态可损伤线粒体功能,线粒体功能障碍可能会进而影响自噬-溶酶体途径[9]。然而,AD中氧化应激、自噬功能障碍和神经元死亡之间的关系仍不清楚。因此,探索改善AD中氧化损伤及自噬功能障碍的有效药物对于攻克AD这一世界难题具有较高的临床应用价值。
汉代的《神农本草经》中有关于白芍的最早记载,为毛茛科植物芍药的干燥根,具有养血调经,敛阴止汗,柔肝止痛,平抑肝阳之功效。芍药苷(paeoniflorin)是芍药或牡丹根皮中提取的水溶性单萜苷,是中药白芍的主要有效成分之一。研究表明,芍药苷可改善AD[10]、帕金森氏病[11]、糖尿病性肾病[12]等疾病引起的损伤。芍药苷对这些疾病的改善作用,可能是与其具有抗炎、抗氧化、调节自噬、改善学习记忆能力的作用相关[13-15]。以往研究结果表明,芍药苷可通过激活LKB1/AMPK信号通路改善大鼠缺血再灌注(I/R)损伤后的自噬障碍,从而有效缓解肠道I/R损伤[16]。芍药苷还可改善氧化型低密度脂蛋白抑制的HUVEC细胞的细胞活力,并通过增强自噬改善细胞受损,从而对氧化型低密度脂蛋白诱导的HUVEC细胞的损伤起到保护作用[17]。此外,芍药苷还能通过自噬相关的钙蛋白酶/Akt/GSK-3β相关途径降低tau蛋白的过度磷酸化水平,从而减轻冈田酸对SH-SY5Y细胞的损害。虽然目前关于芍药苷改善自噬方面的研究已有一定成果,但尚未报道芍药苷是否可以减轻氧化损伤或氧化应激对AD早期神经细胞的影响,需要进一步研究其潜在分子机制。本实验采用H2O2诱导SH-SY5Y细胞构建细胞氧化损伤模型并给予不同浓度芍药苷干预,观察芍药苷的抗氧化损伤作用及对细胞自噬的影响,探讨芍药苷调控自噬与改善氧化损伤之间的联系。
1 材料
1.1 细胞
SH-SY5Y细胞株购自中国科学院上海生命科学研究所。SH-SY5Y细胞培养于25 cm2培养瓶中,培养瓶中加入DMEM/F12(1∶1)完全培养基(美国Hyclone公司),置于37 ℃、5%CO2培养箱(美国Thermo Fisher公司)中培养细胞。待细胞融合至80%左右时,用胰蛋白酶-EDTA消化液(中国索莱宝公司)消化细胞,重悬,计数,根据实验需求将细胞按不同密度接种至孔板中,或将细胞传代培养。
1.2 主要药物和试剂
芍药苷(IP0030)、噻唑蓝(methyl thiazolyl tetrazolium,MTT,M8180)购自中国索莱宝公司;二甲基亚砜(DMSO,D806645)购自中国麦克林公司;过氧化氢溶液(H2O2,323381)、2',7'-二氯荧光素二乙酸酯(DCFH-DA,D6883)购自美国Sigma公司;mCherry-GFP-LC3B融合蛋白的腺病毒(Ad-mCherry-GFP-LC3B,C3011)、SDS-PAGE蛋白上样缓冲液(5X,P0015L)购自中国Beyotime公司;RIPA裂解液(01408/504074)、蛋白酶抑制剂混合物(CW2200)购自康为世纪生物科技有限公司;BCA蛋白定量分析试剂盒(NCI3227CH)购自美国Thermo Fisher公司;Torin1(S2827)购自Selleck Chemicals公司;小鼠单克隆SQSTM1/p62抗体(ab56416)购自美国Abcam公司;兔多克隆LC3抗体(bs-8878R)和兔多克隆β-actin抗体(bs-0061R)购自北京博奥森生物有限公司;山羊抗兔二抗(AP132P)和山羊抗小鼠二抗(AP124)购自美国Sigma-Aldrich公司。
1.3 主要仪器
加热型五段程控金属浴(北京天根生化科技有限公司);化学发光凝胶成像仪(美国BIO-RAD公司);小型台式离心机、CO2培养箱(美国Thermo Fisher公司);倒置荧光显微镜(德国ZEISS公司);多功能酶标仪(美国BioTek公司);共聚焦激光显微镜(日本Nikon公司)。
2 方法
2.1 建立H2O2诱导的SH-SY5Y细胞损伤模型
模型建立步骤参照本课题组前期发表文献[18]。
2.2 实验分组
待细胞融合至80%左右时,接种细胞:12孔板约1×105个/孔、6孔板约4×105个/孔。将细胞置于培养箱中培养过夜,根据实验需求给予不同处理,分别设置对照组、模型组(250 μmol/L H2O2)和芍药苷低(5 μmol/L)、中(10 μmol/L)、高(20 μmol/L)剂量组。
2.3 细胞内ROS水平检测
12孔板中经处理后的细胞,吸弃旧培养基加入工作浓度为1 μmol/L的DCFH-DA的新鲜培养液后,继续培养30 min,PBS洗3次,使用倒置荧光显微镜成像,每组随机选取5个视野,所采集的图片使用Image J软件计算平均荧光强度,以平均荧光强度反应细胞内ROS水平。平均荧光强度=区域荧光强度总和÷区域面积。
2.4 细胞自噬水平检测
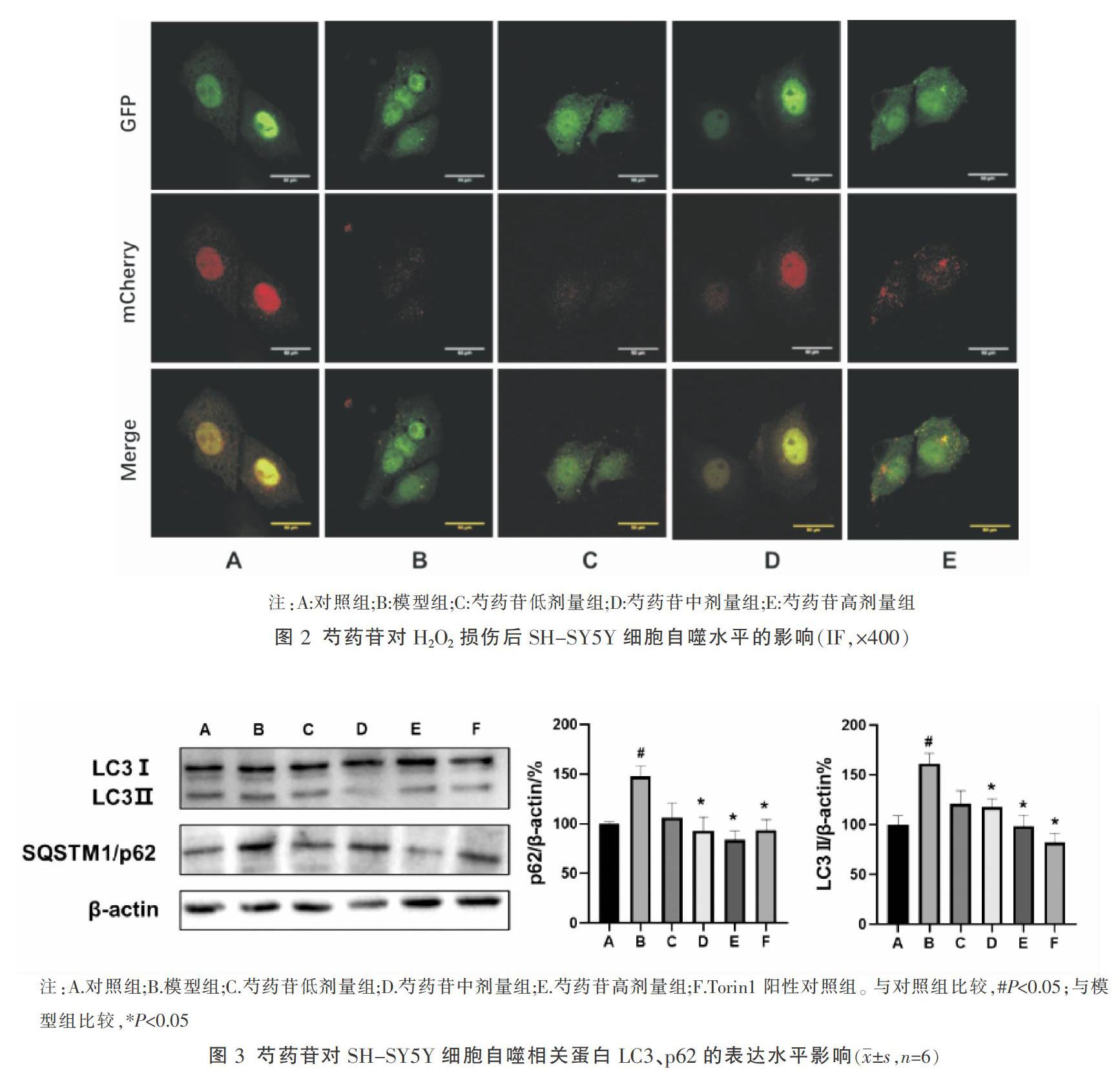
使用Ad-mCherry-GFP-LC3B腺病毒感染细胞前先通过实验确定感染细胞所需的病毒量,以不显著影响细胞生长、荧光较强且便于观察的感染复数(multiplicity of infection, MOI)值和感染后时间为最佳条件。本实验的感染条件如下:感染前一天于12孔板中以1×105个/孔接种SH-SY5Y细胞,每孔加入800 μL完全培养基,于培养箱中培养过夜,使第二天感染细胞时细胞密度为50%左右;吸弃旧培养基,加入400 μL新鲜培养基,按MOI值为10计算每孔所需病毒量,加入病毒液。感染24 h之后,弃病毒液,每孔加入800 μL完全培养基,继续培养24 h后,按照实验分组设计加入对应药物,继续培养24 h后,弃旧培养基,加入4%多聚甲醛固定细胞10 min,PBS洗3次,用抗荧光淬灭剂封片后,使用共聚焦显微镜60倍物镜下扫描成像。通过观察细胞内绿色斑点(自噬体)与红色斑点(自噬溶酶体)的表达来评价细胞自噬情况。
2.5 Western blot检测细胞自噬相关蛋白
6孔板中经处理后的细胞,弃旧培养基,PBS轻洗细胞后,加入RIPA裂解液及蛋白酶抑制剂,刮下细胞,将液体和细胞收集至1.5 mL EP管中;使用超声破碎仪破碎细胞后,于冰上静置30 min,15 000×g、4 ℃离心10 min,吸取上清液至新的EP管中。BCA法测定蛋白浓度后,调整蛋白浓度至2 μg/μL,100 ℃水浴20 min将蛋白变性,上样量为20 μg。使用10%丙烯酰胺胶100 V电泳90 min,200 mA湿转90 min将蛋白转膜至PVDF膜上,5%脱脂牛奶(TBST 配制)室温封闭1 h后;一抗SQSTM1/p62、LC3(1∶1 000),β-actin(1∶5 000)4 ℃孵育过夜;TBST 洗膜后;按1∶1 000稀释SQSTM1/p62、LC3,按1∶5 000稀释β-actin,4 ℃摇床孵育过夜;TBST洗膜后;按1∶10 000比例稀释二抗,目的蛋白SQSTM1/p62使用山羊抗小鼠二抗;LC3及β-actin使用山羊抗兔二抗;于37 ℃摇床孵育1 h;TBST洗膜;按1∶1配制显影液,使用化学发光凝胶成像仪成像;使用Image J软件进行灰度分析,以SQSTM1/p62或LC3Ⅱ与β-actin的灰度值的比值来进行统计。
2.6 统计方法
采用Prism Graphpad 6.0进行数据的统计与分析,计量资料以“x±s”表示,先检测正态性和方差齐性,方差齐时采用单因素方差分析(One-Way ANOVA),使用Student-Newman-Keuls进行组间两两比较;方差不齐时采用Kruskal-Wallis H检验,使用Wilcoxon两样本秩和检验进行组间两两比较。差异性用P值表示,P<0.05为差异具有统计学意义。
3 结果
3.1 芍药苷对SH-SY5Y细胞内ROS水平的影响
ROS荧光成像结果显示(图1A),对照组绿色平均荧光强度低,提示细胞内ROS水平较低;经H2O2处理后,模型组绿色平均荧光强度升高,与对照组相比(图1B、F),差异有统计学意义(P<0.05),提示细胞内ROS水平升高。与模型组相比,芍药苷干预后,绿色平均荧光强度较模型组减弱(图1C-F),提示细胞内ROS水平较模型组降低;芍药苷中剂量、高剂量组绿色平均荧光强度降低有统计学差异(图1F)(P<0.05),提示芍药苷中剂量、高剂量组细胞内ROS水平降低,线粒体功能趋于稳定。
3.2 芍药苷对SH-SY5Y细胞自噬水平的影响
Ad-mCherry-GFP-LC3B腺病毒感染后能在靶细胞中表达红色荧光蛋白(mCherry)、绿色荧光蛋白(GFP)和LC3B的融合蛋白。共聚焦显微镜成像结果显示(图2),与对照组相比,SH-SY5Y细胞经H2O2处理后,细胞內自噬小体呈绿色荧光,提示自噬体与溶酶体的结合过程受阻。而芍药苷干预后,细胞内自噬小体呈红色荧光,提示芍药苷可促进自噬小体与溶酶体结合,促进细胞自噬进程,且芍药苷促进细胞自噬呈一定的浓度依赖性。
3.3 芍药苷对自噬相关蛋白的影响
使用mTORC1/2的抑制劑Torin1作为阳性对照,通过Western blot法检测各组细胞LC3及SQSTM1/p62的表达水平,结果如图3所示,与正常组相比,模型组细胞经H2O2处理后,LC3Ⅱ、SQSTM1/p62水平升高,提示自噬-溶酶体通路受损;而芍药苷可在一定程度上逆转这一过程,改善细胞自噬受损。
4 讨论
中医学认为,痴呆的主要病理机制为肾虚髓亏,脑髓失养,神机失用,以五脏不足为本,血瘀痰阻为标。痴呆的病位在脑,并与心、肝、脾、肾的功能失调密切相关。肝易动难静,善干他脏,故古有“肝为万病之贼”之说。肝主疏泄调畅全身气机;肝失疏泄可影响脾胃气机,以致生化乏源,心血肾精无处化生,则脑髓失养。此外,肝藏血,肾藏精,肝肾精血同源,肝主疏泄以助精血津液在全身的运行与输布。若肝血不足,肾精则无以化生;肾精亏损,则无以充养脑髓,脑络失养。总之,肝正常功能失调会进而累及他脏,最终导致痴呆的发生。通过对老年痴呆用药相关数据的分析显示,归肝经药物数量位于首位,而痴呆中医证型的统计表明,“肝肾阴虚证”为痴呆最常见的证型[19],因此,“治肝”在痴呆的治疗中显得尤为重要。白芍性微寒,入肝、脾经,具有养血柔肝止痛等作用。文献分析结果显示,白芍是治疗痴呆方剂中的常用药物,其主要成分为芍药苷[19-20]。虽然芍药苷目前已经广泛应用于神经系统疾病以及神经退行性疾病的基础研究及临床治疗,但其对AD病理过程的影响机制尚待阐明。
前期研究结果显示,Aβ的聚集会诱导ROS的产生,芍药苷可抑制一氧化氮合酶(NOS)的活性,降低ROS水平[21];同时也能抑制Aβ的生成,减少Aβ的聚集[22]。本课题组前期研究结果表明,给予不同浓度芍药苷干预24 h后,5 μmol/L的芍药苷可以提高H2O2损伤后的SH-SY5Y细胞的存活率,20 μmol/L的芍药苷干预达到峰值[23]。本研究的实验结果显示,芍药苷可降低H2O2诱导的SH-SY5Y细胞内ROS的水平,从而可能改善了线粒体的受损状态,这可能对于改善先于Aβ沉积及NFTs出现的氧化应激对细胞造成的影响具有重要意义。此外,细胞代谢异常能影响β淀粉样蛋白的生成、积累和Tau蛋白的过度磷酸化,可以加剧线粒体功能障碍和ROS的产生,从而导致恶性循环[24]。芍药苷可以减少冈田酸诱导的SH-SY5Y细胞中高度磷酸化Tau蛋白的水平,降低自噬相关蛋白LC3Ⅱ的表达[15]。但芍药苷是否可以通过调控自噬改善氧化损伤对细胞的影响尚未报道。本研究使用Ad-mCherry-GFP-LC3B腺病毒感染后,共聚焦成像结果显示,芍药苷可促进H2O2损伤后的SH-SY5Y细胞自噬溶酶体的形成。
AD早期存在线粒体功能紊乱,线粒体功能紊乱会导致细胞代谢、钙离子平衡失调,同时也会导致氧化应激增多,最终导致细胞凋亡。芍药苷可通过降低ROS及钙离子的生成,抑制PI3K/Akt信号通路的活性,来抑制细胞凋亡[25-26]。此外,细胞自噬的正常进行对于清除衰老、受损的细胞或细胞器、维持细胞正常功能具有重要意义。尽管ROS是自噬的关键诱导剂,但过量产生ROS会抑制自噬。LC3是最早发现的自噬标记物,在细胞内以两种形式存在,LC3Ⅰ存在于细胞质,LC3Ⅱ定位于自噬体膜,因此,LC3Ⅱ常被作为自噬活性的检测指标。在自噬体膜形成过程中,LC3前体被Atg4B剪切成LC3Ⅰ,随后LC3Ⅰ与磷脂乙酰胺(PE)共价结合形成LC3-PE复合物,即膜结合形式的LC3Ⅱ[27]。因此,随着自噬小体的形成,LC3Ⅱ在自噬体膜的表达会逐渐增加。随后,自噬体与溶酶体结合成自噬溶酶体并降解,自噬体膜上的LC3Ⅱ会被Atg4B脂化,重新变成LC3Ⅰ[28]。SQSTM1/p62作为自噬受体蛋白在自噬过程中会先与泛素化蛋白结合,再与定位于自噬小体膜上的LC3Ⅱ连接,促进自噬小体的降解,因此在自噬过程中,SQSTM1/p62的水平与自噬水平呈负相关[29],而当自噬小体与溶酶体形成受阻时,自噬小体的降解受阻,LC3Ⅱ和SQSTM1/p62则会在细胞内累积。我们的结果表明,芍药苷可通过降低LC3Ⅱ的表达,促进p62蛋白的降解,来促进H2O2损伤后的SH-SY5Y细胞自噬,进而可能在一定程度上改善细胞的状态。
参考文献
[1] ALZHEIMER'S DISEASE INTERNATIONAL. World Alzheimer Report 2015—The Global Impact of Dementia [EB/OL]. 2015.
[2] WORLD HEALTH ORGANIZATION. The top 10 causes of death[EB/OL]. 2018-05-24.
[3] SERRANO-POZO A, FROSCH M P, MASLIAH E, et al. Neuropathological alterations in Alzheimer disease[J]. Cold Spring Harbor Perspectives in Medicine, 2011,1(1):a006189.
[4] GILGUN-SHERKI Y, MELAMED E, OFFEN D. Antioxidant treatment in Alzheimer's disease[J]. Journal of Molecular Neuroscience, 2003,3(21):1-11.
[5] MONDRAGóN-RODRíGUEZ S, PERRY G, ZHU X, et al. Phosphorylation of tau protein as the link between oxidative stress, mitochondrial dysfunction, and connectivity failure: implications for Alzheimer's disease[J]. Oxidative Medicine and Cellular Longevity, 2013, 2013: 940603.
[6] SCANDALIOS J G. Oxidative stress responses-what have genome-scale studies taught us?[J]. Genome Biology, 2002, 3(7): REVIEWS1019.
[7] KIM J H, CHOI W, LEE J H, et al. Astaxanthin inhibits H2O2-mediated apoptotic cell death in mouse neural progenitor cells via modulation of P38 and MEK signaling pathways[J]. Journal of Microbiology and Biotechnology, 2009, 19(11): 1355-1363.
[8] CARDOSO S M, PEREIRA C F, MOREIRA P I, et al. Mitochondrial control of autophagic lysosomal pathway in Alzheimer'sdisease[J]. Experimental Neurology, 2010, 223(2): 294-298.
[9] SILVA D F, ESTEVES A R, ARDUINO D M, et al. Amyloid-β-induced mitochondrial dysfunction impairs the autophagic lysosomal pathway in a tubulin dependent pathway[J]. Journal of Alzheimer's Disease, 2011, 26(3): 565-581.
[10] ZHANG H R, PENG J H, CHENG X B, et al. Paeoniflorin atttenuates amyloidogenesis and the inflammatory responses in a transgenic mouse model of alzheimer's disease[J]. Neurochemical Research, 2015, 40(8): 1583-1592.
[11] LIU H Q, ZHANG W Y, LUO X T, et al. Paeoniflorin attenuates neuroinflammation and dopaminergic neurodegeneration in the MPTP model of Parkinson's disease by activation of adenosine A1 receptor[J]. British Journal of Pharmacology, 2006, 148(3): 314-325.
[12] SHAO Y X, XU X X, WANG K, et al. Paeoniflorin attenuates incipient diabetic nephropathy in streptozotocin-induced mice by the suppression of the Toll-like receptor-2 signaling pathway[J]. Drug Design, Development and Therapy, 2017, 11: 3221-3233.
[13] 劉汉珍,刘爱荣,李孝良,等.白芍的化学成分及药理研究进展[J].安徽技术师范学院学报,2001,15(4):54-57.
[14] 李乃谦.探讨白芍的药理作用及现代研究进展[J].中医临床研究,2017,9(20):137-138.
[15] MA X H, DUAN W J, MO Y S, et al. Neuroprotective effect of paeoniflorin on okadaic acid-induced tau hyperphosphorylation via calpain/Akt/GSK-3β pathway in SH-SY5Y cells[J]. Brain Research, 2018, 1690: 1-11.
[16] WEN J, XU B, SUN Y C, et al. Paeoniflorin protects against intestinal ischemia/reperfusion by activating LKB1/AMPK and promoting autophagy[J]. Pharmacological Research, 2019, 146: 104308.
[17] WANG Y, CHE J B, ZHAO H, et al. Paeoniflorin attenuates oxidized low-density lipoprotein-induced apoptosis and adhesion molecule expression by autophagy enhancement in human umbilical vein endothelial cells[J]. Journal of Cellular Biochemistry, 2019, 120(6): 9291-9299.
[18] 余婧萍,贺春香,成绍武,等.当归芍药散通过调控NF-κB炎性通路改善H2O2诱导的SH-SY5Y细胞氧化损伤的作用[J].中国实验方剂学杂志,2020,26(10):1-7.
[19] 司富春,陈 瑞.痴呆的中医证型和方药规律分析[J].世界中西医结合杂志,2014,9(10):1119-1122.
[20] 吴 丹.白芍有效成分芍药苷的测定及其干预胶原诱导性关节炎大鼠的定量蛋白质组学研究[D].长沙:中南大学,2013.
[21] 郭春燕,羅 强,孙 黎,等.芍药苷对H2O2诱导SH-SY5Y神经细胞损伤的保护作用[J].2013,44(20):2864-2871.
[22] 朱 燃,黄田喜,赵雪梅,等.10种中草药成分对体外过表达A?茁的影响及机制探讨[J].药学学报,2014,49(6):800-806.
[23] 余婧萍,贺春香,李 泽,等.芍药苷对PINK1-Parkin介导的线粒体自噬在H2O2诱导的SH-SY5Y细胞损伤中的影响[J/OL].中国中医药信息杂志,2020,27(10):1-7.
[24] T?魻NNIES E, TRUSHINA E. Oxidative stress, synaptic dysfunction, and Alzheimers disease[J]. Journal of Alzheimers Disease, 2017, 57: 1105-1121.
[25] WANG K, ZHU L, ZHU X, et al. Protective effect of paeoniflorin on A?茁25-35-induced SH-SY5Y cell injury by preventing mitochondrial dysfunction[J]. Cellular and Molecular Neurobiology, 2014, 34(2): 2227-2234.
[26] SUN R, WANG K, WU D, et al. Protective effect of paeoniflorin against glutamate-induced neurotoxicity in PC12 cells via Bcl-2/Bax signal pathway[J]. Folia Neuropathologica, 2012, 50(3):270-276.
[27] SOU Y S, TANIDA I, KOMATSU M, et al. Phosphatidylserine in addition to phosphatidylethanolamine is an in vitro target of the mammalian Atg8 modifiers, LC3, GABARAP, and GATE-16[J]. The Journal of Biological Chemistry, 2006, 281(6): 3017-3024.
[28] ISEI TANIDA T U, KOMINAMI E. LC3 and Autophagy[J]. Methods in Molecular Biology, 2008, 445: 77-88.
[29] LAMARK T, SVENNING S, JOHANSEN T. Regulation of selective autophagy: the p62/SQSTM1 paradigm[J]. Essays in Biochemistry, 2017, 61(6): 609-624.
