海藻色素的提取工艺及其稳定性
2020-07-18林国荣蔡琳琳
林国荣,蔡琳琳
莆田学院环境与生物工程学院,福建省新型污染物生态毒理效应与控制重点实验室(莆田 351100)
海藻(Sargassum)是生长在海中的藻类,是一种低等隐花植物[1]。海藻从形体上可分为两种类型:大型海藻和微藻。常见的大型藻类主要有海带、紫菜、裙带菜、石花菜、马尾藻[2]。全世界的海藻约4 100种,我国沿海广泛分布的紫菜就是其中一种[3]。近些年,从海藻中提取了许多生物活性物质,如抗癌、抗氧化、抗辐射物质和免疫调节剂[4]等。它们具有天然、独特的优点,被广泛应用于医学、食品、化学等行业,是海洋生物活性物质开发和提取的热点[5]。
食品工业中常用的色素有两种类型:合成色素与天然色素。因为合成色素具有一定的毒性,在食品工业中的运用受到限制,人们越来越倾向于用天然色素。中国的植物资源十分丰富,大量的新型植物色素正在被研究和使用,我国如今已有80余种天然色素[6],其中大部分是由陆生植物中提取的。由于陆地植物易受季节、天气和地理因素的影响,因此难以通过从陆地植物中提取天然色素来满足市场需求。因而,在研发新的天然色素资源时,海藻引起了人们的重视。海藻具有比陆生植物更高的色素含量,并且含有陆生植物没有的特征色素岩藻黄素[7-12]。近年来,由于技术和方法的不断改进和发展,使海藻色素的提取、分离与鉴定的研究日益深入,应用的材料日益广泛,应用范围也不断扩大。海藻中的色素具有多种功能,且性质特别,含量较高,有着良好的发展前景[13]。
试验以紫菜为试验材料,通过考察提取剂种类、料液比、提取温度、提取时间等因素对海藻色素提取效果的影响,得到海藻色素提取的最佳工艺条件;并在酸碱环境、氧化剂、还原剂、不同温度、光照的处理下,测定海藻色素的含量变化情况,研究环境因素对海藻色素稳定性的影响。
1 材料与仪器
1.1 供试材料
以市售紫菜为试验材料,选用厚度、质量基本一致,表面无机械损伤的紫菜,置于80 ℃恒温干燥箱中烘干至恒质量,待测相关指标。
1.2 主要试剂、仪器与设备
无水乙醇、石油醚、乙酸乙酯、盐酸、氢氧化钠、大孔树脂HZ-818、30%过氧化氢、亚硫酸钠,均为国产分析纯,购于国药集团化学试剂有限公司。
TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司;AR124CN型电子天平,奥豪斯仪器有限公司;ST3100型pH计,奥豪斯仪器(常州)有限公司;DK-S26型电热恒温水浴锅,上海森信实验仪器有限公司;DGG-9053A型电热恒温鼓风干燥箱,上海森信实验仪器有限公司;RV10型旋转蒸发仪,德国IKA公司;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司。
2 方法
2.1 海藻色素最大吸收波长的确定
取5.0 g紫菜放入250 mL锥形瓶中,加入100 mL蒸馏水,在60 ℃的恒温水浴锅中浸提2 h,抽滤后得到海藻色素溶液,定容到100 mL,以水作空白,用紫外分光光度计在200~800 nm波长内进行光谱扫描,测得紫菜色素的最大吸收波长。
2.2 提取剂的选择
取5.0 g紫菜样品于250 mL锥形瓶中,分别加入100 mL蒸馏水、100 mL无水乙醇、100 mL石油醚、100 mL乙酸乙酯,调节料液比为1∶20(g/mL),在60 ℃恒温水浴中浸提2 h,减压过滤后得到海藻色素溶液[14],用蒸馏水定容到100 mL,以相应提取剂作空白,在335 nm处测定吸光度。
2.3 海藻色素提取工艺的正交试验
以海藻色素溶液的吸光度为评价指标,料液比、提取温度、提取时间为三因素,选用L9(33)正交试验表(表1)进行试验。

表1 正交试验因素水平表
2.4 海藻色素的分离
称取100.0 g紫菜,以1∶30(g/mL)的料液比加入蒸馏水,在50 ℃恒温水浴锅中浸提3 h,减压过滤后得到滤液。将大孔树脂HZ-818在无水乙醇中浸泡48 h,并用去离子水洗涤直至无醇味。在色素滤液中加入预处理后的大孔树脂,静置12 h,用50%乙醇洗脱得海藻色素提取液。使用旋转蒸发仪减压浓缩提取液,得到海藻色素浓缩液备用。
2.5 海藻色素的稳定性研究
2.5.1 pH对海藻色素稳定性的影响
通过最佳提取工艺所得的海藻色素浓缩液,配制10%海藻色素溶液。取10 mL色素溶液,置于50 mL锥形瓶中,分别用HCl、NaOH溶液调节pH至3.0,4.0,5.0,6.0,7.0,8.0,9.0和10.0,在室温下静置30 min,测定其在335 nm处的吸光度。同时做3组平行试验。
2.5.2 氧化剂、还原剂对海藻色素稳定性的影响
取10 mL海藻色素溶液,置于25 mL比色管内,分别加入0,0.1,0.2,0.4,0.6和0.8 mL的H2O2溶液和0,1,2,3,4和5 mL的Na2SO3溶液,在室温下放置30 min后测定其在335 nm处的吸光度。同时做3组平行试验。
2.5.3 温度对海藻色素稳定性的影响
取5份10 mL海藻色素溶液,置于25 mL比色管内,在25,40,55,70和95 ℃恒温水浴锅中加热3 h,冷却至室温后测定其在335 nm处的吸光度。同时做3组平行试验。
此外,两文献虽在地位上对等,但实际内容和文体风格都存在较大的差别,按本文分析结果,可以大致分属政府文件和备稿演讲两个类别,并不能因其相似的地位而混为一谈。作为《政府工作报告》英译本,其语体风格应与原文看齐一致。政治翻译必须紧扣原文,不得任意增删。[6](P20)而我国《政府工作报告》本身就具有政府文件至高无上的严肃性和正式性,而接近于备稿演讲的《美国国情咨文》则需要有一定的演讲特质,这也反映了中美两国不同的政治文化。一味地强调通过翻译上的策略来拉近二者的语体风格,缩小差异,笔者认为这将使得译文脱离原文文本特征,从而丢失本应传达的严肃性和正式性,以及中国特色的政治文化色彩。
2.5.4 光照对海藻色素稳定性的影响
将2份100 mL海藻色素溶液,置于250 mL锥形瓶中,在日光、暗处静置1,2,4,6和8 h,并测定其在335 nm波长下的吸光度。同时做3组平行试验。
3 结果与分析
3.1 最大吸收波长的确定
从图1可以看出,以蒸馏水作为提取剂时,海藻色素在波长335 nm处出现最大吸光度,因此选择335 nm为最佳波长。
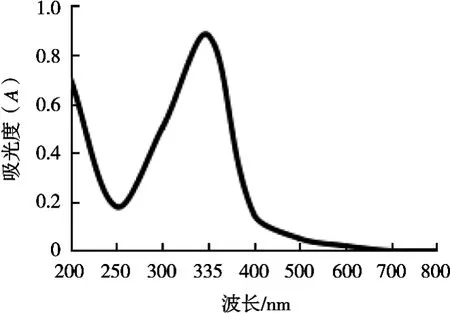
图1 海藻色素最大吸收波长的确定
3.2 提取剂的选择
海藻色素在不同提取剂中的吸光度如图2所示。它可溶于水、乙醇和石油醚,微溶于乙酸乙酯。当选用蒸馏水时,吸光度最大,色素含量高,提取效果最好;石油醚次之,而无水乙醇和乙酸乙酯的提取效果均低于前二者。因此,选择蒸馏水作为海藻色素的最佳提取剂。

图2 提取剂的选择
3.3 海藻色素提取工艺的正交试验
从表2可以看出,影响海藻色素提取效果的因素程度为A>B>C,即料液比的影响最大。通过极差计算分析,得到最佳提取工艺为A3B1C3,即料液比为1∶30(g/mL)、提取温度为50 ℃、提取时间为3 h。
对比验证最佳工艺条件A3B1C3与A3B1C2,结果见表3。在A3B1C3的试验条件下,海藻色素提取液的吸光度为0.822,高于A3B1C2组合的0.788。因此,最佳提取工艺为A3B1C3,即料液比为1∶30(g/mL)、提取时间为3 h、提取温度为50 ℃。在此条件下,海藻色素的提取效果最佳。
3.4 海藻色素的稳定性研究
由图3可知,当pH为3~7时,海藻色素含量有所升降,但整体变化不大;当pH为7~10时,海藻色素含量随着pH的增大而逐渐降低。结果显示,海藻色素在酸性中表现较稳定,在碱性条件下不稳定。这说明酸碱度对其有一定影响。因此,海藻色素适宜在酸性条件下贮存。

表2 正交试验结果

表3 验证试验结果
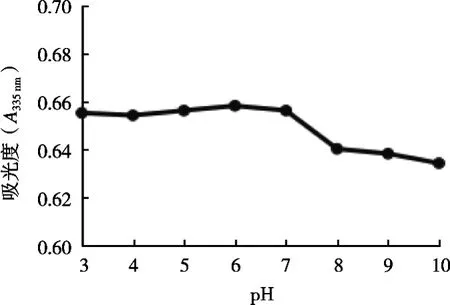
图3 pH对海藻色素稳定性的影响
3.4.2 氧化剂、还原剂对海藻色素稳定性的影响
由图4可知,H2O2对海藻色素存在氧化作用。随着H2O2体积的增加,海藻色素的含量逐渐降低,这可能是氧化剂的作用,使得一部分色素被分解。因此,氧化剂对海藻色素稳定性的影响较大。
图5表明,随着Na2SO3体积的增加,海藻色素的吸光度基本保持不变。说明还原剂对海藻色素稳定性的影响不大。
3.4.3 温度对海藻色素稳定性的影响
图6表明,随着温度的升高,海藻色素溶液的吸光度逐渐降低,温度在25~70 ℃范围内,下降速度较缓慢;而温度高于70 ℃,下降速度较快。这说明海藻色素在高温条件下不稳定,应在低温下保存。
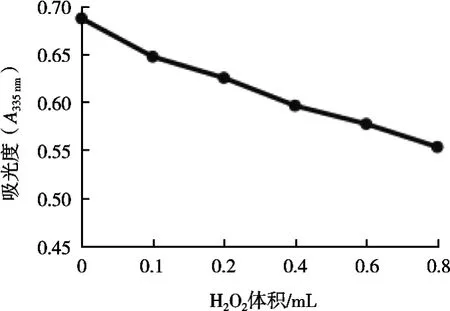
图4 氧化剂对海藻色素稳定性的影响
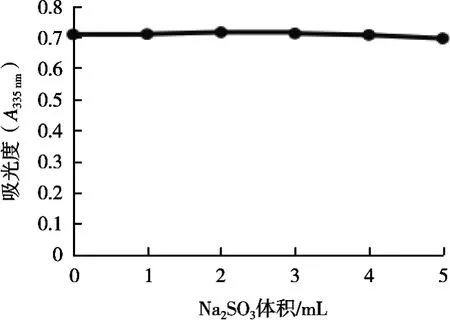
图5 还原剂对海藻色素稳定性的影响

图6 温度对海藻色素稳定性的影响
3.4.4 光照对海藻色素稳定性的影响
从图7可以看出,海藻色素溶液存放于暗处时,其吸光度基本没有变化。但在日光照射下,其吸光度明显降低。这说明随着光照时间的延长,海藻色素含量逐渐降低,即光照对海藻色素稳定性有很大影响。因此,海藻色素适合避光保存。
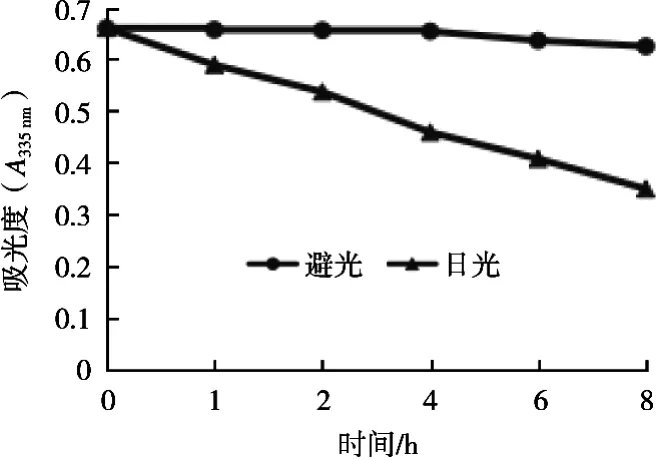
图7 光照对海藻色素稳定性的影响
4 结论
通过单因素试验和正交试验结果,得出海藻色素提取的最佳工艺:以蒸馏水作为提取剂、料液比1∶30(g/mL)、提取温度50 ℃、提取时间3 h。稳定性研究表明,海藻色素在酸性环境中较为稳定,而在碱性环境中不稳定。氧化剂对海藻色素有明显的破坏作用,而还原剂对其基本无影响。高温和光照易使海藻色素分解,因此海藻色素适宜在低温下密封避光保存。
