山葡萄皮花色苷提取工艺优化及其组分分析
2020-07-18王鑫韩茜宇薛宏坤
王鑫,韩茜宇*,薛宏坤
1. 大理大学公共卫生学院(大理 671003);2. 黑龙江国际旅行卫生保健中心(哈尔滨 150090);3. 清华大学工程物理系,粒子与辐射成像教育部重点实验室(北京 100084)
“双丰”山葡萄为葡萄科葡萄属植物,具有显著的抗寒、抗旱特点,被广泛种植于中国东北地区,其果实柔软多汁,风味独特,且含有丰富的天然活性成分,备受人们喜爱[1]。“双丰”山葡萄主要用于制作果汁和果酒,在产品制作过程中,葡萄皮通过作为副产物(占整个葡萄的10%)被大量遗弃,造成环境污染和资源浪费。葡萄皮中富含大量花色苷、多酚、维生素、超氧化物歧化酶等活性成分,可作为天然活性成分的重要来源。因此,如何将副产物变废为宝已成为科研关注热点。
花色苷是葡萄皮中重要的活性成分之一,其基本结构单元为C6—C3—C6骨架构成的2-苯基苯并吡喃[2],结构如图1所示。因独特的结构使其具有抗氧化、抗炎、抗肿瘤、预防心血管疾病和增强视力等功效[3]。如何高效地从“双丰”山葡萄皮中提取花色苷,从而提高山葡萄的附加值,已成为科研人员亟待解决的问题。花色苷提取主要采用传统的浸提法,该方法存在效率低、耗时长、萃取溶剂消耗量大、后期易造成热敏性物质的降解等问题[4],无法满足对高效率和高得率花色苷的需求。超声辅助提取法作为一种新型的植物活性成分提取技术,利用超声波的空化效应、热效应、机械效应加速细胞壁破裂,减小目标成分的扩散阻力,使细胞内的目标成分更容易从细胞中扩散到周围溶剂,从而有效提高目标成分得率[5-6]。因此,该技术被广泛应用于黄酮[7]、多酚[8]、多糖[9]、油类[10]等的提取。而关于采用超声辅助提取“双丰”山葡萄皮花色苷的研究鲜见报道。
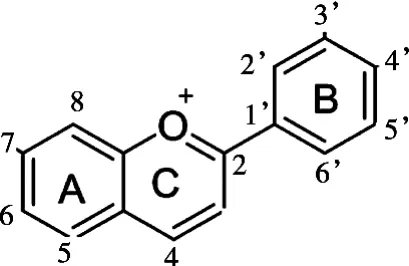
图1 花色苷的基本结构[2]
鉴于此,采用超声辅助提取技术对“双丰”山葡萄皮花色苷进行提取,探究超声功率、超声时间、提取温度、料液比对花色苷得率的影响,并通过正交试验优化其提取工艺;在此基础上,采用高效液相色谱-质谱联用技术对“双丰”山葡萄皮花色苷组分进行鉴定,以期提高“双丰”山葡萄的附加值。
1 材料与方法
1.1 材料与试剂
“双丰”山葡萄(东北小兴安岭地区),成熟后于8月中旬采摘,除杂、清洗、晾干、去皮,果皮置于-20 ℃的冷冻干燥机冻至48 h,然后用植物粉碎机将其粉碎,过40目筛,制成“双丰”山葡萄皮粉末,密封避光保存在-18 ℃冰箱中备用。
甲酸、乙腈、甲醇、乙醇(均为色谱纯,美国Fisher公司);矢车菊素-3-葡萄糖苷标准品(纯度≥95%,美国诺威公司);醋酸纤维素膜(0.45 mm,天津市科密欧化学实剂有限公司);AB-8大孔树脂(日本三菱公司)。
1.2 仪器与设备
KQ600DB超声波清洗器(昆山市超声仪器有限公司);220D电子分析天平(上海力辰仪器科技有限公司);J-HH-6A精密数显恒温水浴锅(上海胜卫电子科技有限公司);LAMBDA35型紫外分光光度计(美国Perkin Elmer公司);SHB-ⅢA型循环水式多用真空泵(郑州紫拓仪器设备有限公司);DRYER真空冷冻干燥器(德国西门子公司);Agilent1260高效液相色谱-布鲁克质谱联用仪(美国Agilent公司)。
1.3 方法
1.3.1 超声辅助提取“双丰”山葡萄皮花色苷
准确称取2.000 0±0.000 5 g经1.1所制得的“双丰”山葡萄皮粉末置于真空包装袋中,按照不同料液比加入体积分数60%乙醇溶液[11],使其充分混合,封口,将其放入超声设备中进行提取,同时固定不同提取温度,提取结束后,将萃取液置于离心机中以5 000 r/min离心15 min,收集上清液,然后将所得的残渣重复上述操作提取2次,合并3次所得滤液,随后用醋酸纤维素膜(0.45 mm)过滤,所得的滤液置于4 ℃冰箱避光保存备用。
1.3.2 超声辅助提取“双丰”山葡萄皮花色苷的单因素试验
称取2.000 0±0.000 5 g“双丰”山葡萄皮粉末样品作为提取对象,选择体积分数60%乙醇作为提取溶剂,考察不同超声功率、提取时间、提取温度和料液比对“双丰”山葡萄皮粉末中花色苷含量的影响。在预试验基础上,设定超声功率100,200,300,400和500 W 5个水平;超声时间20,25,30*,35和40 min 5个水平;提取温度30,40,50*,60和70 ℃ 5个水平;料液比1∶10,1∶20,1∶30*,1∶40和1∶50(g/mL),每组试验重复3次。(注:*表示当考察其他参数对“双丰”山葡萄皮粉末花色苷含量影响时,用*标记的因素保持恒定水平。)
依据单因素试验结果,设计L9(33)正交试验,正交试验因素及水平编码如表1所示。

表1 超声辅助提取山葡萄皮粉末花色苷的L9(33)正交试验因素及水平
1.3.3 花色苷含量的测定
采用pH示差法测定样品中花色苷含量,参考于泽源等[12]的方法并略做改动。取1 mL样品,分别加入9 mL pH 1.0氯化钾缓冲液和9 mL pH 4.5乙酸钠缓冲液,将其混合,避光静置1 h,分别在520和700 nm处测定其吸光度,花色苷的含量表达式如式(1)所示。

式中:c为样品中花色苷含量,mg/g;A为样品提取液的吸光度;DF为稀释倍数;Mw为矢车菊素-3-葡萄糖苷的相对分子质量,449.2;Ma为矢车菊素-3-葡萄糖苷的消光系数,26 900;L为比色皿光程,cm;V为总体积,mL;m为样品质量,g。
1.3.4 HPLC-ESI/MS法对“双丰”山葡萄皮粉末花色苷组分鉴定
样品准备:在最佳工艺条件下获得的“双丰”山葡萄花色苷提取液,将其在50 ℃旋转蒸发仪减压浓缩,准确移取20 mL山葡萄皮花色苷浓缩液,并将其注入已活化的AB-8大孔树脂柱(2.6 cm×60 cm)中充分吸附,进样流速1.5 mL/min,进样完全后,依次用酸化的去离子水(0.01% HCl)、30%乙醇溶液(0.01% HCl)和95%乙醇溶液(0.01% HCl)洗脱,洗脱流速1.0 mL/min,收集洗脱液,将其在50 ℃旋转蒸发仪减压浓缩,得到山葡萄皮花色苷纯化液,将其在冷冻干燥机中冻干成粉,将其用0.1% HCl-甲醇溶液稀释后,配制成浓度为0.1 mg/mL的样品溶液,溶液过0.45 μm滤膜,用于HPLC分析。
色谱条件:Aglient 1260 C18柱(150 mm×4.6 mm,2.6 μm);流动相A为体积分数5%甲酸水溶液,流动相B为乙腈-水-甲酸(体积比61.5∶37∶2.5)。洗脱程序:0~5 min,5%~20%流动相B,保持5 min;5~15 min,20%~25%流动相B,保持5 min;15~25 min,25%~30%流动相B,保持5 min;25~35 min,30%~5%流动相B,保持5 min;流速0.8 mL/min;柱温25 ℃;进样量25 μL;检测波长520 nm。
质谱条件:电喷雾电离离子源(ESI),质谱采用正离子扫描方式,质量扫描范围m/z200~2 000,毛细管电压4.5 kV,雾化器压力1.5 bar,干燥温度220 ℃。
1.3.5 数据处理
每组试验重复3次,结果用“平均值±标准差”表示;采用SPSS 16.0软件对每组试验数据进行方差分析(ANOVA);采用SAS 8.0软件分析结果的显著差异;Origin 9.0进行绘图。
2 结果与分析
2.1 单因素对“双丰”山葡萄皮花色苷含量的影响
超声辅助提取“双丰”山葡萄皮花色苷的单因素试验结果如图1所示。
由图2(A)可知,超声功率100~300 W时,随超声功率增加,花色苷得率呈显著增加趋势(p<0.05),在300 W时,花色苷得率取得最大值(0.62±0.03 mg/g),其原因是随超声功率增加,机械震动效应和空化效应显著增加,使得在萃取液中产生较大剪切力,引起山葡萄皮细胞壁破裂,传质阻力降低,扩散系数增加,进而促进花色苷从山葡萄皮细胞中快速扩散出来[13]。随后继续增加超声功率,花色苷得率呈现显著降低趋势(p<0.05)。这归因于在过高的超声功率下,高强度的空化效应破坏花色苷结构,同时也会引起非花色苷类杂质的溶解,导致花色苷溶解度降低[14],从而使得花色苷得率呈现显著降低趋势。故选择超声波功率为200,300和400 W作为后续正交试验的因素水平。
由图2(B)可知,超声时间20~30 min时,花色苷得率随超声时间延长呈现显著增加趋势(p<0.05),随后继续延长超声时间,花色苷得率无显著变化(p>0.05)。其原因是在萃取初期,花色苷在细胞内外的浓度梯度较大,有利于花色苷从细胞中扩散到周围溶剂中,使得花色苷得率显著增加。进一步延长超声时间,可能由于萃取液中花色苷浓度与山葡萄皮细胞内花色苷浓度一致,内外浓度梯度趋近于零,即萃取液中花色苷达到饱和状态。因此,进一步延长超声时间,花色苷得率基本保持不变,故超声时间设定为30 min,后续不再优化超声时间。
由图2(C)可知,随提取温度增加,花色苷得率呈现先显著增加后显著降低趋势(p<0.05),提取温度50 ℃时,花色苷得率取得最大值(0.68±0.01 mg/g)。其原因是随提取温度增加,萃取液黏度降低,扩散系数和溶解度增加,使得花色苷更容易从细胞中被扩散出来[15],故花色苷得率增加。继续增加提取温度不利于花色苷提取,这是由于花色苷属于热敏性成分,高温破坏花色苷与糖分子形成的糖苷键,引起花色苷呈指数形式降解[16],从而使花色苷得率降低,故提取温度选择40,50和60 ℃作为后续正交试验的因素水平。
由图2(D)可知,料液比1∶10~1∶30(g/mL)时,花色苷得率随料液比增加呈现显著增加趋势(p<0.05),其原因是随萃取溶剂增加,细胞内外花色苷浓度梯度增加,浓度梯度作为花色苷传质驱动力,较大的浓度梯度驱动有利于花色苷由内向外扩散,从而增加花色苷得率。料液比超过1∶30(g/mL)时,继续增加料液比,花色苷得率则呈现显著降低趋势(p<0.05)。归因于过多溶剂会产生杂质、色素等,降低花色苷的溶解度,从而不利于花色苷的提取[17];另外溶剂过大,会对后续提取物的浓缩带来很大的工作量。因此,综合考虑,料液比选择1∶20,1∶30和1∶40(g/mL)作为后续正交试验的因素水平。
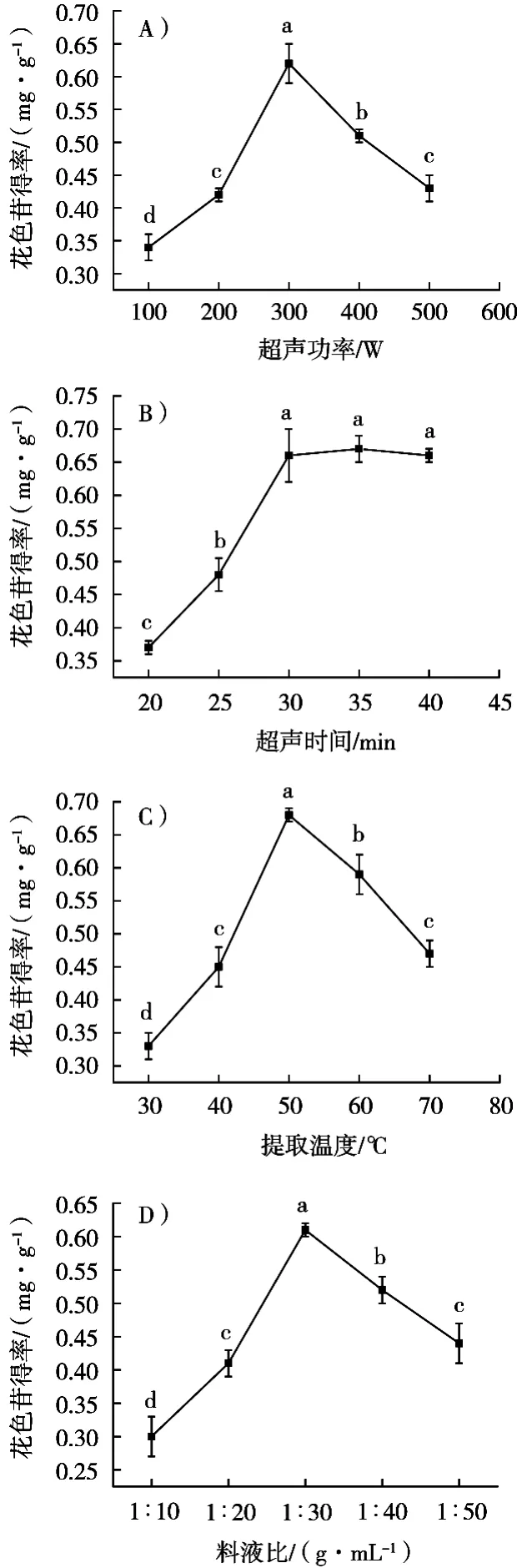
图2 超声功率(A)、超声时间(B)、提取温度(C)和料液比(D)对山葡萄皮花色苷含量的影响
2.2 超声辅助提取“双丰”山葡萄皮花色苷的正交试验结果
超声辅助提取“双丰”山葡萄皮花色苷的正交试验设计及结果如表2所示。通过极差大小确定各因素对花色苷得率影响的主次顺序:C>A>B。最优水平组合为A2B3C3,即超声功率300 W、提取温度60 ℃、料液比1∶40(g/mL)。对最优试验条件进行3组平行试验验证,在最优参数组合下山葡萄皮花色苷得率为0.71±0.03 mg/g,说明超声辅助提取“双丰”山葡萄皮花色苷工艺得到优化。

表2 超声辅助提取“双丰”山葡萄皮花色苷的L9(33)正交试验设计及结果
2.3 “双丰”山葡萄皮花色苷组分鉴定
在最佳参数组合下所得花色苷粗提液,经AB-8大孔树脂纯化后所得样品,再经HPLC-ESI/MS分析,其结果如图3、图4和表3所示。
由图3可知,山葡萄皮粗提液经AB-8大孔树脂纯化后得到3种花色苷组分,结合各组分的色谱保留时间、分子离子峰和丢失的碎片来共同判断3种花色苷组分的组成。图3中1号峰的质谱图如图4(A)所示,分子离子[M+]为465.0,碎片离子m/z303.1,其中m/z303是飞燕草素的特征离子,丢失的碎片m/z162,可能为葡萄糖和半乳糖,结合资料分析[18],最终可判定1号峰为飞燕草素-3-葡萄糖苷。图3中2号峰的质谱图如图4(B)所示,分子离子[M+]为449.0,碎片离子m/z287.1,m/z287是矢车菊素的特征离子,丢失的碎片162,研究结果与Pertuzatti等[19]研究高丛蓝莓花色苷中的矢车菊素-3-葡萄糖苷的质谱信息相一致。因此,2号峰为矢车菊素-3-葡萄糖苷。图3中3号峰的质谱图如图4(C)所示,分子离子[M+]为625.2,碎片离子m/z463.1和m/z301.2,可能是由分子离子失去一分子己糖苷(Δm/z162)而成,m/z463.1和301.3之间也相差一个分子量162的己糖苷,且m/z301是芍药素色素的特征离子,推测3号峰物质可能是带有两个己糖苷的芍药色素花色苷。该研究结果与Wang等[20]在相同高效液相色谱-质谱检测条件下鉴定出芍药素-3, 5-二己糖苷的质谱信息一致。因此,最终判定3号峰为芍药素-3, 5-二己糖苷。

图3 经AB-8大孔树脂纯化后所得山葡萄皮花色苷组分的液相色谱图

图4 花色苷组分质谱图
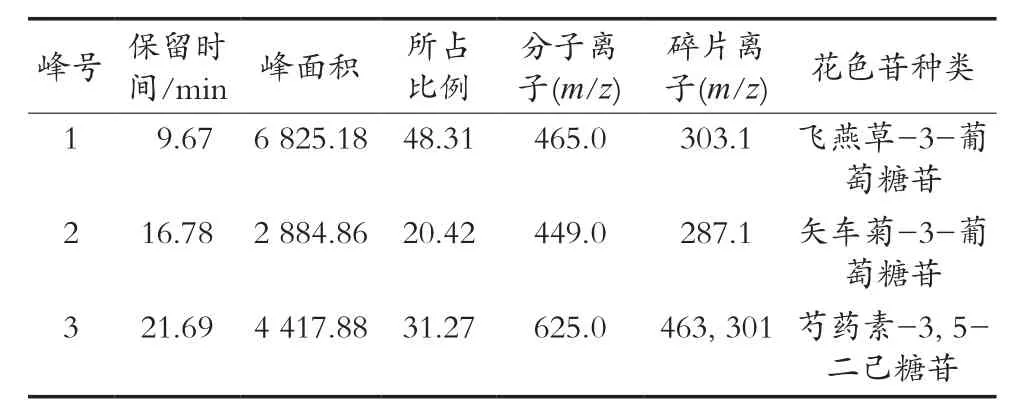
表3 山葡萄皮花色苷种类鉴定表
3 结论
在单因素试验基础上,通过正交试验优化出超声辅助提取“双丰”山葡萄皮花色苷的工艺:超声功率300 W、超声时间30 min、提取温度60 ℃、料液比1∶40(g/mL)。在此条件下花色苷得率为0.71±0.03 mg/g,经HPLC-ESI/MS鉴定发现山葡萄皮中包含3种花色苷组分。试验结果有助于提高“双丰”山葡萄的附加值,同时可为天然花色苷保健品的开发提供物质基础。
