沉默Twist基因对胃癌BGC-823细胞上皮-间质转化的影响
2020-07-18张磊
张 磊
胃癌是最常见的消化道肿瘤之一,随着人类生活条件的改善,良好饮食习惯的建立以及幽门螺杆菌的根除,胃癌的发病率呈下降趋势。然而,全球胃癌的发病率及病死率仍居高不下[1]。随着分子病理学的发展,对胃癌发病机制的了解有了长足的进步,但离最终阐明仍相去甚远。因此,有必要进一步探索并寻找胃癌新型治疗靶标,以达到抑制胃癌增殖和转移,提高患者生存率的目的。上皮-间质转化(epithelial-mesenchymal transition, EMT)是转移的关键环节,该过程可以促进肿瘤细胞的侵袭和向远处器官的转移[2]。在此过程中,细胞经历了形态学上的变化,上皮细胞失去细胞连接和极性并转化为具有侵袭与转移特性的间充质细胞[3]。越来越多的证据表明EMT可引发细胞迁移/侵袭并导致癌细胞的耐药性[4-5]。本实验在组织学与细胞学水平上探讨Twist基因对胃癌细胞EMT的意义。
1 材料与方法
1.1 材料小量及中量质粒抽提试剂盒购自北京康为世纪生物公司;内切酶BamH Ⅰ、Hind Ⅲ、T4 DNA连接酶购自大连宝生物公司;DNA Marker、琼脂糖购自美国Gibco BRL公司;Taq DNA聚合酶购自美国Promega公司;Twist RNAi表达载体、引物设计与合成购自上海生工生物公司;转染试剂购自美国Invitrogen公司;胎牛血清购自杭州四季青公司;DMEM高糖培养基购自Gibco公司;96孔板及Transwell小室购自美国Corning公司;基质胶(Matrigel)购自Millipore公司;qRT-PCR试剂盒购自美国Fermentas公司。
1.2 方法
1.2.1细胞培养 人胃癌细胞株BGC-823购自中国科学院上海细胞生物学研究所,-80 ℃冰箱中保存。细胞置于含10%胎牛血清的DMEM高糖培养基中,37 ℃ 5%CO2培养箱中培养,每2~3天换液1次,细胞汇合度70%~80%时进行传代培养,取生长状态良好且处于对数生长期的细胞进行实验。
1.2.2Twist小干扰RNA(siRNA)的构建 根据Genbank中Twist基因(585 bp,NM 000474)的核苷酸序列及siRNA设计原则,针对Twist cDNA编码区第861~881位核苷酸进行干扰片段的设计,寡核苷酸两端分别带有BamH Ⅰ和Hind Ⅲ酶切位点,合成序列如下:正义链5′-GATCCGATG GCAAGCTGCAGCTATTTCAAGAGAATAGCTGCAGCTTGCCAT CTTTTTTGGAA-3′,反义链5′-AGCTTTTGCAAAAAAGATG GCAAGCTGCAGCTATTCTCTTGAAATAGCTGCAGCTTGCCAT CG-3′。连接Psilencer 3.1质粒,化入大肠杆菌DH5a中。将连接产物各取4 μL分别接种于100 μL的DH5a感受态细胞中进行转化。挑取单个菌落扩增培养,质粒小量抽提。用限制性内切酶Bgl Ⅱ分别对重组质粒进行单酶切鉴定。将鉴定后的Twist siRNA重组质粒送上海生工生物公司进行测序。本实验采用细胞转染技术,将鉴定成功的Twist小干扰RNA作为干扰组,未转染组作为对照组,进行后续实验分析。
1.2.3总RNA提取 取对数生长期细胞,用PBS洗涤细胞2~3次,胰酶消化细胞并收集细胞悬液,1 500 r/min离心5 min。弃上清,每(5~10)×106个细胞加入1 mL Trizol试剂后,反复用枪吹打,冰上裂解细胞。将Trizol裂解液转入无酶EP管中,室温静置5 min。按每1 mL Trizol加0.2 mL氯仿的量加入氯仿,用力震荡15 s,室温下放置5 min,12 000g,2~8 ℃离心15 min。吸取上层水相置于新的无酶EP管中,按每1 mL Trizol加500 μL异丙醇的量加入异丙醇,室温下放置10 min,12 000g,2~8 ℃离心10 min。弃上清,加1 mL 75%乙醇进行洗涤,涡旋混合,7 500g,2~8 ℃离心5 min。弃上清,干燥沉淀的RNA。加入15~20 μL的DEPC水溶解RNA沉淀,-80 ℃冰箱中保存。操作过程均在冰上进行,以防止RNA降解。核酸检测仪测定RNA的浓度及吸光度OD260/280。
1.2.4qRT-PCR反应 提取BGC-823细胞总RNA,根据逆转录试剂盒说明书将其逆转录为cDNA。根据美国Fermentas公司荧光定量PCR试剂盒说明书进行冰上加样,在PCR仪上进行扩增反应,反应体系如下:10×buffer 2.5 μL、dNTP混合液0.5 μL、cDNA 2.0 μL;上游引物0.5 μL、下游引物0.5 μL、Taq DNA聚合酶0.3 μL、去离子水18.7 μL。扩增条件:95 ℃ 5 min预变性;95 ℃ 30 s变性,60 ℃ 40 s退火,72℃ 40 s延伸,30个循环;72 ℃延伸10 min。以GAPDH为内参,基因表达产物以2-ΔΔCt计算。每组设置3个复孔,每个实验重复3次。所需引物序列包括:Twist上游引物5′-GCTCAGCTACGCCTTCTCG-3′,下游引物5′-GATGCCTTTC CTTTCAGTG-3′;E-cadherin上游引物5′-ATCCAAAGCCTCA GGTCATAAACA-3′,下游引物5′-AAGAAACAGCAAGAGCAG CAGAAT-3′;N-cadherin上游引物5′-CCATCAAGCCTGTGG GAATC-3′,下游引物5′-CCCCAGTCGTTCAGGTAATCAT-3′;GAPDH上游引物5′-CGGGAAACTGTGGCGTGAT-3′,下游引物5′-CAAAGGTGGAGGAGTGGGT-3′。
1.2.5划痕实验 将细胞接种于96孔板中,密度为每毫升1.5×105个细胞,分别对每组细胞进行处理,37 ℃下孵育过夜。在80%~90%浓度下,用10 μL枪头划出一致的划痕伤口,用PBS洗涤细胞2次,37 ℃ 5%CO2培养箱中进行培养。24 h后通过计算划痕面积得出细胞迁移率。每组实验重复3次。
1.2.6Transwell实验 对Matrigel进行1∶8稀释,覆盖在Transwell小室的上室面,37 ℃ 30 min聚集成凝胶。实验前一天细胞饥饿12~24 h。消化细胞,离心弃培养液,PBS洗涤1~2遍,用含BSA的无血清培养基重悬细胞,调整细胞密度每毫升5×105个细胞。向下室加入600 μL含30%胎牛血清的DMEM培养基。取1 00 μL细胞悬液加入上室,置于37 ℃、5%CO2培养箱中培养约24 h。取出小室,用棉签轻轻刮除上室未穿过的细胞。4%多聚甲醛固定20 min后染色。在200倍光镜下计数穿透细胞数,每孔随机计数5个视野中的细胞数。以穿透的细胞数目表示肿瘤细胞的侵袭能力。
1.2.7Western blot检测 消化收集对数生长期细胞,加入99 μL RIPA裂解液与1 μL PMSF制备细胞裂解物,BCA法测定蛋白浓度。取等量的蛋白质进行SDS-聚丙烯酰胺凝胶电泳,并转移到PVDF膜上。条带置于含5%脱脂牛奶的磷酸盐缓冲液中封闭2 h,加入一抗4 ℃孵育过夜。加入二抗37 ℃孵育2 h后,化学发光试剂盒显影蛋白条带,Image J v1.8.0测定相对蛋白表达量。
1.2.8临床病理组织标本 根据赫尔辛基宣言,收集25例临床胃癌组织和相邻的癌旁正常组织(患者术前均未接受过放、化疗)均来自皖西卫生职业学院附属医院(六安市第二人民医院),标本置于-80 ℃液氮中保存。
1.2.9Kaplan-Meier数据分析 在Kaplan-Meier Plotter数据分析平台中检索Twist基因,限定条件为总生存和无疾病进展生存,并在线绘制Twist表达的生存曲线。

2 结果
2.1 Twist对胃癌组织的影响通过qRT-PCR技术检测25例胃癌组织标本结果显示,相对于癌旁组织,Twist在癌组织中表达上升(P<0.05),且通过Kaplan-Meier Plotter软件分析得到Twist基因高表达与胃癌患者的预后呈负相关(P<0.05),说明Twist在胃癌中发挥癌基因作用,且表达水平越高,患者预后越差(图1)。
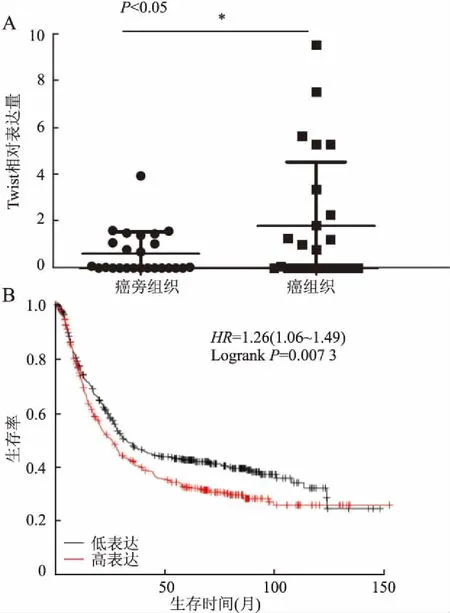
图1 Twist在胃癌及癌旁组织中的表达及其与预后的关系:A.癌与癌旁组织中Twist表达情况;B.生物信息软件预测Twist基因表达与胃癌预后的关系
2.2 干扰Twist基因对细胞迁移能力的影响划痕实验检测干扰Twist对细胞迁移能力的影响,结果发现相比于对照组,干扰组细胞迁移率减低(P<0.05)。提示干扰Twist表达后,细胞迁移能力明显降低(图2)。
2.3 Transwell小室检测各组细胞侵袭能力改变采用Transwell小室检测各组细胞发现:相对于对照组,干扰组细胞数明显减少(P<0.01),提示干扰Twist表达后细胞侵袭能力明显降低(图3)。

图2 划痕实验检测细胞迁移能力改变

图3 Transwell实验检测细胞侵袭能力改变
2.4 干扰Twist基因EMT相关因子的表达采用qRT-PCR及Western blot法检测各组中EMT相关因子E-cadherin及N-cadherin在转录水平上的变化,与对照组相比,干扰Twist表达后,E-cadherin的相对表达量增高(P<0.01),而N-cadherin的表达量降低(P<0.05,图4)。

图4 qRT-PCR检测EMT相关指标的表达:A.qRT-PCR检测E-cadherin mRNA的表达;B.Western blot检测E-cadherin蛋白的表达;C.qRT-PCR检测N-cadherin mRNA的表达;D.Western blot检测N-cadherin蛋白的表达;*P<0.05;**P<0.01
3 讨论
胃癌是消化道较常见的恶性肿瘤,其发生、发展涉及多个环节、多个步骤[6-7]。以往胃癌的好发年龄在50岁以上,且男性的发病率高于女性,但随着人们生活方式、饮食结构、感染等因素的改变,胃癌的发生趋于年轻化。近年肿瘤靶向治疗成为学术界研究的热点,也为胃癌的诊断、治疗及预后提供了新的方向[8]。本实验发现Twist基因参与胃癌BGC-823细胞的生物学进程,推测其可能是胃癌细胞的新型靶向生物标志物,但具体作用机制仍有待进一步研究。
EMT赋予肿瘤细胞更强的侵袭能力及迁移游走的特性[9]。研究表明miR-33a通过Snail/Slug信号通路抑制胃癌细胞的EMT、侵袭和转移等过程[10]。通过实验我们发现Twist基因参与形成胃癌细胞的EMT,抑制其在胃癌细胞中的表达有助于逆转EMT,但关于逆转EMT的具体机制需要后续实验进一步加以验证。
Twist被认为是EMT过程中的关键因子之一。MEST通过STAT3激活导致Twist-1诱导,且通过诱导STAT3核转位能够诱导EMT程序的激活[11]。Wang等[12]发现Twist-1是miR-335的直接靶点且沉默Twist-1基因促进肿瘤细胞凋亡,并逆转了miR-335抑制诱导的细胞活力增加、迁移、侵袭和EMT相关蛋白的异常表达。此外,国内已有文献报道Twist-1参与形成胃癌细胞EMT。本实验发现干扰Twist基因表达后,EMT相关因子E-cadherin表达显著上调,而N-cadherin表达明显下降,说明Twist基因在促进胃癌细胞BGC-823的EMT过程中可能发挥重要的调控作用。此外,干扰Twist表达后,细胞的侵袭和转移能力降低,与前期实验结果一致。前期实验证实细胞骨架蛋白F-actin的表达位置在干扰前后并无明显改变,因此推测在胃癌EMT过程中可能需要其他细胞因子或通道蛋白与Twist共同发挥作用,至于可能存在的调节细胞骨架蛋白的其他关键蛋白或信号转导途径则有待于进一步研究分析。
