CKD患者动态动脉硬化指数与血压变异、肾实质剪切波速度的相关性分析*
2020-07-18陈建平方梦婕廖爱能
陈建平 杨 阳 方梦婕 陈 蓉 廖爱能
三明市第二医院肾内科,福建省永安市 366000
慢性肾脏病(Chronic kidney disease,CKD)系一种高患病率、治疗困难、死亡率高,且知晓率低的慢性病,心血管病变仍是最常见并发症与最主要死因(占CKD死因的45%~60%)。流行病学调查显示:随着CKD病情进展,心血管事件发生率逐渐升高,而进入透析的CKD患者心血管事件发生是非透析人群的20~30倍[1]。血压变异性(Blood pressure variability,BPV)是反应24h血压波动的严重程度,其水平与机体靶器官损害严重程度密切相关,降低BPV水平可显著降低心血管疾病的发生风险[2-3]。CKD患者多合并高血压,且血压昼夜节律,导致动脉硬化发生。动态动脉硬化指数(Ambulatory arterial stiffness index,AASI)系反应动脉硬化程度的新指标,其与高血压靶器官损害(颈动脉粥样硬化、肾损害)、心血管疾病发生率与死亡率密切相关[4],且与肾小球滤过率独立相关。肾实质剪切波速度(Shear wave velocity,SWV)是反应肾组织弹性的指标,其可间接提示肾功能损害程度[5]。研究发现[6]:原发性高血压患者AASI与肾实质SWV呈明显正相关,可以反映肾脏损害程度。本课题组旨在观察CKD患者AASI的变化,探讨其与BPV、肾实质SWV的相关性。
1 资料与方法
1.1 一般资料 纳入2017年12月—2019年6月入住我院经检查(肾脏影像学、有无合并贫血、甲状旁腺功能亢进、钙磷紊乱等)明确诊断为CKD的患者120例,其中男64例,女56例,年龄38~74岁,平均年龄(60.84±12.67)岁。纳入同期健康体检者30例作为对照组,其中男18例,女12例,年龄34~69岁,平均年龄(59.37±12.58)岁。两组在年龄、性别、体质指数等方面具有可比性(均P>0.05)。同时根据AASI值将CKD患者分成AASI正常组49例(AASI≤0.55)和AASI增高组71例(AASI>0.55)。排除标准:(1)各种所致急性肾衰竭、慢性肾功能不全基础上重叠急性肾衰竭者、已行肾脏替代治疗者(血透、腹透)、肾移植者;(2)严重肝脏疾病、心脑血管疾病(心力衰竭、心房颤动、冠心病、高血压急症、心律失常、脑梗死、脑出血等)、急慢性感染、血液系统疾病;(3)甲状腺疾病、恶性肿瘤者;(4)意识障碍、孕妇、依从性差,无法配合检查者。
1.2 方法
1.2.1 临床指标:(1)收集入组对象年龄、性别等基线资料,晨起排空大小便、赤足、着单衣测量身高(m)与体重(kg),计算体质指数(BMI),BMI=体重(kg)/身高(m)2。(2)收集所有入组对象生化、血常规指标,包括白蛋白(ALB)、血肌酐(CREA)、尿酸(UA)、甲状旁腺激素(iPTH)、钙、磷、血红蛋白(Hb)等,并根据MDRD公式估算肾小球滤过率(eGFR)。(3)收集所有入组对象24h尿蛋白定量(24h UP)、尿微量白蛋白/肌酐比值(UACR)。
1.2.2 动态血压参数:所有入组对象均进行非优势臂24h动态血压检测,仪器为MGY-ABP1型动态血压监测仪,白昼每30min测量1次血压(白昼时间为08:00—20:00),夜间每1h测量1次血压(夜间时间为20:00—08:00)。收集24h平均收缩压(24h SBP)、24h平均舒张压(24h DBP)、白昼平均收缩压(d SBP)、白昼平均舒张压(d DBP)、夜间平均收缩压(n SBP)、夜间平均舒张压(n DBP),并根据结果计算24h收缩压变异系数(24h SBPV)、24h舒张压变异系数(24h DBPV)、白昼收缩压标变异系数(d SBPV)、白昼舒张压变异系数(d DBPV)、夜间收缩压变异系数(n SBPV)、夜间舒张压变异系数(n DBPV)。AASI计算:24h舒张压为纵坐标,24h收缩压为横坐标,计算出回归斜率β,而AASI=1-回归斜率β。血压变异系数=标准差/平均值×100%。
1.2.3 肾实质SWV测定:所有入组CKD患者均进行肾实质SWV测定,采用声触诊组织定量(VTQ)技术,仪器为Siemens Acuson S3000多普勒超声诊断仪,探头型号为61C,频率2.0~5.0MHz。体位为侧卧位,二维彩超观察双肾大小、实质回声强度、形态,测量双肾皮质、髓质厚度,然后保持肾冠状面,超声探头置于皮肤不施压,声速方向与肾表面垂直,嘱患者屏住呼吸,分别测量双肾皮质、髓质、肾窦区SWV(取样框位于肾中部皮质区,取样深度<6.0cm)。收集每例受检者稳定的3次结果,计算平均值作为个体值。

2 结果
2.1 两组患者一般临床资料比较 (1)CKD组CREA、UA、iPTH、磷、UACR、24h UP、AASI均较对照组升高(均P<0.01或P<0.05)。(2)与正常对照组比较,CKD组患者ALB、钙、Hb、肾皮质SWV、肾髓质SWV、肾窦区SWV、eGFR均明显降低(均P<0.01)。见表1。
2.2 两组患者SWV、动态血压参数比较 (1)与AASI正常组相比较,AASI增高组患者肾皮质SWV、肾髓质SWV、肾窦区SWV均有明显降低(均P<0.01)。(2)AASI增高组24h SBP、24h DBP、24h SBPV、24hDBPV、d SBP、d DBP、d SBPV、d DBPV、n SBP、n DBP、n SBPV、n DBPV均较AASI正常组明显升高(均P<0.05或P<0.01)。见表2。
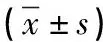
表1 CKD组与对照组一般临床资料比较
2.3 AASI与SWV、动态血压参数的相关性分析 对120例CKD患者进行单因素相关性分析,结果显示:CKD患者AASI与肾皮质SWV、肾髓质SWV、肾窦区SWV、eGFR均呈明显负相关,而与24h SBPV、24h DBPV、d SBPV、d DBPV、n SBPV、n DBPV均呈明显正相关,均P<0.01或P<0.05。见表3。
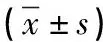
表2 两组SWV、动态血压参数比较

表3 AASI与SWV、动态血压参数的相关性分析
3 讨论
AASI系24h动态血压延伸出用于评估收缩压与舒张压动态关系的指标,其水平的高低可反应动脉硬化的严重程度[7-8]。周成礼等[9]研究发现:冠心病患者AASI与冠脉病变支数、颈动脉狭窄程度呈明显正相关。近些年亦有研究发现[10]:原发性高血压患者AASI与颈动脉内中膜厚度、尿微量白蛋白呈明显正相关。本课题研究发现:与正常对照组比较,CKD患者AASI水平明显升高,且AASI水平与eGFR呈明显负相关(r=-0.679,P<0.01)。这说明AASI可能可以作为评估肾脏损害程度的指标。肾SWV是反应肾组织弹性的指标,其水平与肾脏损害程度呈明显负相关[11]。刘桂荣等[6]研究发现:AASI与肾实质SWV存在相关性。本课题研究发现:AASI升高的CKD患者肾皮质、肾髓质、肾窦区SWV均较AASI正常的CKD患者明显下降(均P<0.01)。进一步相关性分析结果显示:CKD患者AASI与肾皮质、肾髓质、肾窦区SWV水平均呈明显负相关(均P<0.01),这与上述国内外研究结果相一致。这提示AASI水平的高低不仅可评估CKD患者动脉硬化的程度,亦可能是评估肾脏损害程度的良好指标,这可能为临床评估CKD患者肾损害程度提供理论基础。
BPV为反应血压波动的指标,其水平与高血压靶器官损害(心脏、脑、肾脏、眼底、血管)风险密切相关,血压变异系数为最常用指标之一。有研究发现:d SBPV、n DBPV与早期肾损害指标密切相关[12],DBPV能够独立预测CKD患者更差的心血管预后和低灌注相关不良事件[13]。曹滢研究发现:AASI与原发性高血压患者血压昼夜节律、血压变异存在明显相关性。本课题组研究发现:与AASI正常CKD患者比较,AASI升高组CKD患者24h SBP、24h DBP、24h SBPV、24h DBPV、d SBP、d DBP、d SBPV、d DBPV、n SBP、n DBP、n SBPV、n DBPV均明显升高(均P<0.05或P<0.01)。进一步单因素相关分析结果显示:CKD患者AASI水平与24h SBPV、24h DBPV、d SBPV、d DBPV、n SBPV、n DBPV均呈明显正相关,均P<0.01或P<0.05。这说明CKD患者AASI水平与血压变异明显相关,其水平可能可以用于评估心血管事件的发生风险。
综上所述,CKD患者AASI水平明显升高,且其水平与肾小球滤过率、肾实质剪切波速度、血压变异均呈明显相关性。临床上对CKD患者进行AASI评估,有助于了解肾脏损害、动脉硬化、血压变异程度,以期预防心血管事件的发生,进而降低CKD死亡率,改善其远期预后。
