人乳头状瘤病毒与人类疱疹病毒重叠感染在宫颈上皮内瘤变及宫颈癌中的意义
2020-07-18周斌谢福源苏学英左新华
周斌 谢福源 苏学英 左新华
1鹰潭市人民医院细胞学室(江西鹰潭335000);2南昌大学第一附属医院病理科(南昌330006);3四川大学华西医院病理科(成都6100410);4鹰潭市中医院检验科(江西鹰潭335000)
宫颈癌是女性生殖系统常见恶性肿瘤,随宫颈细胞学涂片普查的推广,宫颈癌发病率有所降低,但呈现年轻化发展趋势[1]。统计报道,全球范围内每年宫颈癌新发病例逾47 万,我国宫颈癌新发病例约有13.5 万,且宫颈癌仍为威胁女性生殖健康的主要恶性肿瘤之一[2]。已有大量研究数据证实,人乳头状瘤病毒(human papilloma virus,HPV)感染是宫颈癌发生的始动因素。HPV 的DNA 整合进入宿主细胞DNA 组在HPV 诱导宫颈癌变中发挥关键作用[3]。一般HPV 感染多通过性途径传播,大多数无明显症状[4]。全球约有3 亿携带HPV 感染无症状女性,大多数女性感染HPV 后可在8~10 个月内自行消失,但仍有5%~10%的女性机体无法自动清除HPV,呈HPV 持续感染,可能出现宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN),经过数十年最终进展为宫颈癌。但近年来有学者指出,宫颈癌发病并非由单一HPV感染参与,生殖道病原微生物感染同样可能参与宫颈癌发病过程,尤其感染病原菌种类增加可能增加宫颈癌发病风险[5-6]。人类疱疹病毒(epsteinbarr virus,EBV)属疱疹病毒科嗜淋巴细胞病毒成员,与儿童淋巴瘤、鼻咽癌发病密切关联,被认为是可能致癌人类肿瘤病毒之一[7-8]。对EBV 感染与宫颈癌发病的关系尚存在争论。研究统计,约有60%的宫颈癌患者癌组织存在EBV 感染[9]。也有报道发现,CIN 患者EBER1 mRNA 检出率高达83%,宫颈癌组织检出率约为75%[10]。但对HPV、EBV 重叠感染在CIN 及宫颈癌发病中的意义及价值鲜少见报道。本研究拟选取课题组所在医院留存归档的CIN 组织标本92 份、宫颈癌组织标本49 份、正常宫颈组织标本30 份,以免疫组化法测定HPV、EBV 蛋白表达,旨在探讨EBV、HPV 在宫颈癌发病中的作用,以期为宫颈癌防治提供依据。
1 资料与方法
1.1 一般资料选取课题组所在医院2017年1月至2019年1月收治且留存组织标本的CIN 92 例及宫颈鳞癌49 例作为研究对象。所有对象年龄30~59 岁;术前均未接受放化疗或其他抗肿瘤治疗;未合并其他恶性肿瘤;临床分期按国际妇产科联盟大会通过[11]相关标准;组织学分级参照《外科病理学》[12];组织标本均经病理科医师复查确诊。其中CINⅠ级38 例,CINⅡ~Ⅲ级54 例,宫颈癌49例。CINⅠ级患者年龄30~59 岁,平均(42.6±10.7)岁;CINⅡ~Ⅲ级年龄30~58 岁,平均(42.5±10.3)岁;宫颈癌患者年龄32~58 岁,平均(43.5±11.3)岁。对照组取自同期因子宫良性疾病切除子宫但光镜下宫颈上皮无异常病变的30 例患者,年龄30~58 岁,平均(41.9±10.5)岁。
1.2 主要试剂与仪器HPV 鼠抗单克隆抗体、EBV 鼠抗单克隆抗体、辣根标记抗小鼠IgG 多聚体、即用型免疫组化通用试剂盒、胰蛋白酶、DAB显色剂(均购自北京中杉生物技术公司);株海黑马Win1412 台式高速离心机,德国Leica RM2235型切片机,亚光YT-6C 型烤片机,Olympus CX-31 型显微镜、数码摄像系统。
1.3 方法免疫组化染色:各组织标本3~4 μm连续切片,作HPV、EBV 免疫组化染色,预实验已知阳性切片作为阳性对照,磷酸盐缓冲液(phosphate buffer solution,PBS)替代一抗作为阴性对照。切片60 ℃烘烤1 h,脱蜡至水,3%过氧化氢封闭消除内源性过氧化物酶,PBS 洗涤3 次×3 min,热抗原修复,PBS 洗涤3 次×3 min,加入正常山羊血清封闭内源性生物素,加入稀释HPV 鼠抗单克隆抗体(1∶50)、EBV 鼠抗单克隆抗体(1∶50),4 ℃冰箱内过夜,PBS 洗涤3 次×3 min,加入生物素标记羊抗小鼠二抗,37 ℃孵育40 min,PBS 洗涤3 次×3 min,加入过氧化物酶标记链霉菌抗生物素蛋白,37 ℃孵育0.5 h,PBS 洗涤3 次×3 min,DAB 溶液显色5~15 min,自来水冲洗,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,镜下观察,HPV 蛋白阳性染色定位于宫颈鳞状上皮细胞核,呈棕黄色;EBV 蛋白阳性表达于EBV 感染细胞质内,少部分见于淋巴细胞或细胞核内,呈棕黄色。每切片至少取5 个高倍视野,累及计数1 000 个细胞以上,EBV 或HPV 阳性细胞数超过10%视为阳性[13-14]。两者均阳性视为HPV、EBV重叠感染。
1.4 统计学方法采用SPSS 20.0 对数据进行统计分析,正常宫颈组织、CIN、宫颈癌HPV、EBV 阳性率比较采用等级秩和检验与χ2或Fisher 检验,组间两两比较应用χ2分割检验,变量相关性分析采用Spearman 等级相关分析,HPV、EBV 感染与宫颈癌发生是否存在协同作用采用析因分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组HPV 蛋白、EBV 蛋白免疫组化结果整体比较:随宫颈上皮内瘤变的进展,HPV 阳性率、EBV 阳性率、HPV+EBV 阳性率上升,比较差异有统计学意义(P<0.05),HPV 阳性、EBV 阳性率、HPV+EBV 阳性率均与宫颈上皮内病变等级呈正相关(r=0.717、0.619、0.604,P<0.001),见表1和图1~2。分割比较:正常宫颈组织HPV 阳性率、EBV 阳性率、HPV+EBV 阳性率低于CINⅡ~Ⅲ级、宫颈癌组织(P<0.05),CINⅠ级HPV 阳性率、EBV阳性率、HPV+EBV 阳性率低于CINⅡ~Ⅲ级、宫颈癌组织(P<0.05),CINⅡ~Ⅲ级HPV 阳性率、EBV阳性率、HPV+EBV 阳性率又低于宫颈癌组织(P<0.05),见表2。
2.2 HPV 感染、EBV 感染、HPV+EBV 感染与宫颈癌发病的协同关系分析以宫颈癌发病为因变量,纳入HPV 感染、EBV 感染及其重叠感染进行析因分析,结果证实HPV+EBV 重叠感染对宫颈癌发病存在协同影响(F=5.687,P=0.018),方差分析两者交互作用明显,HPV+EBV 重叠感染对宫颈癌发病影响明显,见表3。
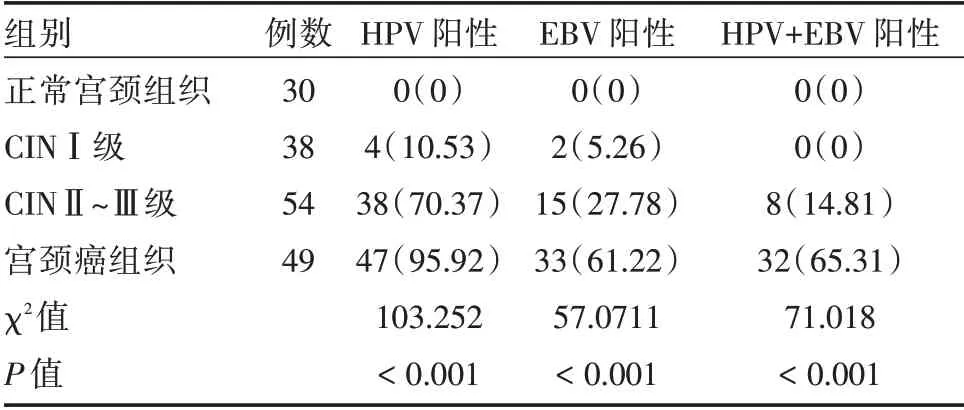
表1 各组HPV 蛋白、EBV 蛋白免疫组化结果Tab.1 Immunohistochemical results of HPV protein and EBV protein in each group 例(%)
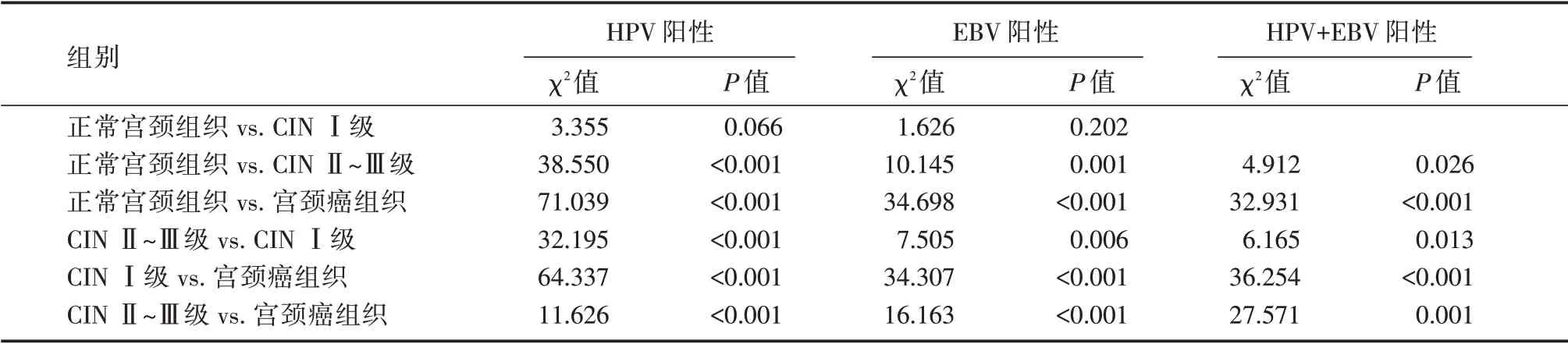
表2 各组HPV、EBV 蛋白阳性率免疫组化结果(两两分割比较结果)Tab.2 Immunohistochemical results of HPV protein and EBV protein positive rates in each group(segmentation comparison results between any two)

图1 各组组织HPV 蛋白免疫组化结果(IHC×200)Fig.1 Immunohistochemical results of HPV protein in tissues of each group(IHC×200)

图2 各组组织EBV 蛋白免疫组化结果(IHC×200)Fig.2 Immunohistochemical results of EBV protein in tissues of each group(IHC×200)
3 讨论
宫颈从正常上皮转化为癌变历经复杂的病理过程,CIN 已被证实为宫颈癌癌前病变[15]。目前已证实高危型HPV 感染系引起CIN 及宫颈癌的重要原因[16]。HPV 系寄生于鳞状上皮层小分子的双链闭合环状DNA 肿瘤病毒类型,属乳头多瘤空泡病毒科乳头瘤属,含E1、E2、E4、E6、E7 等早期表达基因,其中E1 与HPV DNA 复制有关,E2 参与病毒DNA 转录反式激活,E4 则与细胞结合有关,E6、E7 则与病毒致癌性及细胞功能转化有关,系HPV关键致癌蛋白类型[17]。体外实验发现,HPV 编码蛋白E6、E7 可维持小鼠上皮细胞永生化[18]。E6蛋白可特异性与肿瘤抑制蛋白p53 结合促使其降解,影响细胞周期调控;同时可激活端粒酶,导致细胞逃避衰老过程增殖制约,促使癌细胞永生化;此外,E6 蛋白可与干扰素调因子结合,促使其逃逸机体免疫反应;且可粘附于肿瘤坏死因子表面,提升其活性,抑制细胞凋亡[19]。而E7 蛋白则主要通过抑制p27、p15 等细胞周期蛋白依赖性激酶抑制因子活性,驱动细胞过度增殖,导致细胞周期失控[20]。国外研究报道[21],有超过90%宫颈癌组织皆可检出HPV DNA。国际宫颈癌协会对宫颈癌患者展开大样本研究[22],发现有超过2/3 的宫颈癌均感染HPV 16 亚型或HPV 18 亚型。本研究通过对正常癌组织、CIN 及宫颈鳞癌组织标本进行免疫组化检测发现,正常宫颈及CIN Ⅰ级患者宫颈鳞状上皮组织基本上无或鲜少检出HPV 表达;而随CIN 级别的上升,HPV 阳性率均上升,尤其宫颈癌组织HPV 阳性率较高,提示HPV 阳性率与宫颈病变程度存在紧密联系,随HPV 阳性率的上升,宫颈病变程度增加,这与AFONSO 等[23]报道结论相似,提示HPV 感染与宫颈上皮内瘤变及癌性转化存在紧密联系。
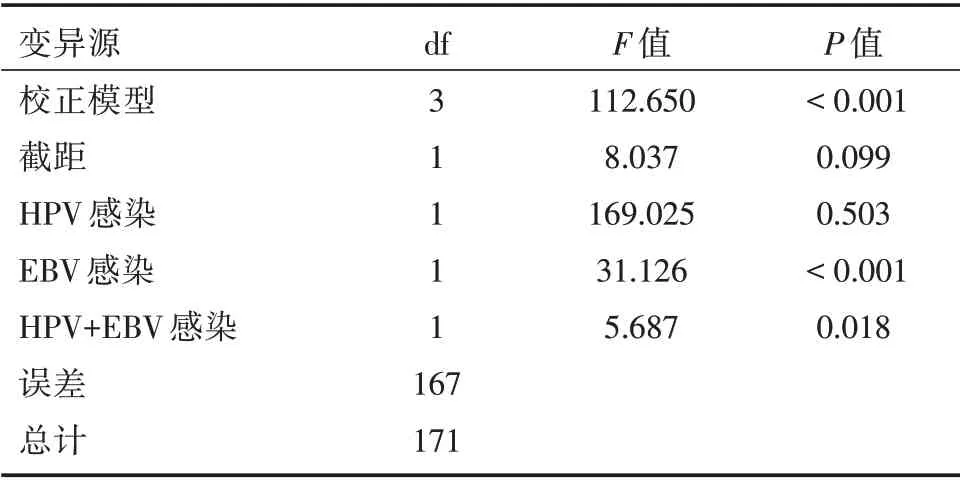
表3 HPV 感染、EBV 感染、HPV+EBV 感染与宫颈癌发病的协同关系分析Tab.3 Synergetic relationship between HPV infection,EBV infection,HPV+EBV infection and the onset of cervical cancer
近期也有越来越多研究者提出,宫颈癌并非单一HPV 感染作用的结果,或可能与生殖道多重感染有关[24-25]。EBV 属疱疹病毒科r 疱疹病毒,外形与其他疱疹病毒类似,含环形蛋白核心,包绕双链DNA,主要感染B 淋巴细胞,亦可造成上皮细胞感染[26]。研究发现,EBV 长期潜伏于淋巴细胞内,并以环状DNA 形式游离于胞浆内,整合于宿主染色体内,潜伏感染下,大多数细胞EBV DNA 处于潜伏状态[27]。目前已被证实EBV 属关键DNA 致瘤性病毒,存在细胞转化效应,参与鼻咽癌、B 细胞淋巴瘤发病过程[28-29]。TOLIMAN 等[30]发现,精液可引起EBV 活化,同时含细菌宫颈黏液可能对EBV 活化存在协同效应,故推测EBV 或可能与宫颈癌发病有关。WOESTENBERG 等[31]应用PCR 技术对宫颈癌患者EBER1 mRNA 检测发现,其组织EBER1 mRNA 检出率超过70%,CIN 超过30%。MESHER 等[32]发现,宫颈癌中约有3/5 存在EBV 感染。以上研究皆认为EBV 或可能参与宫颈上皮癌变过程。本研究结果显示,正常宫颈组织、CINⅠ级患者组织标本基本上无EBV 感染;而随宫颈上皮瘤变程度的增加,EBV 感染率增加,提示EBV 感染可能参与宫颈上皮内瘤变癌性转化过程,但对宫颈病变早期事件,诸如CINⅠ关系不大。本研究还发现,宫颈癌患者癌组织HPV+EBV 重叠感染率高达65.31%,但在正常宫颈组织与CIN 中HPV+EBV 重叠感染率极低,故推测两者双重感染极有可能与宫颈癌发生有关。进一步展开HPV、EBV 感染相关性分析发现,HPV 阳性病例EBV 阳性率较高,存在正性相关关系,说明HPV 感染与EBV 感染可能存在一定的互相影响及协同关系。进一步进行析因分析发现,HPV、EBV 感染协同参与宫颈癌发病过程,分析EBV 感染后其受体分布于宫颈上皮细胞,可能通过干扰p16 蛋白功能、上调bcl-2 表达引起细胞周期调节失控,参与宫颈癌发病[33];而HPV 可通过引起p53 基因突变,引起宫颈癌变,两者协同可能加速宫颈癌癌前病变进程[34]。但对两者重叠感染的对宫颈癌发病的确切机制及具体协同机制尚待进一步研究论证。
综上,CIN、宫颈癌发病皆与HPV 感染有关,而EBV 感染可能为高级别CIN 及宫颈癌发病的重要原因;且HPV、EBV 重叠感染与宫颈癌发生有关,同时HPV、EBV 感染或可能存在协同机制,但本研究尚未对两者是否存在协同具体机制展开研究,存在一定的局限性,对其确切机制尚待进一步展开试验论证。
