红斑丹毒丝菌分离鉴定及主要保护性抗原基因遗传进化分析
2020-07-17陈晓月邵晴青杨婷婷文雪霞
陈晓月,邵晴青,杨婷婷,陈 旭,文雪霞,张 莹
(沈阳农业大学 畜牧兽医学院/东北畜禽疫病研究教育部重点实验室,沈阳110161)
猪丹毒是由红斑丹毒丝菌(Erysipelothrix rhusiopathiae)引起的一种猪的急性、热性传染病,其特征为急性败血症、皮肤荨麻疹和多发性关节炎等。20世纪80~90年代初,猪丹毒与猪瘟、猪肺疫并称为我国养猪业的三大传染病,给养猪业造成很大的经济损失[1]。红斑丹毒丝菌是一种人畜共患传染病的病原,不仅能引起多种动物发病,也能感染人,严重威胁食品卫生安全和人类健康。该病于1882年首次报道,我国最早发生在四川,之后多个省份都有流行的报道。由于疫苗的广泛使用,使本病得到了有效控制。但近年来,国内外多个地区又出现猪丹毒散发的报道,提示该病有卷土重来的趋势[2-3]。红斑丹毒丝菌是革兰氏阳性菌,血清型众多,迄今已经确认26个血清型,致病力大小与血清型存在一定关系,血清1型(包括1a和1b)毒力最强,主要引起急性败血型猪丹毒,血清2型毒力较弱,主要引起斑块型或关节炎型猪丹毒。有研究发现[4-5],丹毒丝菌的表面保护性抗原蛋白(surface protectantigen,spaA)具有良好的免疫原性,是研制猪丹毒丝菌亚单位疫苗的候选抗原,由N端的免疫保护区域和C端的细胞结合区域组成。研究证实spaA在丹毒丝菌感染中发挥重要作用[6-7],成为研制新型猪丹毒疫苗的一个热点。
本研究对发生在辽宁某猪场的疑似猪丹毒病例进行细菌分离培养和鉴定,测定分离菌的致病力,筛选出敏感药物用于指导生产实践。并扩增分离菌株spaA基因序列,将获得的基因序列与其他地区分离菌株spaA基因序列进行比对分析,以期为研制猪丹毒亚单位疫苗提供候选菌株。
1 材料与方法
1.1 材料
病料样品来源于辽宁某猪场疑似猪丹毒病死猪,采取脾脏、肝脏和肺脏。体重18~22g SPF雌性昆明系小白鼠购自辽宁长生生物技术股份有限公司。营养肉汤、营养琼脂、麦康凯、鲜血琼脂、LB等培养基、微量糖发酵管、凝胶回收试剂盒均购自联博生物科技有限公司。Premix Polymerase、pMD19-T载体、琼脂糖等均购自大连TaKaRa公司;药敏纸片购自杭州微生物试剂有限公司。
1.2 引物的设计与合成
参照文献分别合成细菌16S rDNA基因通用引物27F/907R[8],spaA基因引物spaAF/spaAR[9],引物均由上海生物工程技术服务有限公司合成。
1.3 细菌的分离培养及鉴定
1.3.1 细菌的分离、涂片镜检 无菌采集病死猪的肺脏、脾脏和肝脏,接种于鲜血琼脂平板上进行细菌的分离,置于37℃24h培养后挑取疑似菌落经革兰氏染色镜检,挑取单菌落接种于麦康凯培养基和血平板上观察其培养特征,并进行纯培养。
1.3.2 生化试验 分离菌株的纯培养物,接种葡萄糖、乳糖、甘露醇、蔗糖等微量发酵管,37℃培养24~48h后,观察并记录结果。取分离菌株的纯培养物做M.R试验和V-P试验,37℃培养2~3d后观察并记录结果。
1.4 分离菌株PCR鉴定
细菌基因组DNA提取试剂盒提取DNA,以其为模板,扩增16S rDNA基因片段,PCR反应体系20μL,上下游引物各 1μL,premix 酶 10μL,模版 2μL,ddH2O 6μL。 反应条件为 94℃ 4min,94℃ 1min,51℃ 40s,72℃1min,30个循环,最后72℃延伸5min。PCR产物经1%琼脂糖凝胶电泳检测,并纯化回收,测序由上海生物工程有限公司进行。
1.5 spaA基因的扩增及遗传进化分析
以细菌基因组为模版,扩增spaA基因。反应体系20μL:Premix酶10μL,模版2μL,上下游引物各1μL,ddH2O 6μL。 反应条件:94℃4min,94℃1min,51℃1min,72℃2min,30个循环,最后 72℃延伸 10min。 1%琼脂糖凝胶电泳检测,纯化回收目的片段,连接T载体,构建阳性重组质粒,由上海生工测序。利用DNAstar生物学软件将所得序列与国内外已发表的spaA基因序列进行比对和遗传进化分析。
1.6 药物敏感性试验
采用药敏纸片扩散法,将经16S rDNA测序确定为红斑丹毒丝菌的分离菌进行肉汤培养,微量点板法测定细菌的数目,调整菌液浓度为1×107cfu·mL-1,将菌液均匀涂布在血琼脂平板上,贴上药敏试纸片,37℃培养24h,通过测量药敏纸片抑菌圈大小,参照《抗菌药物敏感性试验标准》,评定敏感、中度敏感、高度敏感和耐药,筛选高度敏感药物指导临床用药。
1.7 细菌的致病力检测及小鼠脏器病理组织学变化
以每毫升菌液中的菌体个数的对数值为纵坐标,培养时间为横坐标,测定分离菌株的生长曲线。根据数值得出培养2h分离菌株进入对数生长期,8~10h进入稳定期,因此采取培养8h的菌液进行LD50测定。
采用平板菌落计数法测定每毫升菌液中活菌数,使菌数达到1.0×108CFU·mL-1,再用灭菌生理盐水对菌液进行倍比稀释,从 10-4,10-5,10-6,10-7,10-8,10-9稀释菌液中分别吸取 0.1mL 对小鼠腹腔注射,每个浓度重复注射5只小鼠,连续观察7d,记录小鼠发病死亡情况,并对死亡小鼠进行剖检,4%的多聚甲醛固定、石蜡包埋,制备组织切片,进行常规HE染色,光学显微镜下观察小鼠脏器的病理组织学变化。半数致死量(LD50)计算方法按照Reed-Muench法进行[10]。
2 结果与分析
2.1 发病猪的病理剖检变化
由图1可知,病死猪的脾脏明显淤血、肿大,呈暗红色,是健康猪脾脏的5~10倍,此剖检症状与非洲猪瘟病死猪的病理变化非常相似,容易引起误判和误诊,因此在现场诊断时应加以注意。
2.2 细菌的分离、纯化、镜检及生化试验结果
分离菌在血琼脂平板上形成湿润、光滑、透明、灰白色、露珠样的圆形小菌落,并形成α溶血环(图2a),在麦康凯培养基上不生长。经革兰染色镜检显示为革兰氏阳性、两端钝圆的纤细小杆菌,单个或成堆状排列(图2b)。
由表1可知,分离菌能发酵葡萄糖、果糖和乳糖,产酸不产气;分离菌不发酵甘露醇、蔗糖、山梨醇。MR及V-P试验均为阴性。生化特性与文献报道的红斑丹毒丝菌的生化特性一致[11]。
2.3分离菌株PCR鉴定结果
采用试剂盒提取两个优势菌落的核酸,扩增16S rDNA基因,结果显示900bp处有一明显条带,与预期片段大小相符(图3第1,2泳道)。该基因测序结果经BLAST比对,显示两株菌株16S rDNA基因序列与GenBank中红斑丹毒丝菌序列的同源性达90%(CP029804;CP017116),确定本次试验分离的菌株为红斑丹毒丝菌,分别命名为LN201801和LN201802。
2.4红斑丹毒丝菌主要表面保护性抗原基因(spaA)的扩增及遗传进化分析
2.4.1 spaA基因扩增结果 1%琼脂糖凝胶电泳检测spaA基因扩增结果,显示在1800bp处有明显的条带,与预期大小一致(图3第3,4泳道)。经序列测定获得分离菌株spaA基因序列,长度为1881bp。
2.4.2 spaA基因遗传进化分析 选取32条国内外已经发表的spaA基因序列(登录号、菌株名称、血清型、分离地及分离时间见表2)为参考,采用DNAstar生物信息学软件对辽宁分离株进行序列比对分析和遗传进化分析。

图1 猪的脾脏图片Figure 1 Spleen pictures of pigs
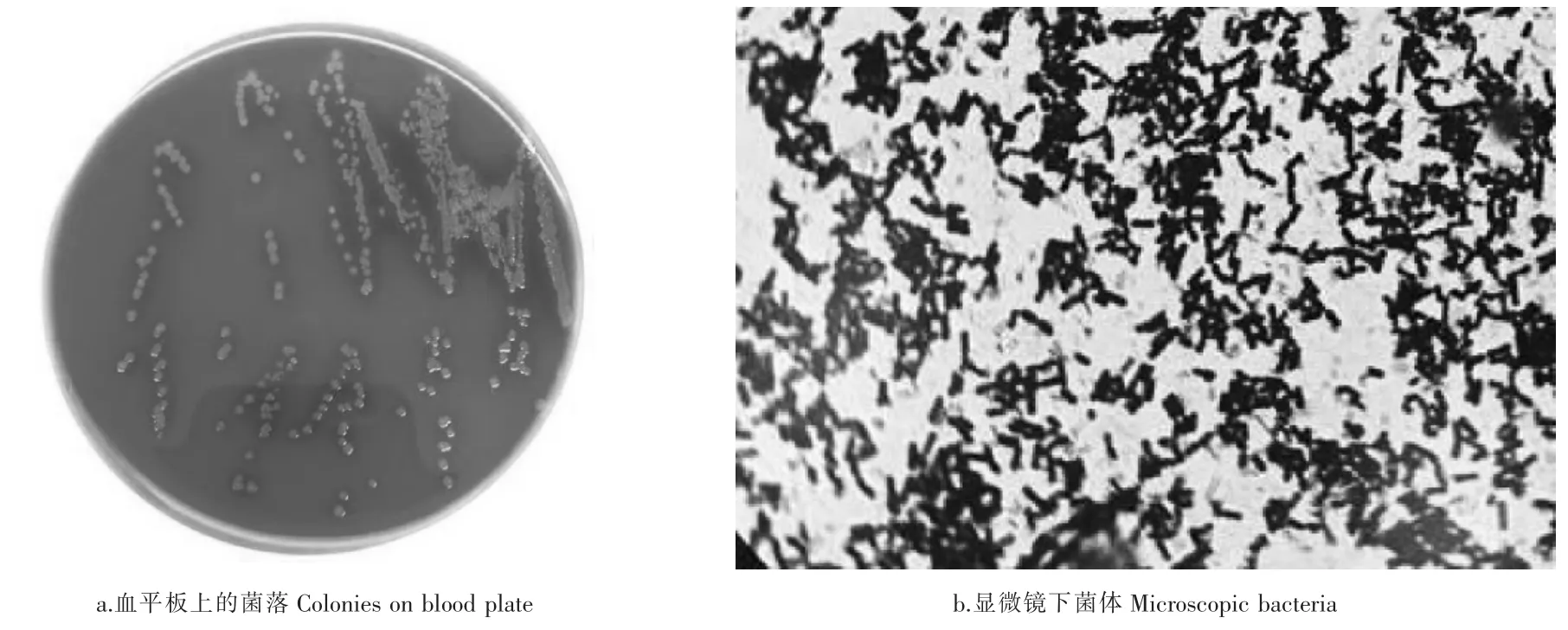
图2 菌落和显微镜下菌体形态Figure 2 Colony and Microscopic morphology(10×100)
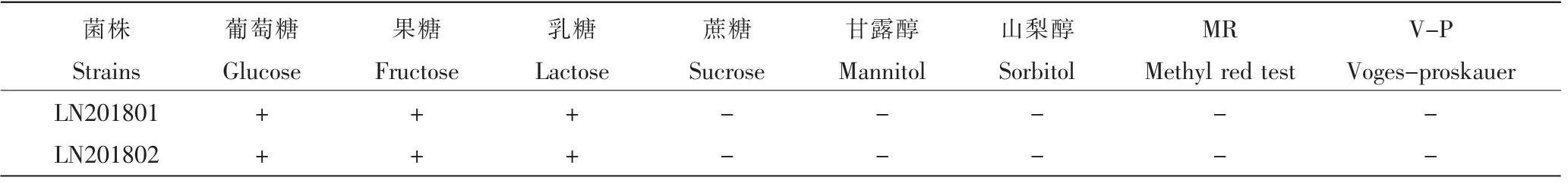
表1 菌落和显微镜下菌体形态Table 1 Biochemical experiments of isolated strains
由图4可知,34条序列核苷酸相似性介于94.5%~100%。其中,辽宁分离株LN201801、LN201802(黑色箭头)spaA基因序列与合肥分离株AQ150411、LA150627、BZ150422,与安徽分离株AQ150414,与德国分离株IMT18232的同源性均为100%。LN201801和LN201802与已知强毒菌株日本分离株Fujisawa的核苷酸同源性为99.9%。LN201801和LN201802与已知疫苗株G4T10(灰色箭头)、GC42(灰色箭头)的同源性分别为95.2%和95.8%,是上述32株基因序列中与辽宁分离株同源性最低的菌株。从spaA基因序列的系统发育树分析结果可见,辽宁分离株LN201801、LN201802与合肥分离株AQ150411、LA150627、BZ150422、TL140918,与安徽分离株 AQ150414、HF140607、FY150511, 与湖南分离株Yy1、Zh1,与湖北分离株SE38位于同一分支上,提示该病存在跨地区传播的可能性。而辽宁分离株LN201801和LN201802与我国疫苗株GC42和G4T10的遗传进化关系较远,为现场出现疫苗免疫失败提供了理论基础。
2.5 红斑丹毒丝菌spaA蛋白的生物信息学分析
2.5.1 spaA蛋白理化特性分析 登录http://us.expasy.org/tools/protparam.html对spaA的理化性质分析,spaA含有 626个 aa,蛋白分子量(MW)为 72.294ku,等电点(pI)为 8.93,分子式为 C3260H5104N854O956S23,消光系数为 82.06,脂溶指数(aliphatic index)为 82.06,总平均亲水性(grand average ofhydropathicity,GRAVY)为 -0.570,该蛋白是脂溶性蛋白,不稳定系数(instability index)为39.57,为稳定蛋白。
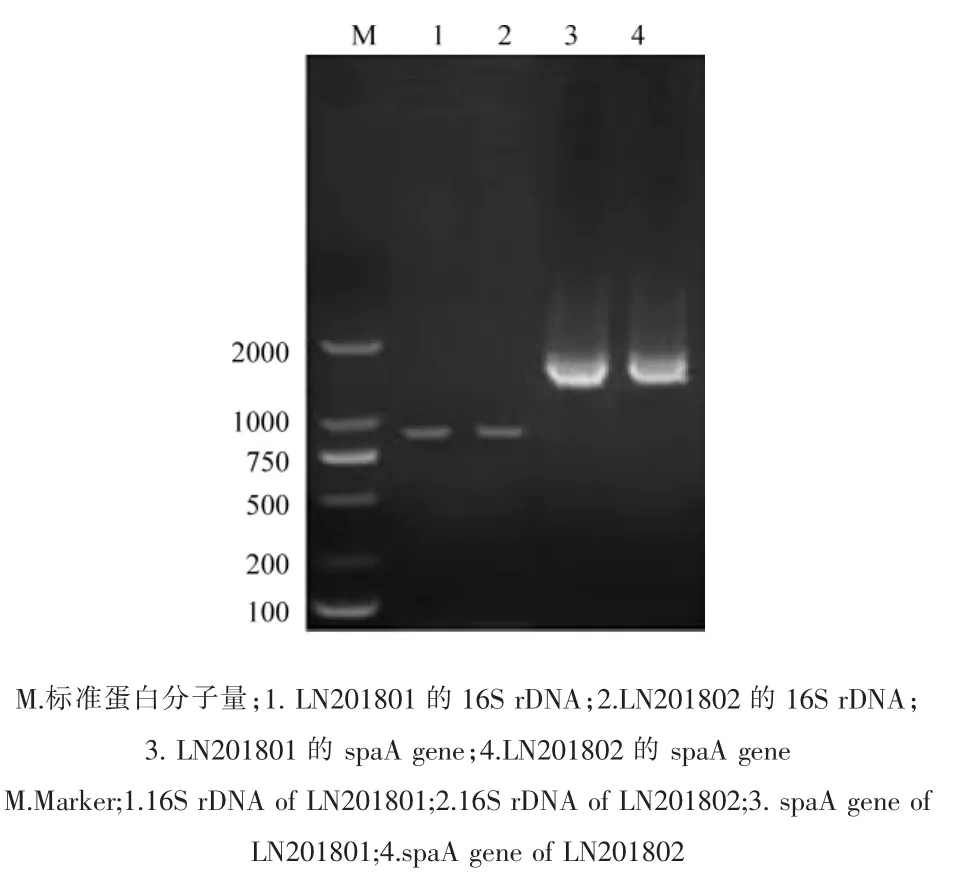
图3 分离株 16S rDNA和spaA基因扩增结果Figure 3 results of 16S rDNA and spaA gene of isolates
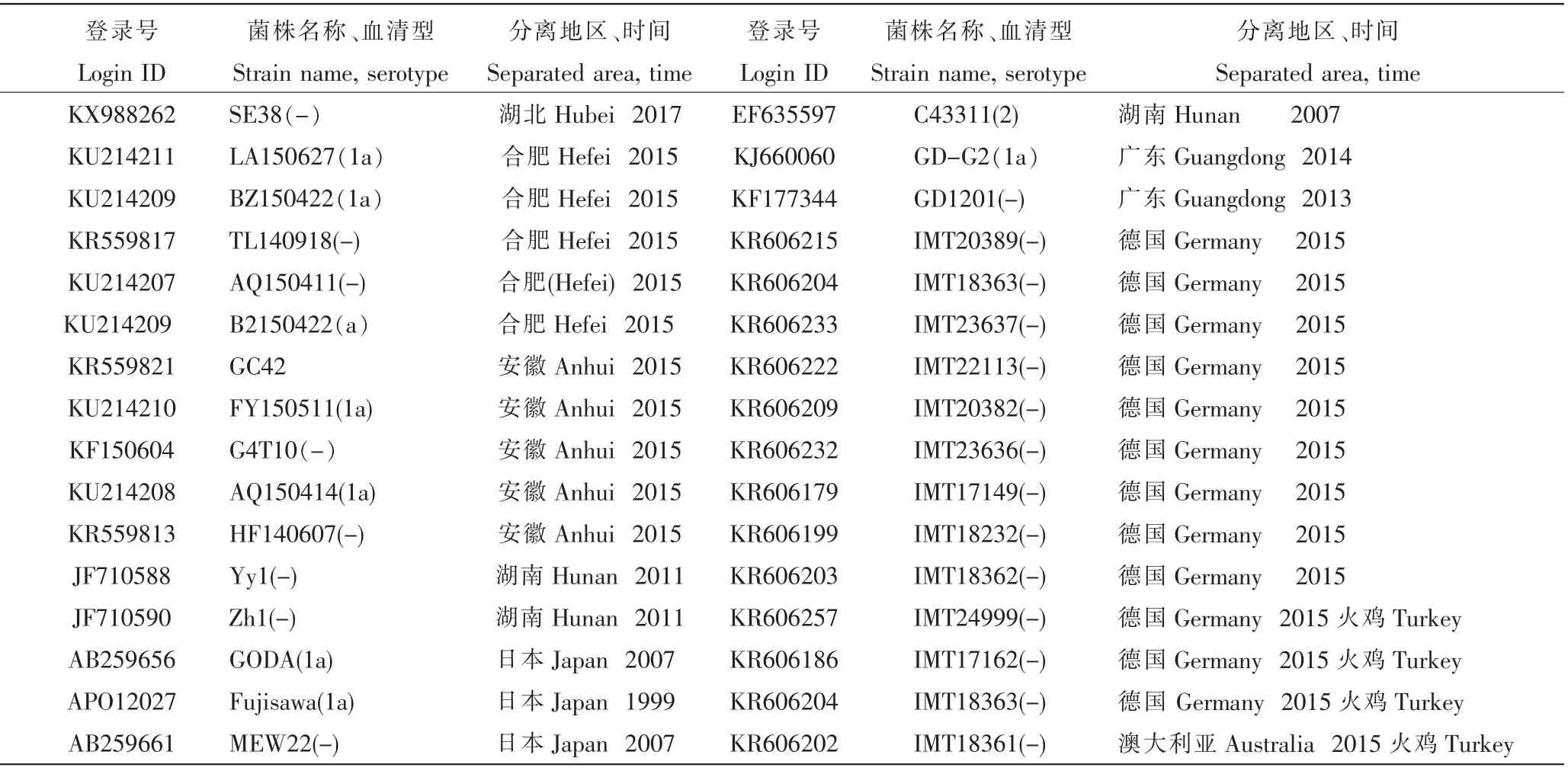
表2 红斑丹毒丝菌spaA基因参考菌株Table 2 Erysipelothrix rhusiopathiae spaA gene reference strains

图4 红斑丹毒丝菌分离菌株与参考菌株spaA基因序列的系统进化树Figure 4 Phylogenetic tree based on spaA gene sequence of the isolated strains and reference strains

图5 spaA蛋白疏水性结果Figure 5 Hydrophobicity of spaA protein

图6 spaA蛋白三级结构预测Figure 6 Tertiary structure prediction of spaA protein
2.5.2 疏水性分析 登录http://web.expasy.org/protscale/,利用在线软件进行分析,结果显示蛋白总平均疏水指数为-0.57,为亲水性蛋白(图5)。
2.5.3 二级结构和三级结构的预测 登录http://scratch.proteomics.ics.uci.edu/,进行蛋白质二级结构的预测。登录 http://www.expasy.org/swissmod/swiss-model.html,在线分子建模,利用已知序列用RASWIN软件对SpaA蛋白进行三级结构预测(图6)。该蛋白有108个螺旋,6个伸展链和30个卷曲结构。该蛋白为非跨膜蛋白,有两个主要结构域,分别为 Domain1:1-261,Domain2:262-626。不形成二硫键。
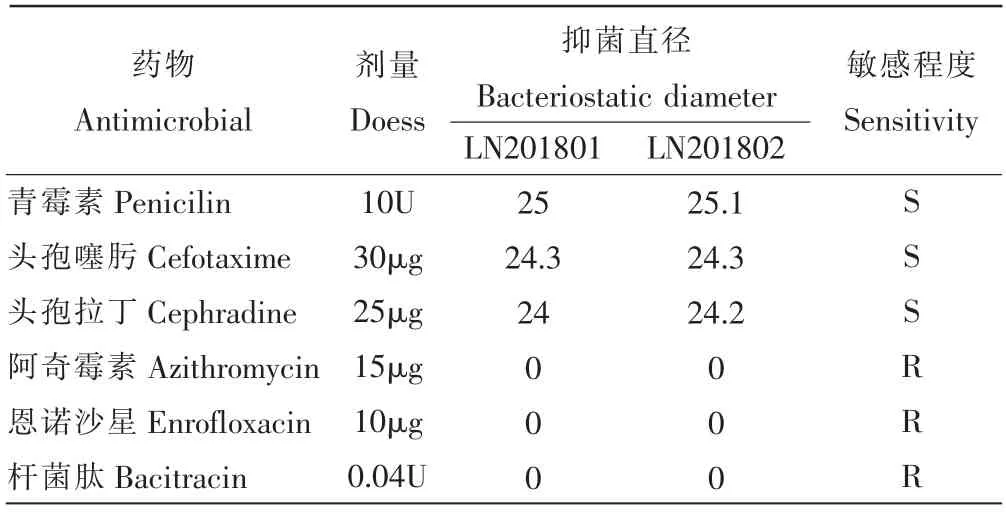
表3 分离菌药敏试验结果Table 3 Strains of drug sensitivity test results /mm
2.6 细菌药敏试验结果
药物敏感性试验结果显示,分离菌对青霉素和头孢噻肟、头孢拉丁高度敏感,对阿奇霉素、杆菌肽和恩诺沙星不敏感(表3)。
2.7 分离菌致病力测定和小鼠脏器组织病理变化结果
2.7.1 分离菌致病力测定 感染组小鼠在接种分离菌株2h后,小鼠表现为精神萎顿、食欲减退,被毛松乱,实验组小鼠36h后开始出现死亡,10-4和10-5组小鼠全部死亡,10-6组小鼠死亡4只,10-7组小鼠死亡1只,10-8和10-9组小鼠未见死亡,对照组小鼠连续饲养7d,状态良好,无异常变化。采用Reed-Muench法计算LD50,结果见表4,两株菌株均为强毒菌株。

表4 半数致死量的检测结果Table 4 Results of LD50
2.7.2 小鼠的组织病理学变化 无菌取病死小鼠肝、肺、脾,经4%多聚甲醛溶液固定,脱水,石蜡包埋,制片(4μm厚),HE染色,在光学显微镜下观察。由图7可知,肺脏大量肺泡腔内有较多红细胞(图7B1,黑色箭头所示)。肝脏静脉及肝窦淤血扩张,静脉腔与肝窦内可见大量红细胞(图7B2黑色箭头);中央静脉周围可见大量肝细胞变性,胞质中明显可见大小不一的圆形空泡(图7B2灰色箭头)。脾脏脾小结面积减小,淋巴细胞数量明显减少,红髓中可见较多嗜酸性物质渗出(图7B3黑色箭头)。
3 讨论与结论
猪丹毒作为古老的疾病之一,一直威胁着养殖业和人类健康,至今仍没有理想的根除方法和治疗措施[16]。红斑丹毒丝菌是猪丹毒的病原菌,常寄生在家猪的扁桃体和其他淋巴组织中,通过排泄或口鼻分泌物排出体外,成为重要的传播源。该病主要预防手段是疫苗接种,但存在保护率低、保护周期短等缺点[17-18]。药物预防常用的药物为青霉素和氨苄青霉素类抗生素,但因某些地区分离菌株具有耐药性及药物残留的风险,使药物预防难以获得预期效果。因此,研制高效疫苗是防制该病的关键。
红斑丹毒丝菌辽宁分离菌株的耐药性与安徽分离菌株药物敏感性存在不同[20-22],说明不同地区分离株耐药性存在差异,可能与基因进化、饲养管理以及环境因素等有关。提示现场用药治疗时,有必要通过药敏试验筛选敏感药物,进行针对性的治疗。
红斑丹毒丝菌的spaA基因较为保守,国内外34条spaA核苷酸相似性均在90%以上,进一步证实了该基因的保守性。辽宁分离株、安徽分离株、合肥分离株、湖北分离株、湖南分离株在遗传进化树处于同一分支,表明该病存在跨地区传播,在生猪运输管理中一定要严格管理,严格检疫,避免该病跨区域传播流行。
目前,猪丹毒的防控主要通过疫苗接种,我国猪丹毒疫苗的菌株为G4T10和GC42,序列分析显示辽宁分离株与两株疫苗株spaA序列同源性最低,遗传进化树分析分别位于不同的分支,为从分子水平上揭示某些地区疫苗免疫失败提供了理论支持。近年来,猪丹毒丝菌表面保护性抗原spaA越来越受到重视,很多研究学者认为spaA蛋白具有免疫保护作用,是一种高效、稳定的亚单位疫苗的候选材料。

图7 不同组织脏器的病理组织学变化(HE 400×)Figure 7 Histopathological changes in different organs of the infected mice(HE 400×)
