利用宏DNA条形码研究浮游动物多样性
——以鸭绿江口为例
2020-07-17高养春李海涛王孝程战爱斌AileenTANShauHwai李宏俊
高养春, 李海涛, 王孝程, 孙 艺, 战爱斌, Aileen TAN Shau-Hwai, 李宏俊,*
1 国家海洋环境监测中心,大连 116023 2 中国科学院生态环境研究中心,北京 100853 3 国家海洋局南海环境监测中心,广州 510300 4 Centre for Marine and Coastal Studies, Universiti Sains Malaysia (USM), 11800, Penang, Malaysia 5 广东省生物资源应用研究所,广州 510260
浮游动物种类多、数量大、分布广,是海洋生物多样性的重要组成部分[1]。作为海洋初级生产力向高营养级传递的关键环节,浮游动物在海洋生态系统的物质循环和能量流动中起着重要作用,同时浮游动物对环境扰动非常敏感,其种类组成和群落结构可作为海洋生态系统结构变化的重要指示[2],可以为评价海洋生态系统环境质量和健康状况提供指标[3]。浮游动物种类的准确鉴定是浮游生态学研究的基础,传统形态鉴定方法无法满足现代海洋生态管理与保护自动化、标准化的数据需求,ZOOSCAN图像识别[4]和DNA条形码技术[5]等新技术的出现,极大推动了浮游动物分类学、生态学及相关领域的研究进展。
为加强海洋生态监测和强化海洋生态管理,我国自2003年开始组织建立海洋生态监控区并实施业务化监测,目前已经在我国近岸海域生态脆弱区和敏感区建立了21个生态监控区。海洋生物多样性是生态监控区业务化监测的重要内容,其目的是掌握海洋生物种类和数量的分布及变化趋势,监测对象包括浮游植物、浮游动物、底栖生物和游泳动物等[6]。浮游动物类群具有多样性高的特点,传统基于形态学的显微计数法对鉴定人员的专业技能要求较高,并且不同鉴定人员的结果可比性较差,导致不同年际间的结果也缺乏可比性,这些缺陷导致基于形态学的鉴定方法难以满足业务化监测的需求,因此,急需开发自动化、标准化的浮游动物种类鉴定技术[5,7]。此外,在海洋浮游动物中,隐存种广泛存在,形态鉴定导致种类多样性被低估[8]。随着高通量测序技术的发展和浮游动物DNA条形码数据库的不断扩充,分子鉴定为浮游动物种类鉴定及多样性的评估提供了机遇,基于高通量测序的宏DNA条形码技术为浮游生物物种、种群和群落的分子生态鉴定和生态监测提供了契机[9- 12]。在业务监测领域,分子鉴定技术在欧洲水框架指令(European Water Framework Directive)已经成为生物种类形态鉴定的有益补充,甚至在未来有望取代形态鉴定[13]。我国海域辽阔,跨越温带、亚热带和热带三个气候带,生物多样性丰富,我国海洋生物多样性监测急需准确和高效的技术方法。
自2003年Hebert等[14]提出DNA条形码技术以来,DNA条形码技术和数据库不断完善,目前生命条形码联盟(The Consortium for the Barcode of Life,CBOL)已经拥有来自40多个国家的120多个成员组织,生命条形码数据系统(The Barcode of Life Data System,BOLD)已经收录DNA条形码序列超过600万条。选择合适的DNA条形码是开展分子种类鉴定的基础,需要满足合适的变异速率、足够的分辨率、保守的通用引物等条件[15]。在浮游动物DNA条形码研究中应用较多的标记包括核糖体大亚基(Ribosomal Large Subunit, LSU)、核糖体小亚基(Ribosomal Small Subunit, SSU)和线粒体细胞色素氧化酶亚基I(Cytochrome Oxidase Subunit I, COI)等[9],不同条形码在实际应用中各有优缺点。SSU因具有较快的进化速率且易于设计出覆盖较广物种类别的通用引物而广泛应用于基于宏条形码水生生物多样性的研究中[16- 19]。
本研究在鸭绿江口海域采集了22份浮游动物样品,分别利用宏条形码鉴定方法和形态鉴定方法分析浮游动物群落组成,并通过比较两种方法得出的多样性指数来评价基于高通量测序的宏条形码分子鉴定方法在我国海洋生物多样性业务化监测中的应用潜力。
1 试验方法
1.1 样品采集
2017年8月沿鸭绿江入海口在中国海域布设22个浮游动物站位(图1)进行采样。使用浅水II型浮游生物网(网目孔径0.160 mm,网口内径31.6 cm,网长140 cm),依据《海洋监测规范》(GB 17378.7—2007)采集浮游动物样品。每个站位采集的样品进行充分混匀后均分成两份:一份用5%甲醛固定用于形态学鉴定,另一份用同孔径筛绢过滤掉海水后,加入无水乙醇固定用于分子鉴定。
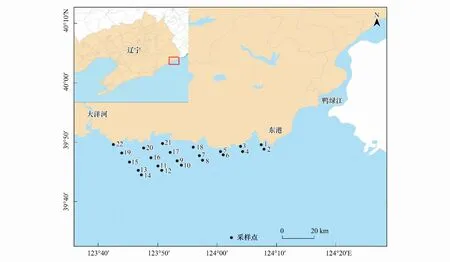
图1 鸭绿江口海域浮游动物样品采集点Fig.1 Sampling sites along the coastal regions of Yalvjiang Estuary
1.2 种类鉴定
形态鉴定:在体视显微镜下对浮游动物样品进行分类鉴定和计数。
分子鉴定:分别从每份酒精(总体积100 mL)保存的样品中分三次吸取浮游动物样品,每次吸取10 mL,三次吸取的浮游动物样品合并在一起,并用20 μm的筛绢过滤,除去酒精及残留的浮游藻类等。采用DNA血液及组织提取试剂盒(Qiagen Canada lnc., ON, Canada)提取浮游动物基因组DNA,提取的DNA采用NanoDrop 2000(Thermo Scientific lnc., USA)进行质量评价。利用浮游动物通用引物(Uni18S:AGGGCAAKYCTGGTGCCAGC; Uni18SR:GRCGGTATCTRATCGYCTT)扩增核糖体小亚基的V4区[20],此引物已证实可以成功扩增几乎所有的浮游动物类别[21]。为了将22份浮游动物样品进行混合测序,我们对每份样品聚合酶链式扩增(Polymerase Chain Reaction, PCR)的引物添加8碱基的条形码,同时也便于后续数据的拆分。PCR反应体系如下(25 μL):1×Ex Taq Buffer(20 mmol/L Mg2+plus, TaKaRa, 大连,中国),5.0 mmol/L dNTP,15 pmol含barcodes的引物,100 ng 基因组DNA;PCR反应程序为95℃ 5min,35个PCR循环(95℃ 30s,50℃ 45s,72℃ 30s),72℃ 7min的延伸;为了保证取样的均一性,每个样品进行8次PCR重复。扩增产物经电泳质检后用Qiagen PCR production purification kit进行PCR产物的纯化,纯化的DNA经NanoDrop 2000定量后进行样品间的等量混合。构建好的文库于Miseq PE300进行测序。
高通量测序下机数据用fastaq_strip_barcode.relablel2.py脚本进行数据的拆分并去除非生物学序列,如测序接头、样品标签序列及引物。利用USEARCH V8.1对拆分的数据进行长度的修剪、质量过滤、操作分类单元(Operational Taxonomic Units, OTUs)聚类等处理。因源于Miseq PE300的序列右端的测序质量急剧下降,尤其是最后20 bp,故将所有数据右端的20 bp删除,以提高序列的整体质量。质量过滤采用USEARCH V8.1推荐的方法,将期望误差阈值设为1.0。采用97%的阈值进行OTUs的聚类。除此之外,在后续的数据分析中,我们采用不删除OTUs单体、二体及三体的方式,因为这些物种可能是真实存在的物种,只是以低丰度的形式存在[20]。采用SEED V1.46[22]软件对聚类出OTUs比对到美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)中的非冗余蛋白质序列数据库(Non-Redundant Protein Sequence Database, NR)中进行物种的注释。比对的结果只保留序列的覆盖度大于85%、相似度大于90%的注释结果[20]。
1.3 统计分析
为便于宏条形码鉴定方法与形态学方法的比较,我们选取海洋浮游动物中丰度较高的桡足亚纲(Copepoda)进行分析。采用PRIMER 6.0[23]计算形态学及分子鉴定物种的多样性指数,包括物种丰度(Species richness)和香浓维纳多样性指数(Shannon Winner diversity index)。采用SPSS 18.0并应用Pearson相关系数对两种方法多样性指数进行相关性分析。
2 结果
图2 鸭绿江口22个浮游动物样品高通量测序稀疏曲线 Fig.2 Rarefaction plots of 22 zooplankton samples based on metabarcoding methodsOTUs:操作分类单元 Operational Taxonomic Units
高通量测序总计产出291.6万条序列,每个采样点得到的序列数在7.3万至27.0万之间,平均为13.3万条,数据已上传到NCBI (SRA accession: PRJNA490610)。经去除重复序列、OTUs聚类等步骤,共获得1957个OTUs。序列数与物种数(OTUs)关系的稀疏曲线(图2)显示:随着序列数的急剧升高,物种数增加的速度逐渐变慢,表明各采样点的测序量足够覆盖大部分的种类。将获得的OTUs与NR进行比对,成功注释1502个,其中229个OTUs被注释为浮游桡足亚纲(Copepoda),隶属于4目、23科、32属(表1)。共鉴定浮游桡足类1069394条序列,其中哲水蚤目(Calanoida)包含12属(57.628%),剑水蚤目(Cyclopoida)包含6属(36.359%),鞘口水蚤目(Poecilostomatoida)包含12属(5.406%),管口虱目(Siphonostomatoida)包含2属(0.607%);并且样点内哲水蚤目和鞘口水蚤目相对丰度沿采样点1至12逐渐升高,而剑水蚤目和管口虱目相对丰度沿采样点1至12逐渐下降(图3)。在这些属中,丰度最高的种类分别为拟哲水蚤属(Paracalanus)和长腹剑水蚤属(Oithona),且样点内拟哲水蚤属(Paracalanus)的相对丰度沿采样点1至22逐渐升高,而长腹剑水蚤属(Oithona)具有逐渐降低的趋势(图4)。
基于形态学特征,共鉴定出桡足纲3目、5科、5属、6种(表1;图5;图6)。哲水蚤目(Calanoida)包含4属(66.67%),剑水蚤目(Cyclopoida)和鞘口水蚤目(Poecilostomatoida)各包含1属(16.67%);且哲水蚤目(Calanoida)的相对丰度沿采样点1至12逐渐降低,而鞘口水蚤目(Poecilostomatoida)逐渐升高(图5)。其中丰度最高的物种是拟哲水蚤属(Paracalanus),在大部分采样点拟哲水蚤属(Paracalanus)所占的比例均较高,少部分采样点(7和8)长腹剑水蚤属(Oithona)所占的比例较高(图6);并且拟哲水蚤属(Paracalanus)的相对丰度沿采样点1至12逐渐降低,而属于鞘口水蚤目(Poecilostomatoida)的剑水蚤属(Corycaeus)相对丰度逐渐升高(图6)。
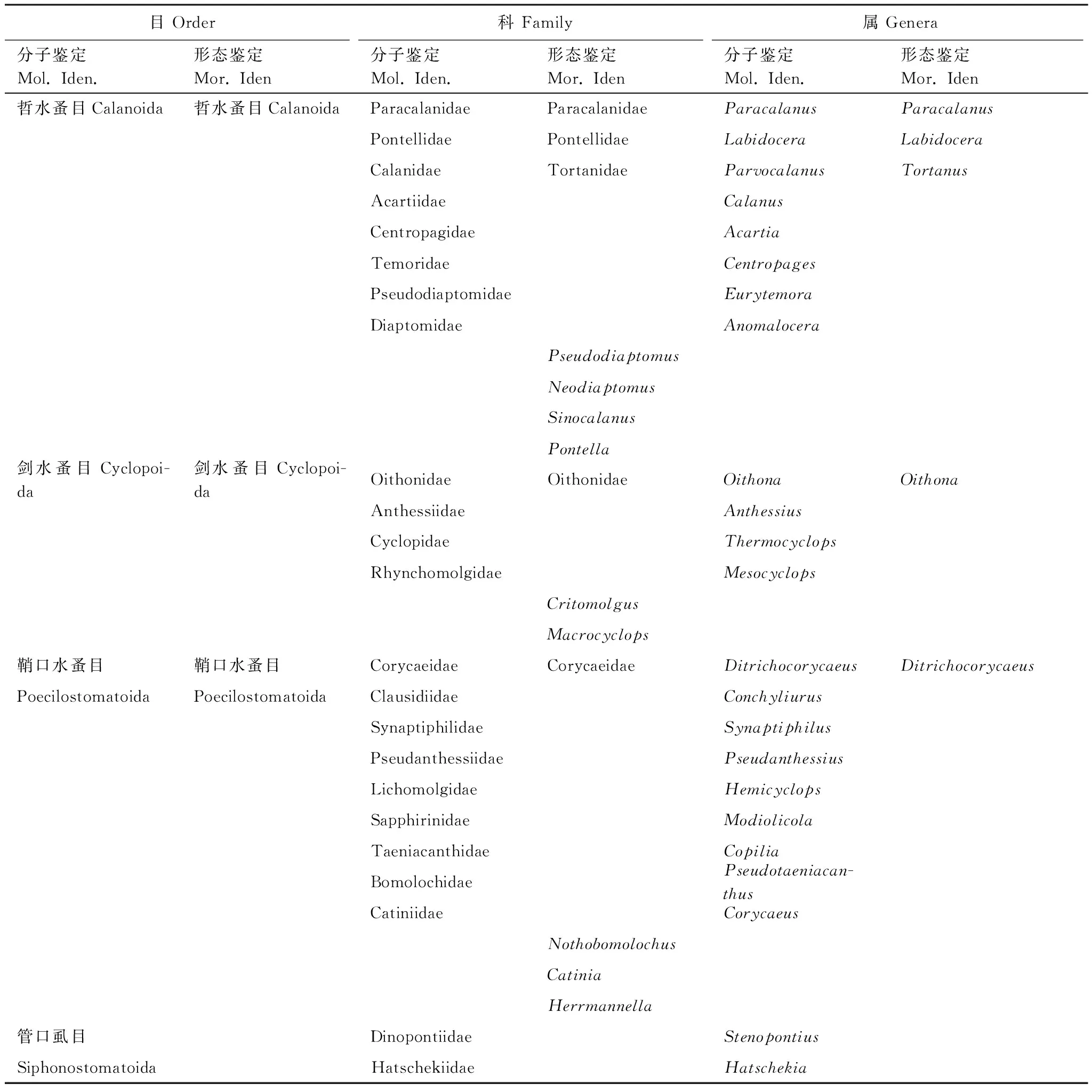
表1 基于宏条形码分子鉴定和形态学鉴定的浮游桡足类
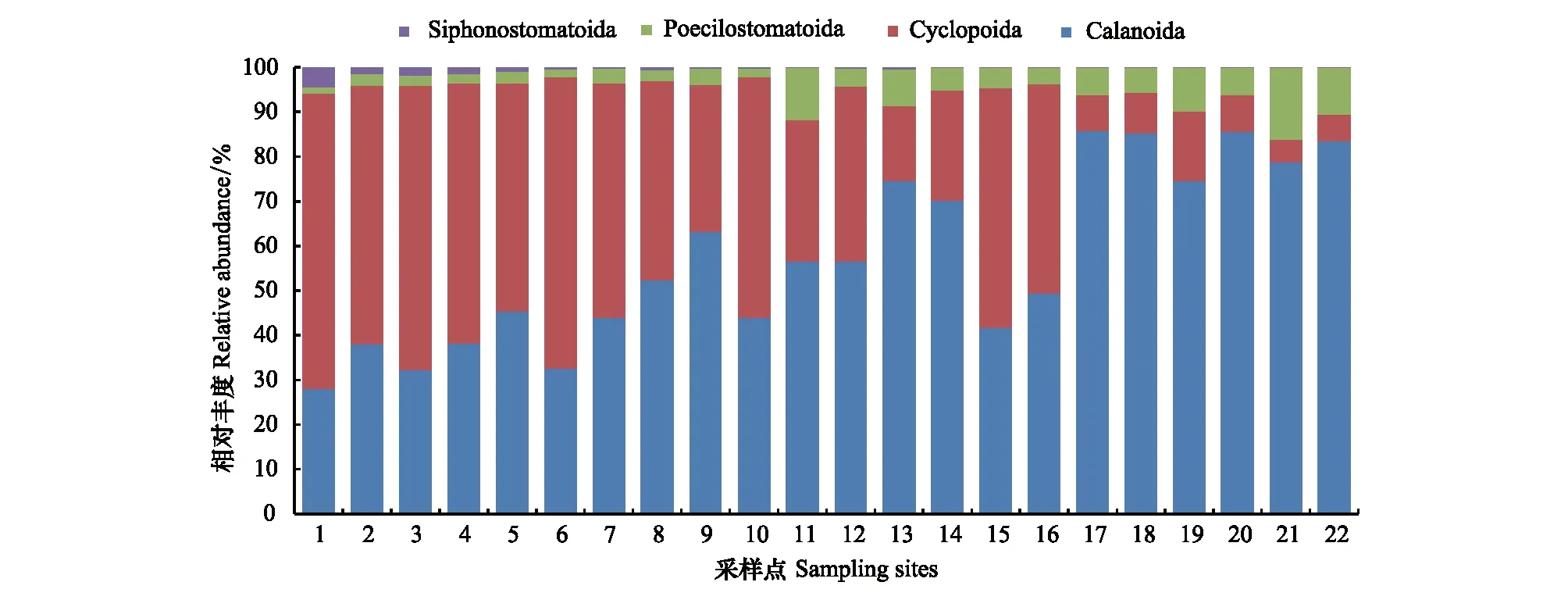
图3 在目水平分子鉴定物种相对丰度Fig.3 Histogram of relative abundance for each sampling site based on metabarcoding method at the order level
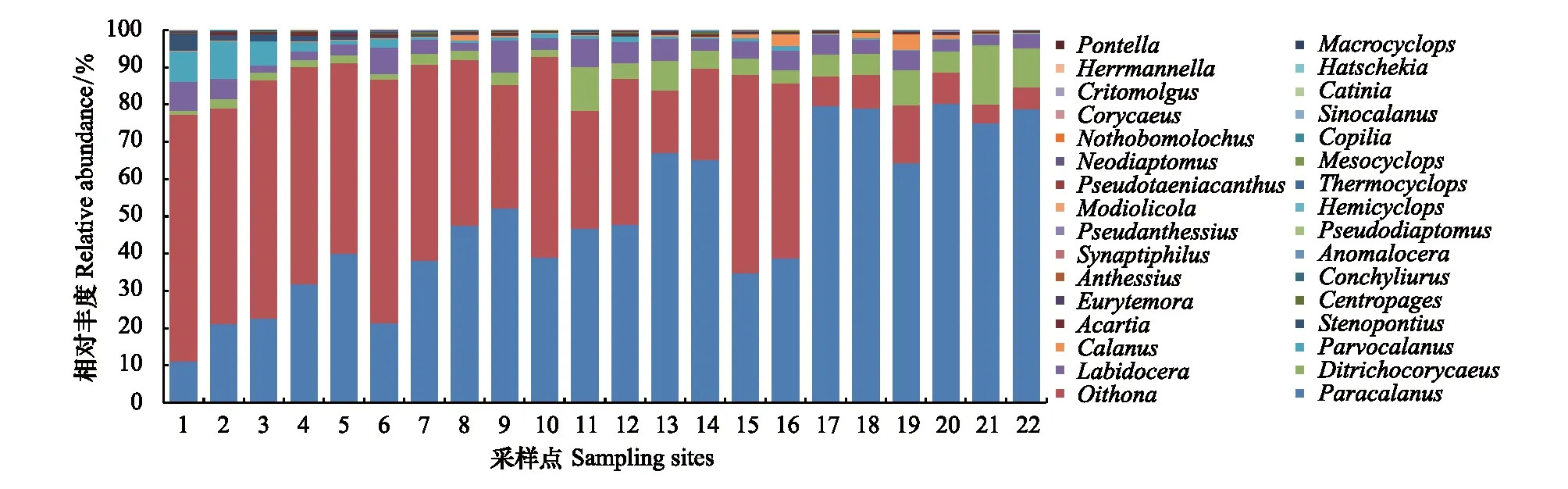
图4 在属水平分子鉴定物种相对丰度Fig.4 Histogram of relative abundance for each sampling site based on metabarcoding method at the genera level
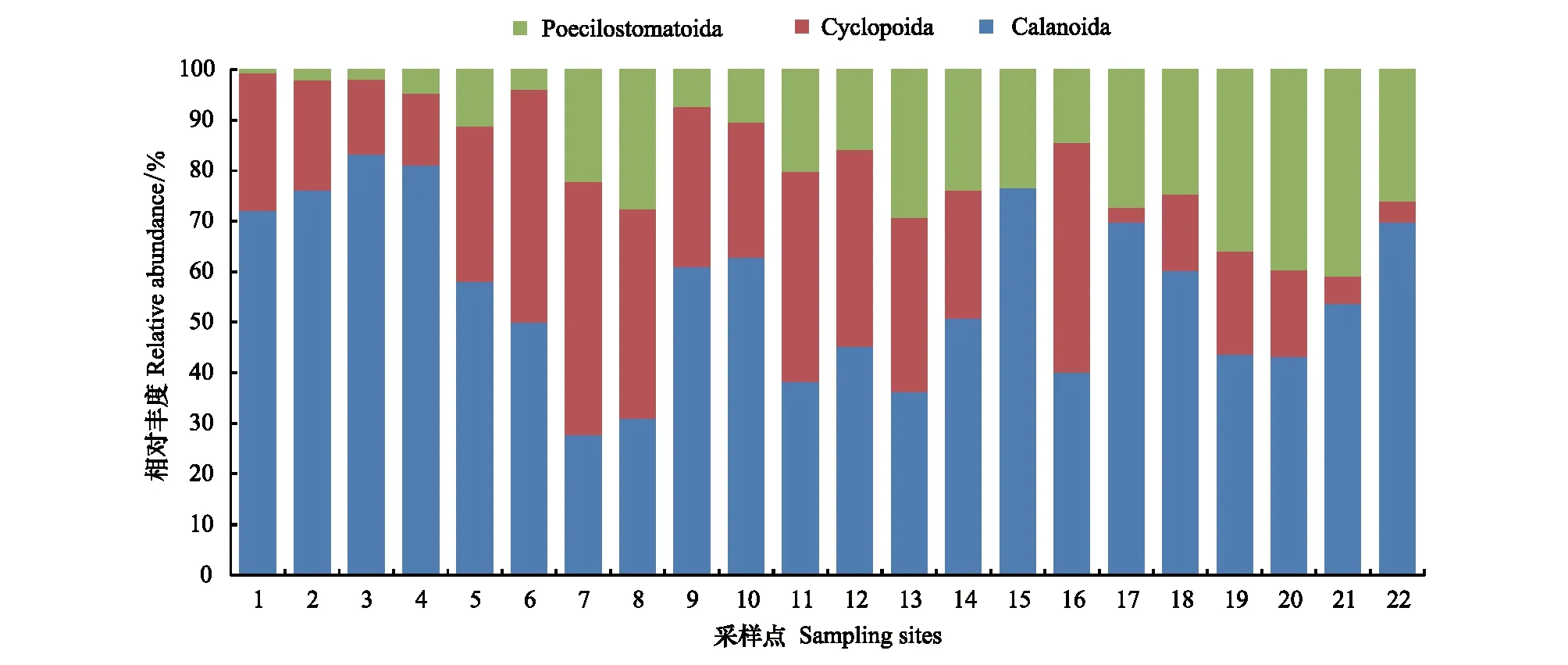
图5 在目水平形态鉴定物种相对丰度Fig.5 Histogram of relative abundance for each sampling site based on morphological method at the order level
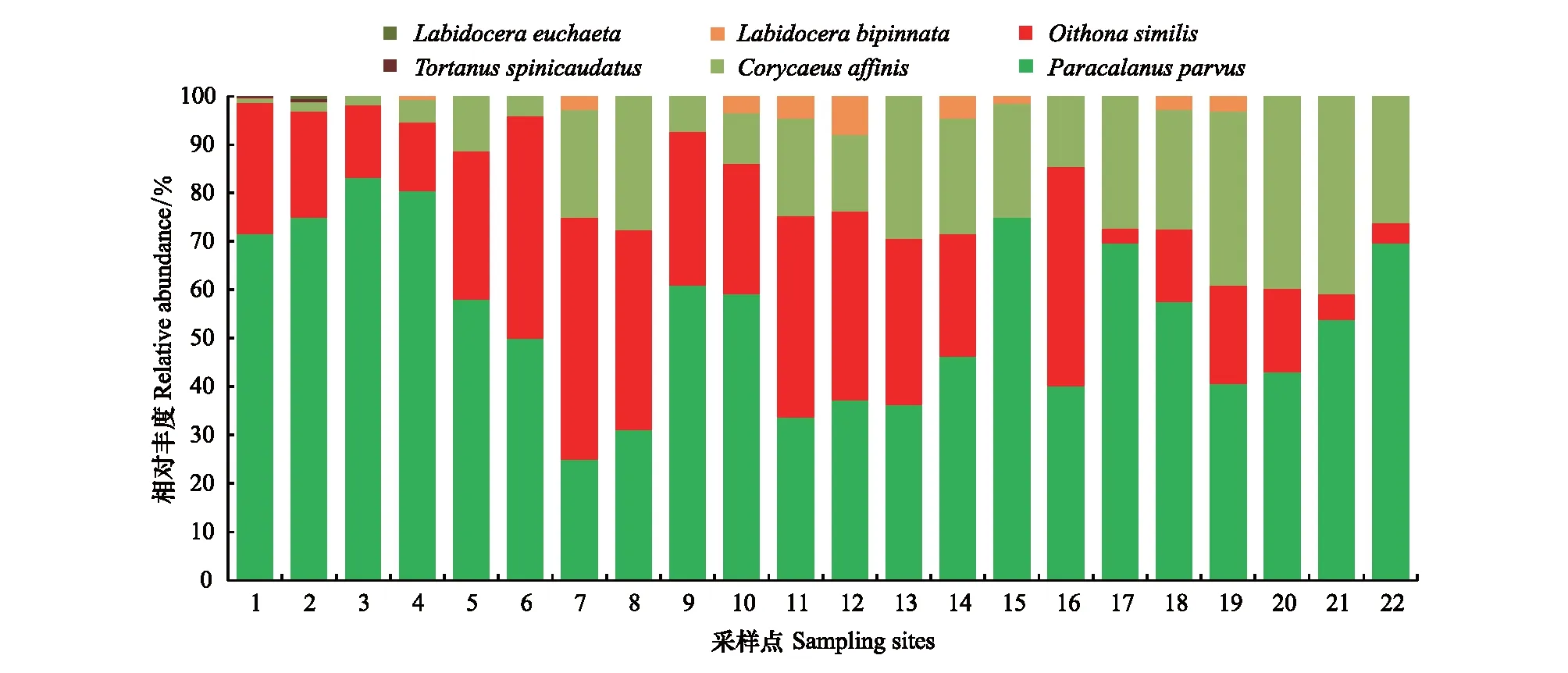
图6 在种水平形态鉴定物种相对丰度Fig.6 Histogram of relative abundance for each sampling site based on morphological method at the species level
基于高通量测序的宏条形码分子鉴定方法每个采样点平均鉴定出19个属,样点间的属数变异为15—22,而基于形态学方法每个采样点平均鉴定出4个属,样点间的属数变异为3—5(表2)。利用形态学方法鉴定出来的大部分类别(目:100%、科:80%、属:80%)同时能用分子方法鉴定出来,而分子方法鉴定出的大部分类别(目:25%、科:83%、属:88%)却不能用形态学方法鉴定出来(表1)。对于物种多样性指数,基于分子鉴定的物种丰度指数均高于基于形态学特征鉴定的结果(图7,表2)。同时,基于分子方法鉴定的平均香浓维纳指数(1.52±0.23)也高于基于形态学鉴定的结果(1.32±0.32)(表2)。对于大部分采样点,基于分子方法鉴定的香浓维纳指数与基于形态学方法鉴定得出的香浓维纳指数差异较小,只有在较少的采样点(1、2、3、4及15)中发现两种方法鉴定的结果存在较大的差异(图8)。
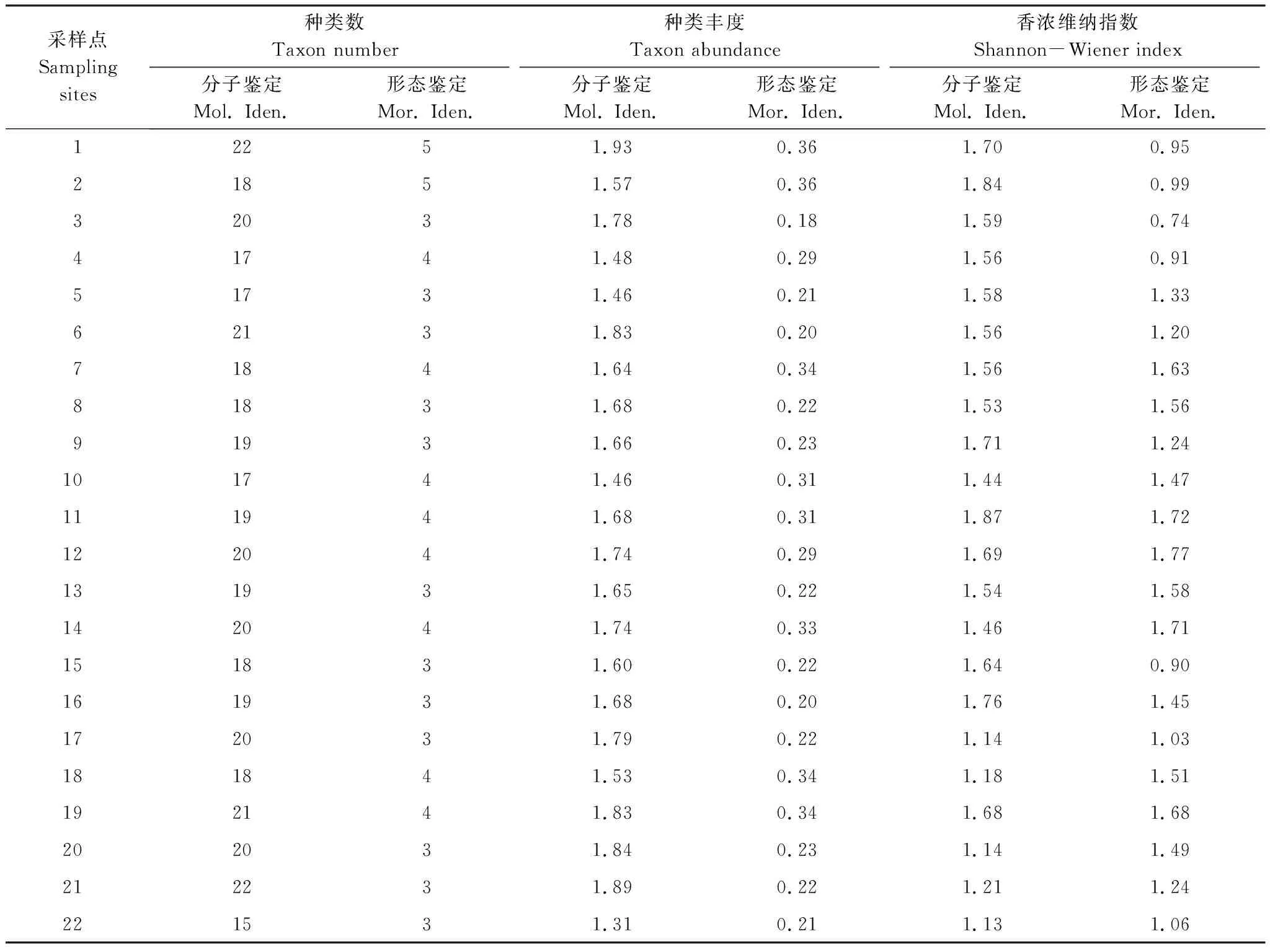
表2 基于宏条形码分子鉴定和形态学鉴定浮游桡足类在属水平的多样性指数
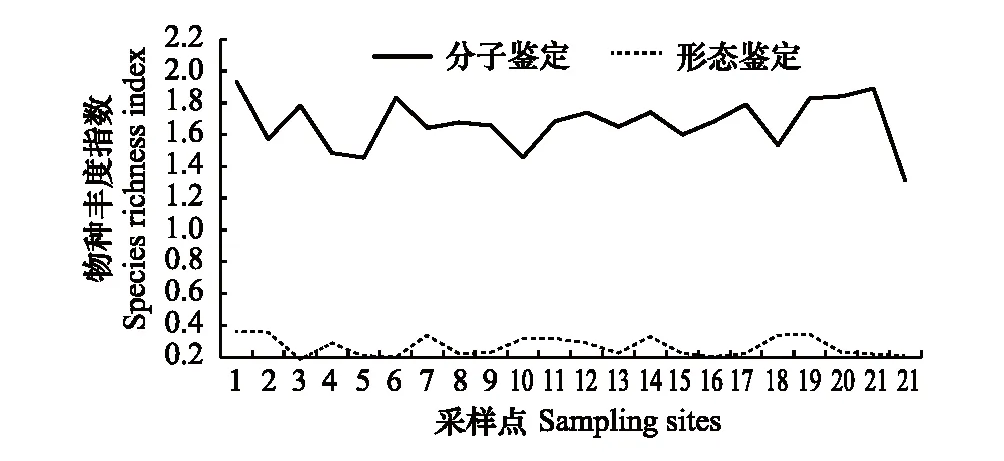
图7 分子和形态鉴定结果的物种丰度比较 Fig.7 Variation of species richness index along the sampling sites based on both metabarcoding and morphological methods

图8 分子鉴定和形态鉴定结果的香浓维纳指数比较 Fig.8 Variation of Shannon-Wiener index along the sampling sites based on metabarcoding and morphological methods
而在一致性方面,对于所有采样点,基于分子鉴定与基于形态鉴定得出的多样性指数没有显著的一致性(r=0.080,P=0.723,图9)。但当排除香浓维纳指数差异较大的少量采样点(1、2、3、4及15,22.73%),只关注差异较小的多数样点(77.27%)时,基于分子与基于形态的香浓维纳指数呈现显著的一致性(r=0.542,P=0.024,图10)。

图9 基于所有采样点分子鉴定与形态鉴定的香浓维纳指数相关性Fig.9 Correlation of Shannon-Wiener index between metabarcoding and morphological methods for all sampling sites
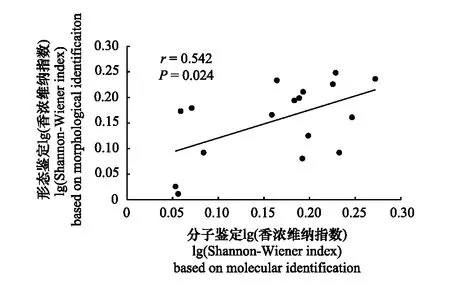
图10 基于大部分采样点(77.28%)分子鉴定与形态鉴定的香浓维纳指数相关性Fig.10 Correlation of Shannon-Wiener diversity index between metabarcoding and morphological methods for most sampling sites (77.28%)
3 讨论
DNA宏条形码技术基于标准化DNA序列进行PCR扩增、高通量测序和比对,可以实现不同物种的批量鉴定。伴随着高通量测序技术的发展和DNA条形码数据库的扩充,宏DNA条形码可以同时完成批量样品中批量物种的分子种类鉴定,从而实现全面、快速评估群落种类组成和物种多样性的目的。利用DNA宏条形码进行种类鉴定需要选择合适的标准序列和相应的通用引物,标准序列需要具备足够的种间DNA变异,通用引物需要实现不同类群的高效扩增。由于DNA条形码在不同类群的分辨率和通用性不同,目前尚未找到适用于所有分类阶元的通用引物。海洋浮游动物DNA条形码研究常用的标准序列包括LSU、SSU和COI等[12]。虽然COI具有较高的物种分辨率,但因其物种间具有较大的序列变异,导致无法在较广的分类单元上设计出通用引物,这限制了其在宏条形码分子鉴定中的应用。尽管SSU物种分辨率不及COI,但可以设计出通用性较好的引物,可较好地用于物种多样性的评价。本文选取的Uni18S-Uni18SR[20]已广泛应用于海洋及淡水生物多样性的评价中[24-25]。虽然此引物并不能将所有物种鉴定到种的水平,但对大部分种类而言鉴定到科及属水平具有较高可信度[20-21]。利用此引物进行宏条形码的测定及分析鉴定出了大量的物种类别,宏条形码分子方法鉴定出的物种丰度明显高于形态学鉴定出的物种丰度:基于分子鉴定出的桡足类的类别在科及属水平上明显多于形态学鉴定,发现了基于形态学特征无法鉴定出的管口水蚤目,且鉴定出了基于形态学特征无法分类的幼虫期桡足类。此结果与国外在浮游动物、底栖生物及浮游藻类的研究结果一致[26-28]。这些发现表明基于高通量测序的分子鉴定方法可揭示出传统基于形态学特征鉴定方法无法揭示出的物种多样性。
本研究中,虽然对于小部分采样点(22.73%),基于分子的多样性指数高于形态鉴定出的多样性指数;但对于大部分采样点(77.27%),基于分子的多样性指数均低于形态鉴定出的多样性指数,并且变化趋势呈现显著的一致性(r=0.542,P=0.024)。国外的研究中也普遍发现类似的结果[29-30]。Lejzerowicz等[30]在苏格兰的利斯莫尔岛海域采集了10个样品,通过比较基于宏条形码和形态学鉴定的结果发现,基于两种方法得出的生物评价指数(Infaunal Trophic Index 和AZTI Marine Biotic Index)具有较高的一致性(P< 0.01)。这些结果表明在海洋浮游动物多样性评价中,分子鉴定的结果与形态鉴定的结果具有较好的可比性。
与形态学鉴定方法相比,分子鉴定除了具有省时、省力、不需要专业的形态学鉴定人员等优点外[12,18, 30-31],还具有能鉴定出光学显微镜下难以发现的物种的优点,致使鉴定出的种类丰度明显高于形态学鉴定出的结果。本研究中利用形态鉴定得到的分类阶元多数(目:100%、科:80%、属:80%)能用宏条形码方法鉴定出来,而分子方法鉴定得到的分类阶元多数(目:25%、科:83%、属:88%)却未能用形态鉴定出来基于宏条形码方法得出,此结果进一步证实了这个观点的正确性。且宏条形码鉴定方法已在国外的海洋生物多样性评价中得到了广泛的应用[16- 18],在我国海洋浮游动物多样性评价中具有较高的应用潜力。
在海洋浮游动物多样性评价所需成本方面,我们估算了鉴定每份浮游动物样本所需的时间成本和经济成本(表3),根据国家海洋局印发的《海域使用论证收费标准(试行)》,对于浮游动物的鉴定,每个站位的样品(包含I型网和II型网两份样品)鉴定需要花费1500元,每个样品的鉴定费用也将约在750元。而利用宏条形码分子鉴定,一个站位的花费仅为103—203元(建库费用60元+Miseq测序费用135元/Hiseq测序费用35元+分析费用8元),约是采用形态学方法所需花费的1/13—1/27之间。而随着测序成本的不断降低及形态学鉴定所需人工成本的不断增加,这种差距还将持续增加。根据我国海洋监测机构反映,完成1个浮游动物样品物种鉴定及多样性分析的时间为1.5—3个小时,而利用宏条形码技术完成22份浮游动物样品分析总共需要一个普通环境监测人员20个小时(8个小时建库+12小时数据分析),平均每份样品花费约1小时。从时间成本考虑,利用宏条形码技术所需的时间仅为形态学鉴定的1/3—1/2,表明利用宏条形码技术极大地提高了浮游动物分析工作的效率。

表3 基于宏条形码和形态学鉴定方法的每份浮游动物样本所需金钱成本与时间成本
目前DNA宏条形码鉴定技术在我国海洋浮游动物业务化监测应用,仍有几个方面有待于提升。首先,同一个种的不同地理种群会因遗传漂变、建群者效应及自然选择等进化生态学过程发生遗传分化[32-34],尤其在较大的地理尺度上如大洋、区域甚至国家之间[35]。如果遗传分化发生在宏条形码所选择的引物区间,欧美国家所构建的参考数据库可能就会不适用于我国。所以,宏条形码鉴定方法可靠的前提是建立我国甚至我国特定海域的条形码数据库。其次,本研究中,对于浮游动物类群,之所以一部分形态学鉴定出的种类没有被宏条形码方法鉴定出,可能是因为数据库中没有对应的物种序列,也有可能是因为本研究中所采用的宏条形码引物序列并不能与这些物种的相应的序列很好的匹配。所以,在今后的研究工作中应根据我国海域浮游动物条形码的序列特征,对现有的宏条形码引物进行改进或者重新设计适应于我国海域浮游动物分子特征的引物,以提高宏条形码方法鉴定物种类别的覆盖度,另外,构建本地化DNA条形码数据库也是开展基于DNA条形码浮游动物种类业务化监测的必要条件。最后,在PCR扩增及高通量测序过程均会产生假阳性及假阴性的错误,虽然PCRfree建库策略能有效减少假阳性的错误[21],但在高通量测序过程中容易丢失丰度较低的物种而引起假阴性,在未来的生物信息学领域,通过改进现有软件或开发新软件有望降低这些过程所引起的错误。
现阶段,形态学鉴定方法是我国海洋浮游生物多样性监测的主要手段。因其在生物多样性评价中存在许多方面的缺陷,尤其比较耗时费力,致使很难在短期内完成大尺度多样品的多样性评价工作。而基于高通量测序的宏条形码方法提供了可供选择的海洋浮游生物多样性快速评价方法。虽然宏条形码技术具有其固有缺陷,如不能反映生物的生长阶段,无法准确对浮游生物进行准确定量等。但因其具有鉴定效率高、花费较低等优点使其有望在未来成为一种互补甚至替代现有评价方法的技术体系。随着宏条形码技术体系的不断完善,我国有可能在海洋浮游生物多样性评价方法方面打破既有的体系,形成新的技术体系及规范。
