内生细菌对盐胁迫下小麦幼苗脯氨酸和丙二醛的影响
2020-07-17徐亚军赵龙飞邢鸿福罗云霄魏正欣
徐亚军,赵龙飞,2,*,邢鸿福,罗云霄,魏正欣
1 商丘师范学院生物与食品学院, 商丘 476000 2 河南省特色微生物资源开发与应用工程研究中心, 商丘 476000
小麦是我国盐碱地主要农作物之一,在幼苗时期易受到盐碱毒害,减弱其抵抗逆境的能力[1],导致产量下降。近年来,越来越重视对小麦抗盐机理的研究。刘晓华等[2]采用转基因技术将TaCHP基因插入小麦品种“济南17”和“济麦22”基因中,以NaCl模拟盐胁迫环境培植小麦,转基因小麦与对照组相比其体内Pro含量上升、MDA含量降低,TaCHP基因能提高小麦抗盐性。李金亭等[3]采用外源H2O2处理“郑麦- 004”盐胁迫下幼苗,提高了小麦耐盐性;郭伟和王庆祥[4]利用腐植酸浸种提高了小麦幼苗抗盐碱能力。Safdarian等[5]在盐胁迫环境下接种小麦硝基愈疮木胶节杆菌(Arthrobacternitroguajacolicus)比较转录组分析,结果表明有152个基因上调,在接种小麦根部苯丙烷、黄酮类、萜类、卟啉、叶绿素代谢、芪类化合物、双苯庚烷代谢途径呈现差异性表达,并检测到编码次生代谢物基因,参与细胞木质素和抗氧化物的生物合成,促进生长并提高了小麦耐盐性。前人通过物理方法、化学方法、耕作控制、遗传育种等措施和途径[6]在一定程度上提高小麦耐盐能力,但这些方法仍存在很多不足,如成本高、不安全、周期长等。目前,运用生物方法[7]探索小麦耐盐机制及提高小麦抗盐能力已成为研究的热点。
植物内生菌指一定阶段或全部阶段定殖于健康植物组织及器官内,对植物不产生实质性危害并与植物形成互惠互利关系的一类微生物类群[8],可增强植物抗病、抗盐碱、抗重金属等抗逆能力[9-10]。Zhao等[11]研究表明大豆根瘤内生菌对大豆疫霉菌具有拮抗作用和促进宿主生长的作用,Fan等[12]表明对分离自豆科植物苜蓿根瘤的内生细菌SinorhizobiummelilotiCCNWSX0020,采用重金属吸附和富集法、电镜扫描和能谱分析法、傅里叶变换红外光谱分析法等表明,内生菌可通过与植物联合作用、转化重金属形态、协同与共生作用等来减小重金属对植物毒害及促进植物对重金属分解。此外,许多有益内生细菌能提高宿主植物在高盐环境下的存活率[13],Sapre等[7]分离自小麦根际的耐盐促生长菌株IG3,接种燕麦在100 mmol/L的NaCl盐浓度胁迫下可提高其耐盐性,盐胁迫下接种组和未接种组相比,茎长、根长、茎干物质、根干物质及相对含水量都明显提高,而脯氨酸、电解质渗出率、丙二醛、抗氧化酶活性均出现降低,明显提升燕麦在盐胁迫下的耐盐性和促进植株生长。而大豆根瘤内生细菌在豆科植物根系具有促进植物生长[14- 15]、提高植物抗逆性、增强植物抗病能力等[16]功能。赵龙飞等[17]对大豆根瘤内生细菌溶磷性研究发现溶磷菌能促进大豆生长;刘杰等[18]报道了豆科植物根瘤内生细菌的研究现状及功能。在长期系统进化过程中,内生细菌与植物形成一种特殊的互惠互利关系[19],其在促进农业生产和研发生物农药方面具有较大潜力,是修复盐胁迫作用的重要微生物资源[20]。目前,根瘤内生细菌不仅能与豆科植物形成共生固氮体系,在适宜条件下还可与玉米、水稻、小麦等非豆科草本植物形成联合内生作用,增强作物自身抗逆性,促进作物健康生长,减轻环境污染,降低种植成本,同时也可缓解土壤盐渍化程度[21]。本课题组前期大豆根瘤内生细菌人工气候室接种小麦幼苗试验结果[22]表明,可改善盐胁迫环境下小麦幼苗生长及促进小麦植株生长。但是目前国内有关内生细菌对盐胁迫下小麦幼苗生长影响研究仍较为少见。基于此,本试验拟选用周麦18为试验材料,大豆根瘤内生细菌为研究菌株,检测小麦体内Pro和MDA含量变化,探讨接种大豆根瘤内生细菌对不同盐浓度胁迫下小麦幼苗生长的影响,以期为提高小麦耐盐性提供理论基础。
1 材料与方法
1.1 材料
小麦品种:周麦18(周口市农业科学院殷贵鸿博士馈赠);根瘤内生细菌252和254分离自课题组(U1204301)在2012年7—8月采集自河南省周口市西华县址坊镇吴店村大豆根瘤样品,对获得的内生细菌进行分离纯化、筛选、镜检,斜面短期保藏于4℃冰箱。
1.2 内生菌的活化和菌悬液制备
将菌株252和254接种至牛肉膏蛋白胨琼脂培养基[23]斜面上,置于30℃恒温培养3d。将内生菌接种在LB液体培养基,置于130 r/min 30℃震荡培养3 d,10000 r/min离心10 min,收集菌体并使用无菌水稀释制成菌悬液,调整OD600值≈1,4℃低温保存备用。
1.3 内生细菌16S rDNA测序及系统发育分析
采用CTAB法提取内生细菌基因组DNA,以此为模板进行16S rDNA扩增[24],所用引物、扩增体系、反应条件见文献[17],扩增产物送北京奥科鼎盛生物科技有限公司测序,根据测序结果,获得序列提交GenBank。使用ClustalX 1.81软件进行序列比对,采用Bioedit 4.8.4软件进行手工纠正,使用TRENCONW软件以Neighbor-Joining方法构建系统发育树,用Bootstrap重复1000次进行可信度评估,用DNAMAN 6.0软件进行序列相似性分析。
1.4 小麦种子处理和接种培养
试验于2013年7月—2015年8月在实验室及人工气候室内进行。挑选籽粒饱满、完整有胚、无霉变的种子,用无水乙醇浸泡15—20 s,置入3%—5%NaClO溶液消毒3—5 min,再用无菌水冲洗5—8次。用无菌水、252和254菌悬液分别浸泡小麦种子,置于恒温培养箱中培养。待小麦种子露白后播于装有灭菌蛭石的花盆中,每盆60粒,置于人工气候箱中(白天28℃14 h,晚上22℃10 h)培养。试验共设置6个处理,3个重复,依据前期试验[22],盐胁迫浓度设置为0、50、100、150、200、250 mmol/L。第1天,CK中加30 mL无菌水,盐胁迫组、菌悬液组各加30 mL盐溶液;第2天,CK、盐胁迫组各加30 mL无菌水,菌悬液组接30 mL菌悬液;第3天,CK、盐胁迫组、菌悬液组分别加30 mL无菌水,以此3d为一个循环。
1.5 小麦脯氨酸含量测定
采用磺基水杨酸比色法[25]。待小麦幼苗长至第7、14、21天分别剪取小麦叶片,加入3%磺基水杨酸提取,水浴10 min,以3000 r/min离心10 min。每个试管中加入上清,对照用蒸馏水代替,再向试管中加入3%磺基水杨酸、冰醋酸和2.5%酸性茚三酮,水浴显色1 h,加入甲苯漩涡震荡,提取上清液中Pro,静置分层取甲苯相,测定OD520值。绘制标准曲线,计算Pro含量。
1.6 丙二醛含量测定
采用硫代巴比妥酸比色法[25]。待小麦幼苗长至第7、14、21天分别采样,称取小麦叶片,加入石英砂和10%三氯乙酸磨成匀浆状,加入三氯乙酸充分研磨,4000 r/min离心10 min,上清液为样品提取液。取出提取液放于试管中,对照用蒸馏水代替,加入0.6% TBA溶液混合均匀,水浴15 min,冷却后分别测定532 nm和450 nm波长下OD值,计算出MDA含量。
1.7 数据处理
利用SPSS 19. 0软件对数据进行统计分析。采用双因素随机方差分析(two-way ANOVA)和最小显著差数法(LSD)分析不同盐浓度下接种内生细菌对Pro、MDA含量的影响,显著性水平设定为α=0.05。
2 结果与分析
2.1 菌株16S rDNA序列测定及系统发育地位
2株菌16S rDNA 序列片段大小均为1500 bp,获得序列号分别为KJ499776和KJ499777。在NCBI数据库中检索相似性高的模式株和参比菌株,构建系统发育树(图1)和进行序列相似性分析。系统发育树整体分为两个主分支和一个边缘支(EscherichiacoliU5/41T)。主分支分别为Bacillus和Agrobacterium,菌株252和模式菌株形成了分支I,其中菌株252与BacillusvallismortisDSM11031T(AB021198)位于同一系统发育分支,两者具有最大相似率,达99.6%。菌株254和模式菌株形成了分支II,其中菌株254和模式菌株AgrobacteriumtumefaciensIAM 12048T(AB247615)位于同一系统发育分支II,两者具有最大相似率,为99.7%。因此,菌株252最相似菌株为死谷芽孢杆菌(Bacillusvallismortis),菌株254最相似菌株为根癌土壤杆菌(Agrobacteriumtumefaciens)。

图1 基于内生细菌16S rDNA序列构建的系统发育树 Fig.1 Phylogenetic tree generated by the neighbor-joining method based on their 16S rDNA sequences of endophytic bacteria括号中的数值表示在GenBank中的序列号,自举值(1000次重复)大于50%的在分支上显示,被测试菌株用黑体标出,标尺表示0.05%的核苷酸替换
2.2 内生细菌252、254对小麦幼苗脯氨酸含量的影响
由图2可知,小麦生长7 d时,盐胁迫环境下,除盐浓度150 mmol/L和250 mmol/L时盐胁迫处理组Pro含量分别略低于对照组2.42%和4.14%以外,总体均高于对照组。在盐浓度200 mmol/L时,小麦幼苗体内Pro含量达到最高值,为44.04 μg/g,显著高于对照组33.67%。由此显示,盐胁迫处理下,NaCl对小麦幼苗具有一定抑制能力。经内生细菌252接菌处理后,该组Pro含量除在200 mmol/L盐浓度外均高于对照组,其中在盐浓度为100 mmol/L时,252接菌处理组Pro含量达到最高值,为40.37 μg/g,显著高于对照组22.53%,高于盐胁迫组19.14%。盐浓度为150 mmol/L时,252接菌处理组与盐胁迫组相比,Pro含量有最大程度升高,为39.12 μg/g,高于对照组18.73%,高于盐胁迫组21.68%。当盐浓度升至200 mmol/L时,252接菌处理组Pro含量为39.57 μg/g,高于对照组20.12%,但低于盐胁迫组10.14%,此浓度下盐胁迫组Pro含量仅次于最高值;在盐浓度250 mmol/L时Pro含量最低,为33.71 μg/g,比对照组高2.33%,比盐胁迫组高6.75%。总体趋势表明,除盐浓度200 mmol/L 时Pro含量低于盐胁迫组外,252接菌处理组同一盐浓度下Pro含量均高于对照组,其他情况下均明显高于盐胁迫组,说明大豆根瘤内生细菌252对盐胁迫小麦在一定程度上(盐浓度50、100、150、250 mmol/L)具有修复作用。
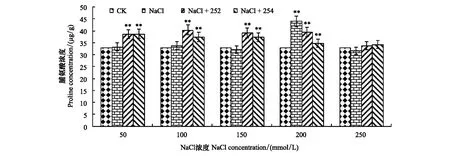
图2 接种内生细菌252、254小麦生长7d时植株脯氨酸含量Fig.2 Proline content of wheat seedings inoculated with endophytic bacterium 252,254 in the 7th day图中星号**表示显著差异,*表示存在差异
盐胁迫处理下,当盐浓度为200 mmol/L时,Pro含量为44.04 μg/g,显著高于其他盐胁迫组。在250 mmol/L时,盐胁迫组Pro含量最低,为31.58 μg/g,较200 mmol/L盐浓度下有大幅度下降。经内生细菌254处理后,在盐浓度50 mmol/L时,接菌254处理组对盐胁迫小麦修复作用最明显,Pro含量达到最高值,为38.72 μg/g,高于对照组17.53%,高于盐胁迫组16.32%。随着盐浓度升高,接种菌株254处理组与对照组相比,修复程度呈现下降趋势。当盐浓度升至250 mmol/L时,接菌处理组Pro含量最低,为34.25 μg/g,仅高于对照组3.9713%,高于盐胁迫组8.47%。当盐胁迫组在200 mmol/L盐浓度时Pro含量达到最高值情况下,接种菌株254处理组Pro含量明显低于盐胁迫组21.06%,说明此浓度下内生细菌254对盐胁迫小麦不具有修复作用。结果表明,在小麦幼苗生长第7天,内生细菌在一定盐浓度下(盐浓度50、100、150、250 mmol/L)对盐胁迫小麦具有明显修复作用。
由图3可知,生长14 d时,对照组Pro含量为70.86 μg/g,较7 d 时Pro含量(39.72 μg/g)有明显升高。盐胁迫组Pro含量除盐浓度为150 mmol/L时外总体均低于对照组,与7 d时情况相反。盐浓度为150 mmol/L时,盐胁迫组Pro含量升至最高,为119.50 μg/g,高于对照组83.63%。经接种内生菌252处理后,Pro含量均高于对照组,除盐浓度在150 mmol/L下Pro含量稍低于盐胁迫组6.55%外,其余盐浓度下接菌252处理组与盐胁迫组相比较,Pro含量均显著升高(P<0.05)。在盐浓度100 mmol/L时,接菌252处理组Pro含量最低,为99.73 μg/g,高于对照组90.23%,高于盐胁迫组73.46%。当盐浓度达到200 mmol/L时,252接菌处理组Pro含量高达140.54 μg/g,高于对照组98.33%,高于盐胁迫组133.48%。随着培养时间延长,对照组、盐胁迫组、252接菌处理组Pro含量均呈现上升趋势,且接菌252处理组在盐浓度200 mmol/L时明显高于盐胁迫组。结果表明,内生细菌252在一定盐浓度下(盐浓度50 mmol/L、100 mmol/L、200 mmol/L、250 mmol/L)对盐胁迫小麦具有显著修复作用。

图3 接种内生细菌252、254小麦生长14d时植株脯氨酸含量Fig.3 Proline content of wheat seedings inoculated with endophytic bacterium 252,254 in the 14th day
小麦幼苗生长14 d时,在盐浓度50、200、250 mmol/L下,接种菌株254处理组Pro含量均高于盐胁迫组,其中在250 mmol/L时Pro含量最高,为125.61 μg/g,比对照组高77.26%,比盐胁迫组高91.48%,修复作用最为显著。在盐浓度为50 mml/L和200 mmol/L时,接种254处理组Pro含量分别高于盐胁迫组27.43%和29.53%。盐浓度为100 mmol/L和150 mmol/L时,接种254处理组Pro含量均低于盐胁迫组。结果说明内生细菌254只有在特定盐浓度范围内(盐浓度50、200、250 mmol/L)对盐胁迫小麦才具有修复作用,且在高盐浓度为250 mmol/L时修复作用最明显。
由图4可知,培养21 d时,对照组Pro含量降至40.57 μg/g,盐胁迫组Pro含量均高于对照组,随着培养时间增长,盐胁迫组和接菌252处理组Pro含量均呈先升后降趋势,且盐胁迫组随盐浓度升高,Pro含量呈逐渐升高趋势。盐浓度为50 mmol/L时,盐胁迫组Pro含量最低,为43.27 μg/g,高于对照组6.66%。当盐浓度升至250 mmol/L时,盐胁迫组Pro含量达到最高值,为113.09 μg/g,高于对照组178.76%。经内生细菌252处理后,小麦Pro含量随盐浓度升高呈现先升后降趋势,其中,在200 mmol/L时,接种252处理组Pro含量最高,为99.73 μg/g,比对照组高145.81%,比盐胁迫组高83.92%。当盐浓度升高至250 mmol/L时,盐胁迫组Pro含量最高,而252接菌处理组Pro含量降为54.65 μg/g,高于对照组34.70%,低于盐胁迫组51.68%。结果表明内生菌252能在一定盐浓度范围下(盐浓度100、150、200 mmol/L)对盐胁迫小麦有不同程度修复作用。
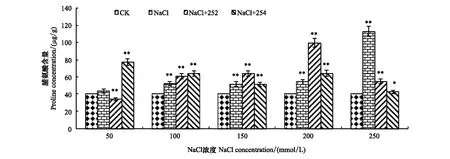
图4 接种内生细菌252、254小麦生长21d时植株脯氨酸含量Fig.4 Proline content of wheat seedings inoculated with endophytic bacterium 252, 254 in the 21th day
小麦幼苗培养至21 d时,盐胁迫组Pro含量随盐浓度升高呈上升趋势,盐浓度250 mmol/L下,Pro含量较200 mmol/L上升,最高值为113.10 μg/g,高于对照组178.76%。而接菌254处理组在250 mmol/L时Pro含量降至最低,为42.42 μg/g,明显低于盐胁迫组64.29%,仅高于对照组4.56%。由此说明在高盐浓度250 mmol/L下,当盐胁迫组Pro含量达到最高值时,内生菌254修复作用有限,对盐胁迫小麦失去修复能力。在低盐环境50 mmol/L下,接菌254处理组Pro含量最高,为77.26 μg/g,高于对照组90.43%,高于盐胁迫组78.54%,此浓度下,内生菌254对盐胁迫组小麦修复作用达到最佳。随盐浓度升高,接种254处理组对盐胁迫小麦修复作用总体上呈下降趋势。结果表明,内生细菌254在低盐环境下(盐浓度50、100、200 mmol/L)对小麦具有显著修复作用,在高盐环境下(盐浓度250 mmol/L),对盐胁迫小麦生长呈现明显抑制作用。
2.3 内生细菌252、254对小麦幼苗体内丙二醛含量的影响
由图5可知,培养第7天时,对照组MDA含量为1.12 μmol/L,盐胁迫组MDA含量均低于对照组,随盐浓度升高,MDA含量总体上呈下降趋势。在盐浓度为50 mmol/L时,盐胁迫组MDA含量最高,为0.48 μmol/L,低于对照组56.97%。当盐浓度为250 mmol/L时,盐胁迫组MDA含量降至最低,为0.39 μmol/L,低于对照组65.20%。由此表明,在盐胁迫下小麦对于盐分具有一定程度抵抗能力。经内生细菌252处理后,除盐浓度100 μmol/L和150 μmol/L时,接菌252处理组MDA含量分别略高于盐胁迫组11.25%和1.90%外,总体上接菌处理组均低于盐胁迫组MDA水平。在盐浓度为250 mmol/L时,接菌252处理组较其他盐浓度下MDA含量达到最低,为0.27 μmol/L,低于对照组76.01%,低于盐胁迫组31.05%,修复作用最为显著。结果表明内生细菌252对盐胁迫下小麦在一定盐浓度下(盐浓度50、200、250 mmol/L)具有修复作用。

图5 接种内生细菌252、254小麦生长7d时植株丙二醛含量Fig.5 MDA content of wheat seedings inoculated with endophytic bacterium 252, 254 in the 7th day
小麦长至7d,盐胁迫组MDA含量均低于对照组,接菌254处理组均低于盐胁迫组。在盐浓度100 mmol/L时,接菌254处理组MDA含量最高,为0.35 μmol/L,低于对照组68.99%,低于盐胁迫组18.87%。在盐浓度为200 mmol/L时,接菌处理组MDA含量最低,为0.27 μmol/L,低于对照组75.66%,低于盐胁迫组34.35%。随盐浓度升高,接菌处理组MDA含量总体保持稳定。说明内生细菌254在一定程度上对盐胁迫小麦具有明显稳定修复能力。
由图6可知,生长14 d时,对照组小麦幼苗体内MDA含量为0.18 μmol/L,较第7天 MDA含量有较大程度降低。盐胁迫组MDA含量总体上均高于对照组,在盐浓度50 mmol/L时,盐胁迫组MDA含量最高,为1.09 μmol/L,高于对照组513.15%。接种内生细菌252后,在盐浓度50 mmol/L时,接菌252处理组MDA含量达到最低,为0.19 μmol/L,明显低于盐胁迫组82.52%。盐浓度为150 mmol/L和200 mmol/L时,接菌252处理组MDA含量分别低于盐胁迫组8.65%和2.01%。盐浓度100 mmol/L和250 mmol/L下,接菌处理组MDA含量分别高于盐胁迫组78.63%和35.75%。说明内生细菌252对盐胁迫小麦在100 mmol/L和250 mmol/L时具有显著抑制作用,在盐浓度50、150、200 mmol/L时具有修复作用。
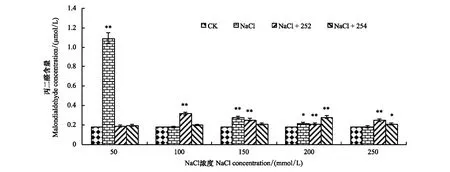
图6 接种内生细菌252、254小麦生长14d时植株丙二醛含量Fig.6 MDA content of wheat seedings inoculated with endophytic bacterium 252, 254 in the 14th day
小麦培养14 d时,接菌254处理组MDA含量均高于对照组。在盐浓度为50 mmol/L时,接菌254处理组MDA含量最低,为0.19 μmol/L,低于对照组9.02%,低于盐胁迫组82.22%,修复作用最明显。在盐浓度150 mmol/L时,接菌254处理组MDA含量低于盐胁迫组25.24%。说明在盐浓度50 mmol/L和150 mmol/L时,内生菌具有明显修复作用。在盐浓度为100 mmol/L、200 mmol/L、250 mmol/L时,接菌254处理组MDA含量均高于盐胁迫组,其中在盐浓度200 mmol/L时,接菌处理组MDA含量最高,为0.28 μmol/L,高于对照组56.94%,高于盐胁迫组30.63%,说明大豆内生细菌在200 mmol/L盐浓度下对小麦生长具有明显抑制作用。
由图7可知,生长21 d时,对照组MDA含量为0.52 μmol/L。随培养时间延长,对照组MDA总体趋势为先降后升,与Pro含量变化趋势相反。随盐浓度升高,盐胁迫组MDA含量均低于对照组,接种菌株252处理组均低于盐胁迫组。在盐浓度为50 mmol/L时,接菌252处理组MDA含量最高,为0.25 μmol/L,低于对照组23.57%,低于盐胁迫组32.25%。在盐浓度为200 mmol/L时,252接菌处理组MDA含量最低,为0.09 μmol/L,低于对照组82.93%,低于盐胁迫组81.50%,修复作用最明显。结果表明,内生菌252在21d盐胁迫环境下培养均具有明显修复作用。

图7 接种内生细菌252、254小麦生长21d时植株丙二醛含量Fig.7 MDA content of wheat seedings inoculated with endophytic bacterium 252, 254 in the 21th day
经内生细菌254处理后,接菌处理组MDA含量均低于盐胁迫组,在盐浓度为50 mmol/L时,接菌254处理组MDA含量最低为0.08 μmol/L,低于对照组84.46%,低于盐胁迫组77.47%。在盐浓度为200 mmol/L时,接菌254处理组MDA含量增至最高,达0.26 μmol/L,低于对照组50.98%,低于盐胁迫组46.90%。结果表明,在小麦培养21 d时,接菌254处理组对盐胁迫小麦均具有明显修复作用,其中在50 mmol/L盐浓度时修复作用最显著。
3 讨论
3.1 接种内生细菌对小麦幼苗脯氨酸含量的影响
Pro是一种植物体内蛋白质组成成分之一,在植物体内分布广泛并以游离状态存在。Pro水合能力很强,在盐胁迫等逆境条件下可提高植株耐性和植物细胞液浓度,能保持渗透平衡,防止细胞因过度缺水而变形[1,26];另外,可清除植物体内活性氧,在一定程度上保持膜稳定性[27]。研究[28-29]表明,Pro含量高低可作为衡量植物抵抗逆境能力强弱的指标。因此,小麦体内Pro含量高低作为衡量在盐胁迫环境下小麦的抗逆性强弱。本试验结果表明,随着小麦培养时间延长,盐胁迫组小麦体内Pro含量呈先升高后下降的趋势。在前期和中期,小麦在盐处理环境下生长,体内Pro含量逐渐积累,调节小麦细胞质渗透压,稳定了生物大分子的结构,从而提高了小麦抗逆性,保证代谢正常进行。在后期,小麦逐渐对盐环境产生适应性,体内Pro含量较中期有一定程度下降。随着盐浓度升高,小麦体内Pro含量先升高后下降趋势,但不同时期有不同适应性,说明小麦在不同生长期对盐胁迫的抵抗能力不同,每个时期小麦对盐的抵抗能力都有一个阈值,超过小麦体内负荷,小麦的抵抗能力减弱,说明调节能力有限。接种内生细菌252和254后,提高了小麦体内Pro含量,清除细胞内活性氧,维持细胞形态,提高小麦抵抗盐胁迫能力,有利于提高小麦存活率,促进了小麦生长。尤其在第14天,内生菌252和254分别在盐浓度为200 mmol/L和250 mmol/L时修复效果最显著,分别高于盐胁迫组133.48%和91.48%。Lastochkina等[30]研究表明,内生细菌Bacillussubtilis10- 4可产生IAA和铁载体,在2% NaCl盐胁迫下小麦幼苗Pro含量增加,盐胁迫下接种内生细菌B.subtilis10- 4,降低诱导产生Pro的积累,该结果与本试验结果相一致。由此表明内生菌252和254对盐胁迫小麦具有明显修复作用。
本研究用NaCl模拟盐胁迫环境,小麦幼苗Pro含量显著升高,尤其在生长第21天,盐胁迫组Pro含量均明显高于对照组,在盐浓度250 mmol/L时,盐胁迫组Pro含量高达113.10 μg/g,高于对照组178.76%。此结果与谷艳芳等[1]研究结论相一致,盐胁迫导致周麦18 Pro含量升高。吕秀云等[31]通过对藜研究发现,盐胁迫条件下Pro作为藜苗后期主要渗透调节物质,其含量显著增加,有力支持了本试验结果。接种内生细菌252和254后,小麦幼苗Pro含量与盐胁迫组相比有明显升高,这说明内生细菌处理能够减缓盐胁迫对小麦幼苗带来的伤害,达到提高小麦抵抗盐胁迫的能力及促生长作用。对内生菌系统发育结果分析表明,菌株252最相似菌株为死谷芽胞杆菌。分离自苦丁茶的内生细菌死谷芽胞杆菌ZZ185,其发酵液中含有杆菌霉素D(bacillomycin D),对小麦具有抗真菌活性[32]。菌株254最相似菌株为根癌土壤杆菌,携带重组质粒的根癌土壤杆菌EHA105转入宿主植物[33],在200 mmol/L盐胁迫下,Pro含量明显高于非转基因烟草植株,提高了宿主植物耐盐性。赵龙飞等[34]从大豆根瘤中筛选产生ACC脱氨酶活性的内生细菌,其中菌株DD165、DD132可耐受9% NaCl盐浓度,接种试验表明内生细菌DD132对小麦幼苗生长具有明显促生长作用。刘华伟等[35]利用田菁茎瘤固氮根瘤菌“ORS571”与巴西固氮螺菌 “Yu62”浸种侵染小麦,研究聚乙二醇处理渗透胁迫下接菌小麦种子发芽状况,结果表明接种混合固氮菌后在渗透胁迫下小麦种子发芽率明显提高,小麦幼苗Pro含量明显升高,表明接种固氮细菌可提高小麦幼苗抗渗透胁迫能力。这些研究与本试验结论基本一致,盐胁迫使小麦幼苗Pro含量升高,经内生细菌252和254处理后,有效缓解盐胁迫对幼苗造成的伤害,其Pro含量进一步积累,对小麦幼苗具有显著修复作用。此外,前人[36]用氢氧化细菌WMQ7浸种盐胁迫小麦、大多数内生细菌可产生Pro重要渗透物质来提高植物耐盐性[37],均有力支撑了本试验结果。在小麦生长前中期,小麦膜质过氧化程度不高,生物膜结构还未受到损伤,可能对小麦正常代谢尚未造成严重影响,随培养时间延长,到生长后期,麦苗逐渐出现枯萎,MDA含量升高,启动了膜脂过氧化,导致膜损伤和破坏[38]。说明内生细菌252和254能缓解小麦过氧化程度,对盐胁迫下小麦生长具有显著修复能力,且随培养时间延长,修复能力越显著。具体机制还在进一步研究之中。
3.2 接种内生细菌对小麦幼苗丙二醛含量的影响
在小麦幼苗耐盐性研究中,逆境条件下MDA是膜脂过氧化的终产物[37],能在一定程度上反映细胞膜结构的完整性,与植物抗性有重要关联[39]。小麦生长7 d,内生菌252处理的小麦在盐胁迫浓度为50 mmol/L、200 mmol/L、250 mmol/L时体内MDA含量均低于盐胁迫组,接种菌株254处理组在盐浓度为50—250 mmol/L范围内均表现修复作用。小麦生长21d,菌株252和254处理组的MDA含量均低于盐胁迫组,特别是在盐浓度200 mmol/L时,内生细菌252修复作用最明显,MDA含量低于盐胁迫组81.50%;内生细菌254在盐浓度为50 mmol/L时修复作用最显著,其MDA含量低于盐胁迫组77.47%。傅蕾等[40]研究表明,在不同盐浓度胁迫下,内生细菌PP04能够有效增加杂交狼尾草体内SOD、POD、CAT和APX活性,减少膜脂过氧化产物MDA的积累,缓解盐环境对杂交狼尾草造成的氧化胁迫,增强其耐盐能力。Lastochkina等[30]研究表明,内生细菌Bacillussubtilis10- 4能够产生IAA和铁载体,在2% NaCl盐胁迫下对小麦生长有保护作用,盐胁迫下小麦幼苗MDA含量增加,盐胁迫下接种内生细菌B.subtilis10- 4降低因胁迫诱导产生的MDA,对小麦幼苗生长具有修复作用。这些结果与本结论基本一致。Mayak等[41]研究推测其机制是在一定盐胁迫下,接种内生细菌可促进植物对矿质营养元素的吸收,改变植物体内离子平衡,增加植物对水分的吸收和利用能力,从而增强幼苗生长各项指标导致内生菌缓解盐胁迫能力受限。而本研究仅从内生细菌252和254对盐胁迫小麦在盐浓度为50—250 mmol/L范围内通过测定Pro和MDA含量进行了探索,至于盐胁迫下内生菌对小麦耐盐性的其他生理指标影响有待于进一步研究。
作物盐害导致农田土壤生物多样性和土壤肥效降低,严重影响作物的生长和代谢,具有抗盐潜能的生防微生物菌种有利于这一问题的解决[42]。与植物相关的多样化菌群,在植物生长和健康方面发挥着重要作用,进化基因促使其适应宿主植物,来自拟南芥、杨树、玉米作物根部细菌的基因组测序表明,与非植物根部相关细菌相比,其基因组编码较多的碳水化合物进行代谢,有利于在宿主植物内的定殖进化,也有助于植物相关微生物间的竞争[43]。幼苗时期是小麦生长的关键时期,如果该时期遭遇盐环境侵害,造成小麦体内水分缺失,严重危害小麦生长发育。本研究利用内生细菌接种盐胁迫下小麦幼苗,在一定程度上缓解盐胁迫对小麦的危害。Yoolong等[44]研究结果支持了本结果,ACC脱氨酶产生菌株StreptomycesvenezuelaeATCC 10712在盐胁迫条件下接种泰国香稻,通过增加Pro,减少乙烯、活性氧族和钠离子含量,增加了水稻的耐盐性。韩坤等[45]研究表明外源根瘤菌的固氮作用能够改善小麦生长,有力支持了根瘤内生菌调节其他植物生长并提高产量的可能性。此外,前人还对花生[46]、苜蓿[47]、黄瓜[48]、玉米[49]、番茄[50]等研究,内生细菌作为植物生长修复剂不仅能修复盐害,还能提高作物抗病和分解重金属能力,为实现盐胁迫下修复幼苗植株生长研究打下基础。
