氧化还原滴定法在分析化学中的应用
2020-07-17张静萍侯继萍青海省水环境监测中心青海西宁810003
张静萍 侯继萍(青海省水环境监测中心,青海 西宁810003)
1 氧化还原反应的概述
在反应过程中,物质之间发生了电子转移或偏移的一类反应称为氧化还原反应。
1.1 氧化还原反应的特点
①有电子得失(转移),价态发生变化,且数目不固定
②复杂反应,由基元反应组成,分步进行
③反应条件苛刻
④反应速度慢,必须克服反应势能才能反应
1.2 氧化还原反应的速度及影响因素
1.2.1 反应物的浓度对反应速度的影响
反应物的浓度越大,反应的速度越快,测定高锰酸盐指数时,用草酸钠标定高锰酸钾时,必须在强酸性溶液中进行,也就是增加草酸钠的浓度或提高溶液的酸度,都可以使反应速度加快。
1.2.2 温度对反应速度的影响
实验证明:一般温度每升高10℃,反应速度可增加2~3倍,常温下高锰酸钾与草酸钠之间反应速度缓慢,但加热却能加快反应速度。但温度不能过高,否则会引起草酸的分解,见下式:

滴定完毕时,溶液的温度也不应低于60℃,以保证监测数据的准确性。
1.2.3 催化反应对反应速度的影响
用草酸钠标定高锰酸钾溶液的浓度时,利用Mn04-与C2042-反应后生成的微量MnO2作催化剂,加快了反应的进行,这是自动催化的作用。就是开始滴定时反应速度
较慢,随着滴定剂的不断加入,其催化剂的浓度逐渐增多,反应速度就逐渐加快,随后反应物的浓度越来越低,反应速度由逐渐降低,到达滴定终点。
2 氧化还原滴定法
2.1 氧化还原滴定的基本原理
2.1.1 氧化还原滴定曲线
在进行氧化还原滴定时,随着滴定剂的加入和反应的进行,氧化型和还原型物质的浓度逐渐变化,电极电势也随之不断发生改变,这种变化可以用氧化还原滴定曲线来表示。下面以1mol / LH2SO4介质中,以0.1mol / LCe(SO4)2溶液滴定20mL0.1mol/LFeSO4溶液为例,讨论氧化还原滴定曲线。
滴定的离子反应Ce4++Fe2+=Ce3++Fe3+
(1)滴定前体积为0.1mol/L FeSO4溶液。
(2)滴定开始至化学计量点前此时滴加的Ce(SO4)2溶液中的Ce4+几乎全部转化为Ce3+,溶液中Ce4+浓度很小,且不易直接计算,而溶液中Fe2+和Fe3+的浓度容易求出,故在化学计量点前可利用Fe3+/Fe2+电对计算溶液中各平衡点的电极电势值。
(3)化学计量点当滴定分数为100%,滴入的Ce(SO4)2标准溶液为20mL时,系统到达化学计量点,此时Ce(SO4)2和FeSO4溶液均已定量反应完全,它们的浓度均很小且不易求得,单独采用任意电对都无法求得化学计量点的电极电势,可将二者联立起来考虑。
(4)化学计量点后化学计量点后,Ce(SO4)2过量,溶液中的二价铁离子几乎被氧化为三价铁离子,二价铁离子的浓度很小且不易求得。
在氧化还原滴定中,随滴定剂的逐滴加入,溶液中有关组分浓度不断变化,导致有关电对电势也随之不断变化。以加入的标准溶液的体积为横坐标,溶液的电极电势为纵坐标作图,可得氧化还原滴定曲线。曲线形象的说明了滴定过程中溶液的电极电势,特别是计量点附近的电极电势变化的规律,可作为选择指示剂的依据。
按照上述方法,整个滴定过程中电极电势的计算结果列表1,并绘制如图1以滴定百分率为横坐标,溶液中的电极电势为纵坐标所示的滴定曲线。
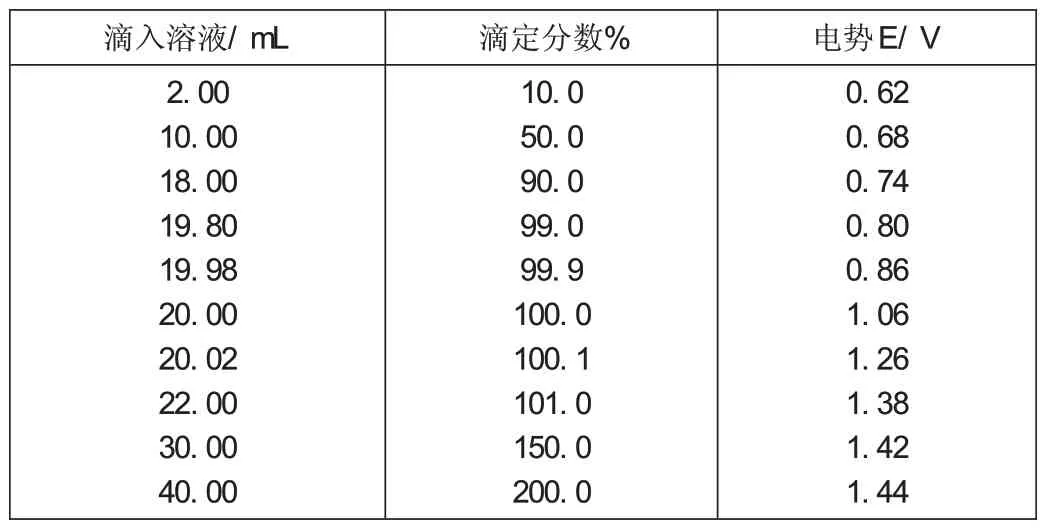
表1 滴定过程中电极电势的计算结果表

图1 滴定曲线
氧化还原滴定曲线的影响因素:
氧化还原滴定中,化学计量点附近电势突跃范围与两个电对的条件电极电势有关。条件电极电势差值越大,即反应的完全程度越高,突跃范围就越大,滴定的准确度越高;差值越小,突跃越小。由于条件电极电势随溶液的性质而改变,故同一滴定反应在不同的介质中进行,其计量点电势及突跃范围的大小不同。
2.1.2 氧化还原滴定中的指示剂
氧化还原滴定可用指示剂来指示终点。根据指示剂变色原理的不同,氧化还原滴定中常用的指示剂可分为以下几种类型:
(1)氧化还原指示剂 氧化还原指示剂是一类本身可以发生氧化还原的物质,其氧化态In(OX)和还原态In(Red)具有不同的颜色。在滴定过程中,随着滴定剂的加入,溶液的电势不断发生变化,指示剂被氧化或还原,使得在计量点附近由一种颜色变为另一种颜色。
(2)自身指示剂 有些标准溶液或被滴定物质本身具有很深的颜色,如果被测物溶液在反应后变为无色或浅色,那么在滴定过程中,这种试剂稍有过量就容易检出,这样滴定时就不需要另加指示剂,而可以通过被测物本身颜色来判断终点,此类指示剂称为自身指示剂。
(3)特殊指示剂 有些物质本不具有氧化还原性,但却能与滴定剂或被测物生成特殊颜色的物质,起到指示滴定终点的作用,这类指示剂被称为特殊指示剂。
3 结语
在氧化还原滴定分析中,不仅要从平衡的观点来考虑反应的可能性,还应从其反应速度来考虑反应的现实性。它不但能直接测定具有氧化性、还原性的物质,而且能间接测定一些非氧化还原性的物质;不仅能测定无机物,也能测定一些有机物。所以在氧化还原滴定分析中,不仅要从平衡的观点来考虑反应的可能性,还应从其反应速度来考虑反应的现实性。
