基于高通量测序分析入境羊毛微生物群落结构特征
2020-07-17韩阿祥康雨童丰新倩谢旦立关万春楼永良
韩阿祥,康雨童,丰新倩,谢旦立,关万春,楼永良
我国是世界上羊毛进口和生产加工大国,每年羊毛进口量不断增长[1]。进口入境的原羊毛属于未经加工的产品,其携带的病原体具有复杂性及不可预测性等特点[2],有学者曾在入境羊毛中分离出沙门氏菌[3]、大肠杆菌、绿脓杆菌、化脓性链球菌、化脓棒状杆菌、金黄色葡萄球菌、表皮葡萄球菌和蜡样芽胞杆菌等[4]。目前国内关于入境羊毛的检验与检疫方法主要集中在常规的微生物分离培养,但环境中99.8%的微生物不能通过常规的培养方法获得[5],因此微生物的常规培养无法全面的反映微生物群落结构的多样性[6]。随着高通量测序技术以及生物信息学分析技术的快速发展,使得高通量测序技术在分析微生物的群落结构方面相对于传统的微生物分离培养具有完整、精确、可信等优势[7]。近年来16S rRNA扩增子测序广泛应用于水体[8-9]、土壤[10-11]、食品[12]以及肠道微生态[13-14]的研究。据了解,通过提取羊毛表面微生物的DNA进行高通量测序研究其表面微生物群落结构的方法在国内尚属首次。常规16S rRNA扩增子测序只能检测微生物群落的相对丰度,不能得到微生物绝对丰度信息。微生物的相对丰度只表征了一个样本中微生物类群的相对比例,而近年来,特定环境样本中某一类群微生物的绝对定量问题受到越来越多研究学者的关注[15]。以往大多数研究往往用相对丰度来进行跨样本间微生物丰度的比较,当样本间总微生物绝对含量存在差异时,可能会得出相反的结论[15]。所以,通过微生物16S扩增子绝对定量测序技术获得微生物绝对丰度信息能为反映微生物群落结构及其动态变化提供更多有价值的参考信息。因此本研究选用微生物16S扩增子绝对定量测序的技术,基于Illumina 2×250 bp的方法获得5个国家进口的5批次羊毛表面微生物群落结构特征信息,通过后期的分析比对,以期对于海关的进口羊毛风险监测和安全评估提供有效的数据支持。
1 材料与方法
1.1样本的采集 样本于2019年4月25日在温州海关直接获取,5批羊毛分别来自美国(USA),阿根廷(ARG),德国(GER),比利时(BEL),法国(FRA)。
1.2微生物的收集处理 使用电子天平(Sartorius, Germany)分别称取羊毛10 g置于1 L无菌烧杯中,加入600 mL无菌PBS(pH=7.2)浸泡12 h(期间搅拌震荡以使羊毛表面微生物充分分散于PBS中),将全部浸泡液用15~20 μm孔径的定性滤纸(杭州特种纸业有限公司)过滤以去除液体中的大颗粒泥沙等杂质,取其中200 mL滤液以9 000 r/min (Eppendorf 5810R,Germany)离心10 min,将沉淀全部收集到5 mL磁珠管(PowerWater DNA Isolation kit提供)。
1.3DNA的提取 样品微生物DNA的提取采用PowerWater DNA Isolation kit(Qiagen,Germany)试剂盒完成,具体步骤参照试剂盒说明书。使用DS-11超微量分光光度计(DeNovix,USA)测定所提取DNA的浓度以及纯度,符合要求的DNA用于后续测序。
1.4高通量测序 DNA样品送往上海天昊生物科技有限公司,使用琼脂糖凝胶电泳方法检测基因组DNA完整性,Nanodrop 2000(Thermo Fisher Scientific, USA)检测基因组DNA质量,对于合格的样本检测区域进行高保真PCR扩增,设置3个重复实验,同时以标准的细菌/真菌基因组DNA Mix作为阳性对照,DNA的扩增使用的是16S rRNA基因V3-V4区的引物,引物序列(5′-3′):正向引物Illumina adapter sequence 1+ CCTACGGGNGGCWGCAG,反向引物Illumina adapter sequence 2+ GACTACHVGGGTATCTAATCC。琼脂糖凝胶电泳检测扩增产物是否单一和特异。将同一个样本的3个平行扩增产物混合,每个样本加入等体积的AgencourtAMpure XP(Beckman Coulter, USA)核酸纯化磁珠对产物进行纯化,使用Qubit3.0(Thermo Fisher Scientific, USA)和Agilent 2100 bioanalyzer(Agilent Technologies, USA)评估测序文库质量,最后采用Illumina平台,2×250 bp的双端测序策略对文库进行测序,后续进行生物信息学分析。
1.5数据分析 为了得到高质量的测序数据,以提高后续生物信息分析准确性,对下机后的原始数据过滤去除低质量的序列;使用FLASH2软件将双末端测序得到的成对序列进行拼接,得到merge序列,进一步去除merge后低质量序列;使用Mothur软件查找并去除序列中的引物;使用Usearch去除总碱基错误率大于2的序列以及长度小于100 bp的序列,得到质量和可信度较高的优化序列(Clean reads),将相似度大于97%的序列聚为同1个OTU[16],同时使用Denovo模式去除嵌合体序列,最终将产生的OTU代表序列通过与数据库比对, 进行物种注释和 OTU 的物种分类。基于Mothur软件计算α生物多样性指数:Chao 1[17], ACE, Simpson和Shannon[18]指数。
2 结 果
2.1样品序列统计和稀释曲线 对原始下机数据进行质控过滤后,此次采集的5个国家的5批羊毛样本最终得到1 062 239条序列,平均长度为425.80 bp,共聚类于342条OTU。稀释性曲线图中,当曲线随着抽取序列数的增加而趋于平缓时,说明样本的测序数据量合理,更多的数据量只会产生少量新的OTU,样本稀释性曲线(图1)显示5条曲线在后期阶段均已经达到平台期,测序量的增加不会引起过多OTU数目的增加[19]。

图1 5批羊毛的样本稀释曲线图Fig.1 Rarefaction curve of five wool samples

表1 5批羊毛样本的α-多样性指数Tab.1 α-diversity index of five wool samples
2.2微生物多样性分析 样本的Alpha多样性指数(表1)常常用来反映样本的物种丰富度以及多样性,其中Chao1指数和ACE指数是生态学中用来估计物种丰富度的常用指标,指数越大,表明群落的丰富度越高;Shannon指数反映多样性指标,其值越大说明群落物种的多样性越高;Simpson指数常用来反映物种的优势度;5个样本Chao1指数平均值为220.08,ACE指数平均值为219.78,Shannon指数平均值为2.30,Simpson指数平均值为0.21,其中法国的Shannon指数明显低于其他4个国家且Simpson指数高于其他4个国家,说明此次研究采集的样本中法国的样本群落结构多样性相对于其他4个国家处于较低的水平。
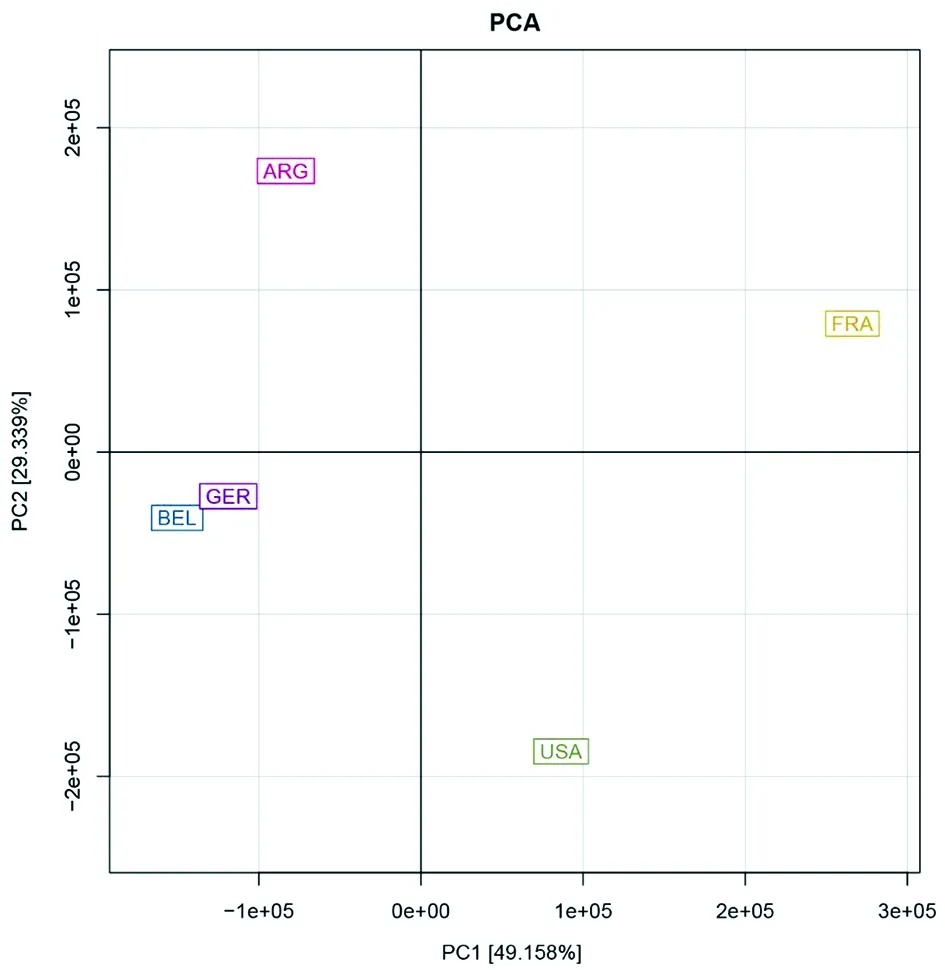
图2 基于 OTU 数据的不同样本微生物群落的主成分分析Fig.2 Principal component analysis (PCA) of all microbial communities based on OTU data
使用主成分分析(PCA)的方法展示本次采集的5个样本微生物群落结构之间的差异。结果见图2,由图可见,除德国和比利时2个国家样本点距离较近,其余3个样本距离均相距较远,说明本次采集样本中来自不同国家的羊毛表面的微生物组成有差异,其中PC1贡献度为49.16%,PC2贡献度为29.34%。
2.3微生物群落结构 通过与数据库的比对,对OTU进行了注释。在门水平上(图3),本次采集5个样本共测出的微生物门类按平均丰度大小依次为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、Candidatus_Saccharibacteri、软壁菌门(Tenericutes)、广古菌门(Euryarchaeota)、浮霉菌门(Planctomycetes);其中来自阿根廷、德国和比利时的羊毛表面微生物以变形菌门为主,占比超50%,厚壁菌门次之;而美国和法国则与另外3个国家趋势相反,微生物以厚壁菌门为主,占比超50%,变形菌门次之;在微生物总量绝对丰度层面美国>阿根廷>德国>比利时>法国。属水平的微生物组成结果如图4所示,本次采集5个样本共注释到122个属,其中丰度高于1%的有15个属,阿根廷、德国和比利时3个国家丰度较高的3个菌属分别是不动杆菌属(Acinetobacter)、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas);美国丰度前3的菌属为芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、土壤芽孢杆菌属(Solibacillus);法国丰度前3的菌属是土壤芽孢杆菌属(Solibacillus)、芽孢杆菌属(Bacillus)、解鸟氨酸芽孢杆菌属(Ornithinibacillus)。种水平(图5)共注释到了103个种,其中包括一些常见的条件性致病菌:鲁氏不动杆菌(Acinetobacter_lwoffii)、黄褐假单胞菌(Pseudomonas_fulva)、肠沙门菌(Salmonella_enterica)、嗜麦芽窄食单胞菌(Stenotrophomonas_maltophilia)。为进一步揭示微生物群落结构在OTU水平的分布特征,基于OTU水平绘制了韦恩图(图6),如图6所示,本次采集样本中美国、阿根廷、德国、比利时、法国各个样本包含的OTU数目分别为194、189、263、149、188个,其中德国的OTU多样性最高,为263个;比利时的OTU多样性最低,为149个。5批羊毛所共有的OTU为81个,美国、阿根廷、德国、法国每个国家所独有的OTU为10、19、47、22个,比利时独有的OTU为0个。

图3 样本在门水平分类等级上的微生物组成Fig.3 Relative abundance and absolute abundance at phylum level

图4 样本在属水平分类等级上的微生物组成Fig.4 Relative abundance and absolute abundance at genus level

图5 样本在种水平分类等级上的微生物组成Fig.5 Relative abundance and absolute abundance at species level

图6 样本微生物群落OTU水平分布维恩图Fig.6 Venn diagram based on OTU of microbial community
3 讨 论
入境样本中携带的致病菌对于我国的国境卫生以及传染病预防和控制造成了巨大的挑战[20],本研究利用Illumina Miseq测序平台分析来自美国、阿根廷、德国、比利时、法国5个不同国家的入境羊毛表面微生物群落结构和多样性的特点和差异。本次研究采集的羊毛样本的数量以及分布范围有限,故本次研究的样本不一定能代表某一国家羊毛中微生物的实际情况,但是利用Illumina Miseq高通量测序技术对于进一步了解我国入境的羊毛样本的微生物以及病原体提供了1种新的检验检疫技术方法和思路,同时测序还发现了许多未被分类的微生物(Unassigned),验证了通过高通量测序的方法能够获得更加全面的生物学信息,一些未被认识和分类的微生物可以通过测序而体现[21-22]。
本研究中,5个样本的稀释曲线(图1)随着抽取序列数增加均已达到平台期,表明测序深度充分,评估OTU的数量接近实际情况。5个批次羊毛样本微生物群落的α-多样性如表1,Chao1和ACE的结果表明德国样本所含OTU数目最高,美国样本所含的OTU数目仅次于德国,而阿根廷、比利时、法国3个国家各自所含的OTU数目大致相同。Shannon指数和Simpson指数的结果表明德国样本的微生物群落多样性最高,法国样本的微生物群落多样性远低于其他4个国家。结合以上4个指数来看,法国的样本在OTU数目与阿根廷和比利时2个国家相近的情况下,微生物群落多样性却远低于另外两个国家。
主成分分析(PCA)一般用来反映样本微生物群落结构的差异,如图2所示,德国和比利时2个样本在图中的距离较近,其他3个国家的样本则分布的相对较远,说明德国和比利时2个国家的样本微生物群落差异较小。有趣的是在德国、法国、比利时3个国家的地理位置、气候等外界环境因子大体相同的情况下,法国的微生物群落结构却与德国和比利时有较明显的差异,根据Brajesh K. Singh的报道[23],对于牧场的土壤给与不同的处理方法会影响到牧场的微生物群落结构,因此除去地理位置、气候等环境因子,造成法国样本微生物群落结构与其他4个国家有较大差异的原因可能跟羊的品种、当地的土壤或者一些人为的操作(比如饲料的差异,抗生素的使用[24])有关。
在微生物群落结构的种属水平,我们发现了苏云金芽孢杆菌(Bacillusthuringiensis),这是一种在自然界广泛分布的革兰氏阳性细菌[25],这种菌在生长代谢的过程中形成的蛋白晶体毒素能够对500多种害虫具有毒杀作用[26-27],因此,常被当做生物农药而广泛使用,此次检测结果阳性可能跟当地牧场采取杀虫措施时选择的农药有关;同时我们还检测到了鲁氏不动杆菌(Acinetobacterlwoffii)、肠沙门菌(Salmonellaenterica)、嗜麦芽窄食单胞菌(Stenotrophomonasmaltophilia)等临床上常见的一些条件致病菌,2000年北京市宣武医院重症监护病房就曾有过鲁氏不动杆菌暴发的相关报道[28],随着不动杆菌属到种鉴定技术的进一步发展,鲁氏不动杆菌在临床上的鉴定以及检出率也在不断的攀升[29],近年来有报道发现鲁氏不动杆菌对于光照的抵抗力较30年前明显增高,其可以出现在光照消毒后的医疗器械表面[30],因此这种菌更应该引起一线工作人员(海关进出口检验检疫人员、洗毛厂工人和装卸人员)的重视和防范;嗜麦芽窄食单胞菌以往临床并不常见,由于近年来一些临床住院患者使用大量抗生素、免疫抑制剂以及介入性的医疗操作,使得该菌有机会造成感染,其具有先天性以及获得性的耐药,因此临床上处理起来非常困难[31];检出的鲁氏不动杆菌以及嗜麦芽窄食单胞菌等条件性致病菌一般情况下对于一线工作人员(海关进出口检验检疫人员、洗毛厂工人和装卸人员)并不会致病,但是当相关的工作人员操作不当、经呼吸道吸入、身体有伤口或者免疫抵抗力下降时,这些条件性致病菌会使人患病对人体造成危害;在中国大陆地区统计的食物中毒病例中,沙门氏菌引起的食物中毒较为常见,引起了全国各地疾控中心以及实验室的重视[32-34],有研究人员曾在入境的羊毛样本中分离出了沙门氏菌[3],这与我们的测序结果相符合,也曾有报道指出儿童沙门氏菌感染的来源更有可能是来自于环境污染而不单单是食物来源[35],因此这就需要我们对于入境羊毛的风险重新评估,同时加强对于入境羊毛的管控以及消毒处理,防止沙门氏菌对于羊毛相关的从业人员的身体健康和生态环境造成严重的危害。
羊毛中病原体含量较多且疫情复杂,依靠常规的培养分离等检验检疫手段,无法对于羊毛的疫情进行全面的掌控。本研究使用的16S rRNA扩增子测序的方法可作为出入境检验检疫机构一个备选的检验方法,与常规的检验方法相补充,从而获得更全面入境样本病原体信息,同时提醒相关机构重视羊毛的熏蒸、消毒等除害化处理,一线从业人员更应该做好自我防护以切断传播途径。这对于我国的国境卫生,相关行业的安全生产以及人民的健康安全都是十分重要的。
利益冲突:无
