新生儿体外循环术后低体温影响因素分析
2020-07-17黄晶谢庆陈晓霞卢嫦青谭叶
黄晶,谢庆,陈晓霞,卢嫦青,谭叶
心脏手术患者由于术中体外循环机器转流降温,同时体外转流致机体血容量不足,末梢循环血运差,麻醉药的应用等原因,术后易发生低体温(核心体温低于36.0℃)[1]。有研究报道,心脏手术患者术后低体温发生率达51%[2]。新生儿由于体温调节中枢发育不完善、体表面积大、皮下脂肪薄易受环境影响[3],体外循环术后低体温生率高达70%[4]。低体温会造成患儿凝血功能障碍、伤口感染,严重时影响心脏功能和机体代谢,可危及生命[5]。鉴此,笔者对本院2017年9月至2019年2月收治的204例体外循环下行先天性心脏畸形矫治术的新生儿相关资料进行分析,探讨其发生术后低体温的影响因素,以为临床防范新生儿体外循环术后低体温提供参考。
1 资料与方法
1.1一般资料 204例新生儿,男136例,女68例;日龄4~28 d,平均16.0 d;体质量1.9~6.5 kg,平均3.4 kg。疾病类型:动脉导管未闭10例,主动脉缩窄10例,房间隔缺损合并室间隔缺损32例,法洛氏四联征15例,完全/部分性肺静脉异位引流23例,完全性大动脉转位35例,室间缺损12例,肺动脉闭锁11例,肺动脉狭窄18例,主动脉弓离断14例,完全/部分房室间隔缺损13例,室间隔缺损合并主动脉缩窄11例;急诊手术33例,择期手术171例;麻醉准备时间20~150 min,平均58.0 min;阻断时间16~203 min,平均61.8 min;手术时间135~725 min,平均230.0 min;复温时间17~128 min,平均50.0 min;止血关胸时间43~292 min,平均65.0 min;出血量20~500 mL,平均80.2 mL;术中输入红细胞0~4.5 U,平均1.3 U;输入冷沉淀24例。术前(麻醉诱导开始前)体温34.0~36.9℃,平均36.0℃;术中最低温16.5~35.2℃,平均24.3℃。
1.2方法
1.2.1体温监测 体温计采用泰科公司生产的90050型9Fr一次性使用温度探头,探头连接导线接入监护仪持续监测鼻咽温度及直肠温度。直肠温度探头置入肛门齿状线以上[6],使其头端到达直肠。
1.2.2体外循环体温管理 手术间室温设定为25℃,患儿入室后予盖被并采用下垫式暖风毯接暖风机以38~40℃持续保温,手术开始,关闭保暖设备。在完成主动脉和腔静脉插管,建立全流量体外循环后开始对机体降温,将室温调至20℃。心内操作基本完成开始复温,室温调至23℃,鼻咽温度达到34~35℃开放主动脉阻断钳,保持变温水箱与血温的温差在10℃以内,同时体外循环水箱温度始终不超过38.5℃。当鼻咽温度达到36.5℃时,停止升温,依靠变温水毯及充气式加温仪维持患儿体温,暖风机设定温度与实际核心体温温差小于10℃。术中非体外循环期间采用37~40℃温生理盐水冲洗创面及心包腔,术中输血输液使用输血输液加温仪,输血温度设置为38℃,输液温度设置为39~40℃。
1.2.3资料收集 ①自制新生儿体外循环术中数据登记表(下称登记表),内容包括患儿年龄、性别、体质量、是否急诊手术、手术名称、术前体温、麻醉开始时间、手术切皮时间、建立体外循环时间、主动脉阻断时间、停止体外循环时间、手术结束时间、术中最低体温、出室前体温、术中输入血制品种类及量。②患儿入室后,由手术室巡回护士于登记表上填写患儿基本信息及体温等数据,体外循环相关数据由体外循环人员填写,手术结束由专人将数据校正并录入系统,进行双人核对。③术后低体温的界定。本研究参照专家共识[1]及相关证据[4,6],将新生儿术毕撤离体外循环后出手术室前直肠温<36.0℃定义为术后低体温。
1.2.4统计学方法 采用SPSS22.0软件进行数据分析,行统计描述,χ2检验,Logistic回归分析,检验水准α=0.05。
2 结果
2.1新生儿体外循环术后低体温发生情况 术后发生低体温82例,发生率为40.2%;其中33.8℃1例,34.0~34.9℃18例,35.0~36.0℃63例。
2.2新生儿体外循环术后低体温的单因素分析 将新生儿性别、年龄、体质量、是否急诊手术、手术名称、麻醉准备时间、循环阻断时间、手术时间、复温时间、止血关胸时间、出血量、术中是否输入红细胞、是否输入冷沉淀、术前体温及术中最低温15项指标进行单因素分析,结果4项差异有统计学意义,见表1。
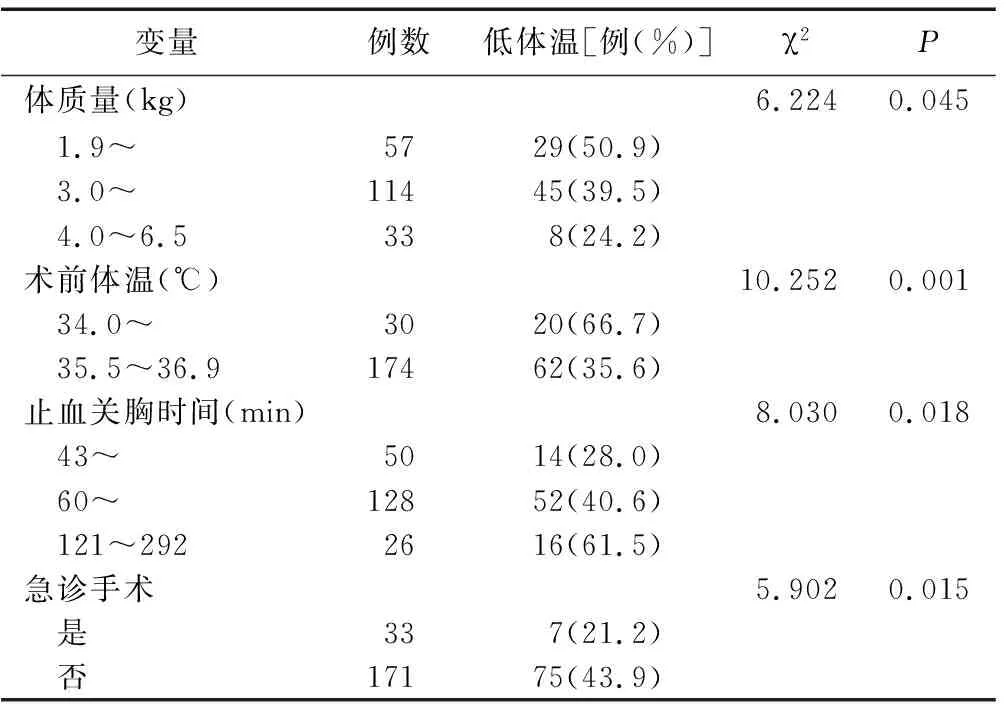
表1 不同特征新生儿体外循环术后低体温发生率比较
2.3新生儿体外循环术后低体温的多因素分析 以是否发生低体温为因变量(未发生低体温=0,发生低体温=1),以单因素分析有统计学意义的项目为自变量,行Logistic回归分析,结果:体质量(1.9~kg=1,3.0~kg=2,4.0~6.5 kg=3)、术前体温(35.5~36.9=1,34.0~℃=2)、急诊手术(急诊手术=1,非急诊手术=2)是新生儿体外循环术后低体温的影响因素,见表2。
3 讨论
临床研究证实,围手术期低体温可导致诸多不良影响,包括凝血功能障碍、伤口感染,严重时影响心脏功能和机体代谢等[7],必须加以重视,尽可能避免围术期低体温的发生。本研究结果显示,204例中发生低体温82例,发生率为40.2%,低于2017年全国部分地区横断面调查围术期低体温发生率44.5%的报道[8],其中低体质量、术前体温低于35.5℃、非急诊手术是新生儿体外循环术后低体温的主要影响因素。单因素分析显示,不同止血关胸时间低体温发生率差异有统计学意义(P<0.05),呈现随时间的延长低体温发生率相应增高的现象,但该项未能进入回归方程,分析原因可能为需要较长时间关胸的病例数较少(121~292 min病例仅占12.7%),尚不足以成为主要影响因素。主要影响因素分析如下。
3.1低体质量对体外循环术后新生儿低体温发生的影响及应对 手术过程中,体外循环升温阶段,加温水箱对血液进行外在升温,机体体温的上升主要通过组织灌注带来的热量对流和传导,身体各部位及组织的灌注量有较大差异,头部和胸部属于强灌注区,在升温过程中首先得到热量储备,四肢属于弱灌注区,热量储备主要通过中心向四肢的传导进行,故而滞后于头部及胸部。体外循环结束后,由于头胸部与四肢存在热量差,热量在全身进行重新分布,机体核心体温会出现1.0~1.5℃下降[9]。体质量偏低的新生儿,多为生理机能发育不成熟,皮下脂肪少,皮下组织薄,骨骼肌发育不健全,此类患儿在热量进行重新分布的过程中热量丢失得较正常体质量患儿多;低体质量新生儿体表面积相对较大,热量丢失较多,故而容易发生低体温。Tasew等[10]在一项264例ICU新生儿低体温原因分析提出,低体质量是新生儿发生低体温的独立影响因素(OR=8.51,95%CI2.71~26.73),与本研究结果一致。邢丽云等[7]的一项系统评价显示,用塑料薄膜包裹早产新生儿,能减少其进入NICU时低体温的发生,可以作为一种有效的保暖方法。对于实施体外循环术的低体质量新生儿,可借鉴该方法,术前将患儿四肢包裹塑料薄膜,以减少热量自中心向四周传导过程中的丢失。
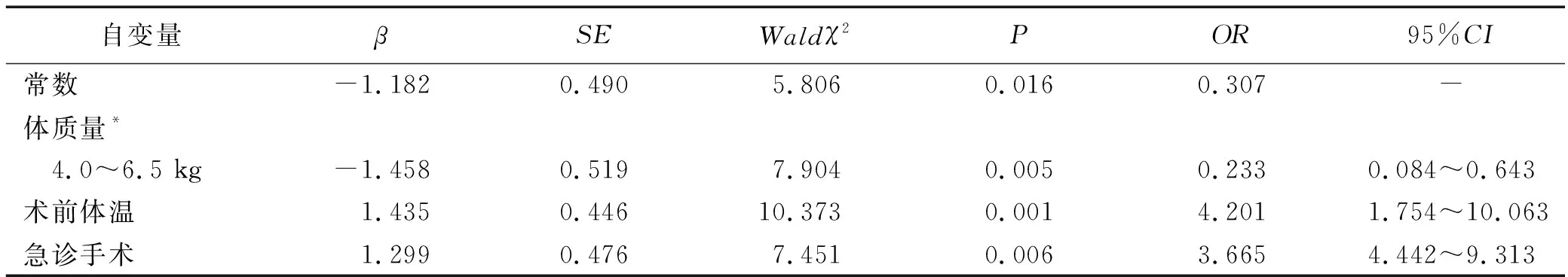
表2 新生儿体外循环术后低体温影响因素的回归分析(n=204)
3.2术前体温对体外循环术后新生儿低体温发生的影响及应对 谢言虎等[11]在一项131例患者术中低体温危险因素分析中提出,术前基础体温低是术中发生低体温的独立影响因素。本研究显示,新生儿术前体温<35.5℃,对体外循环术后新生儿低体温发生有显著影响,是独立影响因素。术前体温<35.5℃提示患儿存在机体功能低下,能量代谢异常,故而在体外循环结束后自身体温难以维持[12],出现低体温。对此,围术期可给予适当肠外营养,同时优化手术间温湿度(设置室温≥25℃,湿度≥50%),以减少患儿与空气之间形成的巨大温度梯度,在此基础上使用充气式保温毯给患儿主动加温,尽量在体温达到36.0℃后实施麻醉,主动预保温可使围手术期低体温发生率明显减少。
3.3是否急诊手术对体外循环术后新生儿低体温发生的影响及应对 新生儿能量储备少,不能通过肌肉活动(寒颤)产热[13],而是靠增加耗氧量提高新陈代谢来代偿性产热;同时肝糖元储备少,在摄食不足时极易造成散热大于产热,使能量储备耗尽,造成机体低体温[14]。本中心患儿经术前检查确诊需进行急诊手术者,即刻禁食并给予全胃肠外营养,而非急诊手术患儿则采取传统方法术前禁食6 h、禁饮4 h,故非急诊手术患儿能量补充不及急诊手术患儿。长时间禁食禁饮会引起机体血糖降低,胰岛素分泌减少,胰高血糖素分泌增加,促使蛋白质、脂肪、糖原分解,术后易引起胰岛素抵抗,增加手术后代谢性应激,减轻体质量,降低机体免疫能力。2017年美国麻醉医师协会(ASA)重新制定新的禁食禁饮方案,提出缩短术前患者的禁食禁饮时间[15]。王阿蕾等[16]根据ASA提出的术前禁食禁饮方法对100例手术患儿进行观察,结果观察组患儿术前口渴、饥饿感、焦虑、疲乏无力感发生率显著低于对照组,术前血糖、胰岛素水平显著高于对照组。由此可见,应改革传统的术前禁食禁饮方案。
4 小结
本研究显示,新生儿体外循环术后低体温的发生呈现较高水平,患儿体质量、术前体温低于35.5℃、非急诊手术是新生儿体外循环术后发生低体温的独立影响因素。对此类患儿,应加强保温,尤其是体外循环结束后应采用多种方式保暖;非急诊手术患儿,应进行缩短术前禁食禁饮时间的研究,确定最佳禁食禁饮时间,降低新生儿体外循环术后低体温的发生。本研究的局限性:为单中心研究,缺乏多中心数据分析;在术前禁食禁饮时间与术后低体温发生相关性方面还需要更详实临床数据支持。
(致谢:感谢广东省人民医院统计室张冠荣老师对本研究统计计算的支持!)
