Olsen法测定蔗区土壤有效磷影响因素研究
2020-07-16许雪皎李复琴邓军樊仙李如丹张跃彬刀静梅杨绍林全怡吉
许雪皎,李复琴,邓军,樊仙,李如丹,张跃彬,刀静梅,杨绍林,全怡吉
(1.云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699;2.云南省农业科学院,昆明 650201)
0 引言
甘蔗生长所必需的三大营养元素氮、磷、钾主要由土壤提供,研究结果表明,磷钾可使甘蔗的糖分含量增加,氮钾则可促进甘蔗的茎径和茎长的增长,对提高甘蔗的产量有显著效果[1]。由此可见,磷对甘蔗生长有重要的影响。在石灰性土壤中,通常含有较高的钙离子,易与磷酸根离子形成磷酸钙的沉淀,从而降低磷的有效性,造成蔗区土壤磷素匮乏[2]。甘蔗生产施肥主要是依靠土壤养分分析研究和生产经验指导[3],因此,测定蔗区土壤有效磷含量,为提高甘蔗产量和品质、合理施肥提供科学依据,均有很重要的意义[4]。
我们通常所说的土壤有效磷不是指某一种特定形态的磷,它没有真正的“数量”概念,同一土壤用不同的方法可测出不同数量的有效磷,所以,我们通常所检测的土壤有效磷只是表示一个相对指标,在一定程度上只有统计学意义而不能判定为土壤中“真正”有效磷的“绝对含量”。但这项指标能在一定程度上体现出土壤的磷含量,可用来判断是否施用磷肥[5],也可作为施磷肥的推荐方法[6]。测定土壤有效磷的方法有碳酸氢钠浸提-钼锑抗比色法(简称Olsen 法)、Bray 1 法、树脂法等,由于Olsen 法与作物对磷肥的反应相关性好,适用范围广,所以普遍用于各个实验室对土壤有效磷的检测,为了提高检测结果的准确度,减少劳动量和强度,笔者对在实验过程中影响Olsen法测定结果的几个因素进行了分析讨论,为使用该法测定有机磷时提供参考。
1 材料与方法
1.1 材料、仪器和试剂
1.1.1 材料
土壤样品取于2019 年云南蔗区实际待检土样11 个(编号:2019001、2019002、2019003、2019004、2019005、2019006、2019007、2019008、2019009、2019010、2019011),自制参比土样(编号:2014F391)和已知有效磷含量(29±3)mg/kg的有证标准土样(编号:GBW07414)。所有土样均经过自然风干,磨细,过2 mm筛孔处理,试验用土壤pH测定结果见表1。

表1 土壤样品pH 值Table 1 The pH value in soil sample
1.1.2 仪器
电子天平,梅特勒,型号:PL2002/01;分光光度计,上海菁华,型号:722;全温度振荡培养箱,太仓市华美生化仪器厂,型号:QHZ-98A;实验室常用容量瓶、移液管等器具及设备。
1.1.3 试剂溶液
本文所用试剂和水均严格按土壤有效磷检测标准[7]的要求配制和取用:钼锑贮备液;钼锑抗显色剂;抗坏血酸(左旋,旋光度+21~22°);2,4-二硝基酚指示剂;碳酸氢钠浸提剂(0.5 mol/L,pH8.5);无磷活性碳粉;磷标准贮备液(P=100 mg/L);无磷滤纸。
1.2 有效磷的浸提
称取2.50 g 风干土样于干燥的200 mL 塑料瓶中,准确加入50 mL 25±1℃浓度为0.5 mol/L 的碳酸氢钠浸提剂,盖紧瓶盖,混匀并把塑料瓶固定好,以保证样液充分混匀且在振荡过程中不撒漏。然后在温度25±1℃,振荡频率180±20 r/min 的全温度振荡培养箱内振荡25~30 min,振荡结束后,用无磷滤纸干过滤至滤液清澈。同时做空白实验。
1.3 滤出液中有效磷的测定
1.3.1 待测液的准备
⑴待测液的吸取:用干净的刻度移液管准确吸取5.00 mL滤液于50 mL容量瓶中;如果土壤有效磷含量较高,可以减少滤液的吸取量,但必须保持显色时溶液的酸度。计算结果要按所取滤液的分取倍数计算。
⑵调色:加入显色剂前,先将10 mL左右的水加入装有5.00 mL滤液的容量瓶中,再加2~3滴2,4-二硝基酚指示剂,然后用稀硫酸溶液和稀氢氧化钠溶液调节pH至微黄色[9]。
⑶赶气泡:将5.00 mL钼锑抗显色剂缓慢加入调好色的滤液中,由慢到快摇动容量瓶,直至气泡消失,CO2气体充分排除(要防止产生的CO2气泡溢出瓶口,影响测定结果),然后定容,盖紧瓶盖,摇匀待测。
1.3.2 有效磷的显色测定
将定容好的待测液置于室温高于25℃的条件下静置30 min,同时预热分光光度计,用1 cm光径比色皿在波长700 nm 处,以标准溶液的零点调零后进行比色测定,在测定过程中,始终保持比色皿的光滑面对准光路,手持毛面,擦干比色皿外侧液体后再将其放入比色槽,以标准曲线的零点调零后再进行比色测定;并从标准曲线上查出磷含量;同时进行空白实验。测定过程中比色皿被钼蓝染色则会造成滤液的显色色值偏大,所以如果发现比色皿被钼蓝污染,可用棉棒沾酒精清洗干净后用纯水反复冲洗干净,再倒入待测液进行测定。
1.4 磷标准曲线绘制
在土样测定的同时,吸取5.00 mL 磷标准贮备液(P=100 mg/L)于100 mL 容量瓶中,用水定容摇匀得到5.00 mg/L 的磷标准溶液。分别吸取磷标准溶液(P=5 mg/L)0.00、0.50、1.00、1.50、2.00、3.00、4.00、5.00 mL 于50 mL容量瓶中,加入5.00 mL碳酸氢钠浸提剂,2~3滴2,4-二硝基酚指示剂,然后用稀硫酸溶液和稀氢氧化钠溶液调节pH 至微黄色,再加入5.00 mL 钼锑抗显色剂,缓慢摇动排除CO2后加水定容,即得到含磷0.00、0.05、0.10、0.15、0.20、0.30、0.40、0.50 mg/L 的磷标准系列溶液,用分光光度计波长在700 nm 处测定试样吸光度,计算标准曲线数据见表2。r=0.999,说明测定结果比较准确。

表2 磷测定标准曲线Table 2 Standard curve for determination of phosphorus
1.5 测定结果计算
土壤中有效磷(P)的含量(mg/kg)计算:P(mg/kg)=
式中:ρ是从标准曲线求得的显色液中磷的浓度(mg/L);ρ0是从标准曲线求得的空白试样中磷的浓度(mg/L);V是显色液体积(mL);D是分取倍数,试样浸提剂体积与分取体积之比;1000是将mL换算成L和将g换算成kg的系数。
2 结果与分析
2.1 比色皿对吸光度测定的影响
比色皿有不同的光程长度,一般常用的有0.5、1、2、3 cm 光程长度等,选择何种光径的比色皿是根据分析样品的吸光度而定。当样品浓度较小时,应选用光程长度较大的如2、3 cm比色皿;当样品浓度较大时,可选用光程长度较小的如1 cm比色皿。不同浓度下的测定误差也不同,选择最适宜的测定浓度可以减少测定误差,吸光值在0.1~0.7 之间时,测定误差相对较小,所以我们在选择比色皿时,应使所测溶液的吸光值在0.1~0.7之间。通过比较1、2、3 cm三种不同光程长度的比色皿对10个蔗区待测土壤样品检测有效磷吸光度的测定分析发现(表3),选用1 cm 的比色皿比色时,所测样液的吸光值为0.1~0.7;选用2、3 cm 的比色皿比色时,有部分土壤吸光值超出0.7;为减少测定误差,故在检测蔗区该批次土壤样有效磷时应选用光程长度较小的1 cm 比色皿。比色皿均有方向性,在检测过程中应严格按方向标记使用;清洗比色皿时可用稀硝酸(1%)或者无水乙醇浸泡片刻,除去吸附在皿壁的钼蓝物质,然后用纯水反复冲洗干净[10]。

表3 不同光程长度比色皿测定土壤吸光值Table 3 Determination of soil absorbance by cuvette of different lengths range
2.2 土液比对浸提效果的影响
通过对土壤样品在不同土液比下浸提测定结果的对比发现,Olsen法中土液的比值可直接影响磷的浸提效果(表4),土液比越大,浸提效果越不明显,土液比低于1∶20,虽然浸提效果明显,却存在滤液过少的情况;故在检测中,我们要按照标准,严格将土液比控制在1∶20,保证滤液充足且浸提完全。称取土样时要先将校准过的电子天平预热30 min,加入浸提剂后,要将瓶盖拧紧并上下摇动多次,保证样液充分混匀。

表4 土壤样品2014F391 土液比对浸提效果的影响Table 4 Effect of soil sample(2014F391) to liquid ratio on extraction
2.3 振荡时间的控制
磷溶解作用和交换作用都与作用时间有关,通过对土壤样品、自制参比土样和已知有效磷含量29±3 mg/kg 的有证标准土样在振荡时间选择的研究中发现(表5);土壤质量2.50 g,土液比1∶20的同等条件下,振荡时间低于25 min时,磷的浸出不充分,磷结果偏低;振荡时间越久,磷检测结果就越高,数据显示振荡时间为30 min时浸提结果比较接近各土壤样品磷含量的标准值,故振荡时间控制在30 min最适宜。
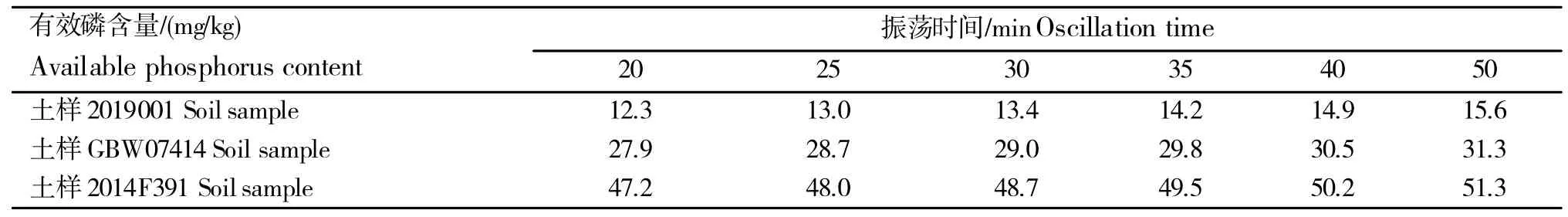
表5 不同振荡时间提取土壤有效磷的检测结果Table 5 Results of available phosphorus extracted from soil at different oscillation time
2.4 振荡频率的选择
根据对已知有效磷含量29±3 mg/kg 的有证标准土样浸提有效磷时不同振荡频率的研究(表6)发现,振荡频率不同会影响土壤有效磷的浸提结果;振荡频率慢,则测定结果会偏低;振荡频率越快,浸提效率越高[11],但是频率过快会导致样液溅出,也会影响其测定结果,所以根据行业标准《土壤检测第七部分:土壤有效磷的测定》中的规定,浸提频率应控制在180±20 r/min最适宜。

表6 不同振荡频率对土样GBW07414 有效磷含量测定结果的影响Table 6 Effects of different oscillation frequencies on content of available phosphorus in soil sample(GBW07414)
2.5 浸提温度的控制
用Olsen 法测定土壤有效磷时,磷测定结果会受浸提温度和浸提液温度的影响。张雯雯等指出在20~30℃提取温度范围内,以25±1℃为标准,温度每升高1℃,土壤有效磷检测结果就会增加0.43 mg/kg[12],所以,准确控制浸提温度和浸提液温度是保证检测结果准确性的重要条件。
根据对自制参比土样和已知有效磷含量29±3 mg/kg 的有证标准土样进行的不同浸提温度下有效磷含量测定实验中发现,在条件相同的情况下,不同的浸提温度会直接影响有效磷的测定结果(表7);随着温度的逐步升高有效磷的结果也随之增加,在接近25℃时,浸出磷的含量比较接近样品标准有效磷的含量;所以浸提时,应把振荡箱的温度控制在25±1℃,使浸提温度和浸提液温度一样,以提高检测结果的准确性。冬天室温较低时,可先把浸提剂用热水浴的方法适当加温,但不能超过35℃[8]。夏季温度较高时,则采用冷水浴的方法适当降温。
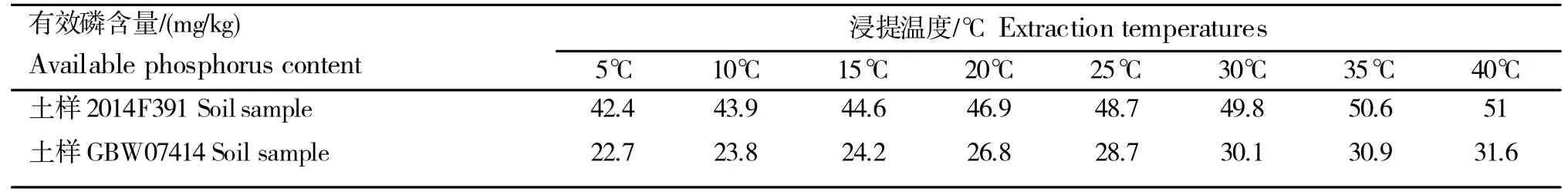
表7 不同浸提温度对土壤有效磷含量测定结果的影响Table 7 Effects of different extraction temperatures on results of available phosphorus in soil
2.6 调色对测定结果的影响
Olsen法测定土壤有效磷是通过pH=8.5的NaHCO3溶液来提取土壤中的有效磷,石灰性土壤中的磷,多以磷酸一钙和磷酸二钙的形态存在,pH=8.5 的NaHCO3提取土壤有效磷时,由于碳酸根的同离子效应,碳酸钙的溶解度会降低,随之溶液中钙的浓度也会降低,既有利于磷酸钙盐的提取,又能使碳酸氢钠碱溶液中的HCO3-、CO32-等阴离子有利于吸附态磷的置换;在偏酸性土壤中pH 的升高会使磷酸铝和磷酸铁(Fe-P、Al-P) 水解而部分被提取,在浸提液中由于Al、Ca、Fe 浓度较低,不会产生磷的再沉淀[6],故可以用钼锑抗显色测出浸提液中的磷含量。
通过对4 个待检土样、自制参比土样和已知有效磷含量(29±3)mg/kg 的有证标准土样浸提后直接滤液与调色后滤液的pH 检测发现(表8),由于浸提时对浸提液pH 的严格控制,所以滤液的pH 呈碱性,而磷钼杂多酸的生成需要合适的酸度条件,过酸或不足都会影响显色效果,所以在磷的钼蓝比色测定中,酸度的控制极其重要,故为了保持显色时待测液的酸度,在加入显色剂前,需要先调节浸提液的pH 至微黄色,让钼蓝显色在特定的酸度条件下发生,以保证实验结果的准确性。
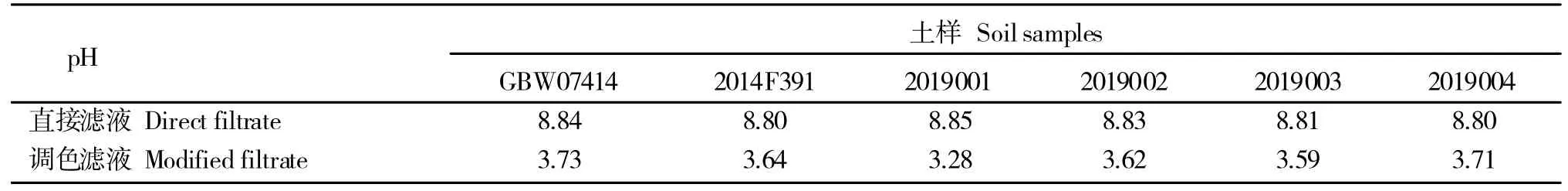
表8 直接滤液与调色后滤液的pH 值对比Table 8 Comparison of pH between direct filtrate and modified filtrate
2.7 吸收波长的选择
分光光度法是依据比尔定律,通过测定待检物质在一定波长范围内或特定波长处光的吸收度,来对该物质进行定量和定性分析的方法;不同的测试标准对待测液吸收波长的要求有所不同[12],在测试之前,通过对已知有效磷含量29±3 mg/kg的有证标准土样待测液吸收光谱的测定(表9),在700 nm处吸光度最大,选择最大吸收波长700 nm处作为本实验的测量波长[13],从而获得较高的灵敏度及较好的线性关系。

表9 标准土样(GBW07414)在不同波长下测定的吸光度Table 9 Absorbance of standard soil samples(GBW07414) at different wavelengths
2.8 Olsen法检测有效磷含量的精密度
通过对蔗区部分土壤、有证标准土样有效磷检测,在室内温度为25℃,称取待检土样4 个,编号分为:2019001、2019002、2019003、2019004,自制参比土样(编号:2014F391)和已知有效磷含量29±3mg/kg 的有证标准土样(编号:GBW07414)各2.50 g,每个样品平行测定5 次,用1 cm 比色皿比色,土液比1∶20,振荡时间为30 min,转速180±20 r/min,浸提温度25±1℃;用Olsen法检测其有效磷含量。由表10可知,6组土壤样品测定有效磷含量的RSD为0.41%~1.22%,符合标准要求。
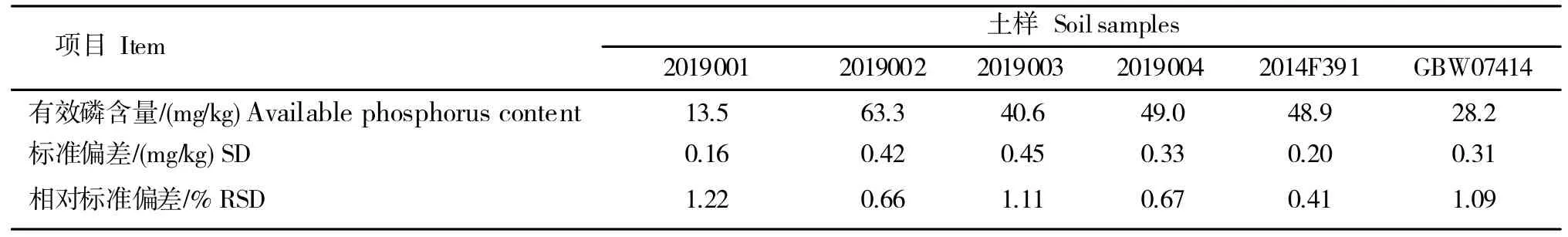
表10 蔗区土壤样品有效磷精密度测定结果Table 10 Results of available phosphorus density of soil samples in sugarcane area
3 讨论与结论
本文主要讨论了影响有效磷测定结果的几个因素。通过实验得知碳酸氢钠浸提-钼锑抗比色法中使用碳酸氢钠浸提剂浸提时,要严格控制土液比1∶20,振荡时间30 min和频率180±20 r/min,浸提温度25±1℃,用1 cm 比色皿测吸光值等几个关键的因素;重点研究了调色对滤液待测液pH 的影响,因浸提环境的限制,滤液的pH 呈碱性,所以在加入显色剂前通过调色使待测液达到适合钼蓝显色的特定酸度条件,再用加入抗坏血酸的钼锑抗溶液作为显色剂,可以使显色在短时间内完成,且生成的颜色较稳定,提高了实验效率;本文通过对紫外可见波长全扫描,找到最大吸收峰的波长700 nm 作为本实验的波长,测得6 组土壤样品的RSD为0.41%~1.22%,符合标准要求。与NY/T 1121.7-2014相比,本方法缩短了实验时间,增加了实验结果的稳定性,优化了环境对实验的限制。
按照样品分析的全部步骤,重复n(n≥7)次空白试验将各测定结果换算为样品中的浓度,计算n次平行测定的标准偏差,按下列公式计算方法检出限:MDL=t(n-1,0.99)×S(式中:n是样品的平行测定次数;t是自由度为n-1,置信度为0.99 时的t分布,S是n次平行测定的标准偏差)。当n=7 时,t=3.143,以4倍检出限作为方法测定下限,检出限为0.47 mg/kg,检出下限为1.90 mg/kg;较传统Olsen法,该方法显色快,显色效果好,生成的颜色较稳定,受干扰离子小,在室温下也能显色;检出限、准确度、精密度均较好,同时也满足了土壤有效磷测定的要求,可广泛应用于对中性、微酸性和石灰性土壤有效磷的检测,更好地为蔗农进行平衡施肥提供准确的理论依据。
