微藻细胞破壁方法研究进展
2020-07-14刘俊果董尧坤张园园
刘俊果 董尧坤 张园园
摘 要:微藻具有光合作用效率高、环境适应性强、生长快、生物质产率高和环境效益显著等优点,在体内还能积累虾青素、叶黄素、高不饱和脂肪酸、生物柴油等重要产物,近年来成为人们关注和研究的热点。微藻细胞破壁是提取这些产物的关键及困难环节。从3种常用微藻细胞壁的结构入手,分析总结了机械破壁法、基于波的细胞破壁法、热解破壁法、化学法以及生物法等微藻破壁技术的研究现状与发展趋势。认为从现实角度出发,将化学法与机械法结合使用,即先采用化学法进行预处理,再采用机械法破壁,可解决大部分藻细胞的破壁问题,是一种比较可行的产业化破壁技术路线;从发展前景来看,生物法破壁具有能量消耗较低、条件温和等优势,对于绝大多数藻类来说具有经济可行性和技术理论可行性,是一种最值得期待的破壁方法。
关键词:生物工程其他学科;微藻;细胞破壁;机械法;非机械法
中图分类号:O949.2 文献标识码:A
doi:10.7535/hbkd.2020yx03008
Advances in microalgae cell wall disruption
LIU Junguo, DONG Yaokun, ZHANG Yuanyuan
(School of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China)
Abstract:
Microalgae cultivation shows the advantages of high photosynthesis efficiency, good environmental adaptability, fast growth, high bioproducts productivity and good environmental value, and many valuable products including astaxanthin, lutein, high-unsaturated fatty acids, lipids, etc. can accumulate in microalgae cells, so microalgae has become the focus in scientific research in recent years. Cell disruption is the key and difficult step to extract those products. Starting from discussing the cell wall structural characteristics of three species of microalgae, the current situation, trends in scientific research and technical development of cell disruption strategies including mechanical, wave-based, pyrolysis, chemical and biological methods were discussed and summarized. It is pointed out that practically the combination of chemical and mechanical methods, with chemical procedures as pretreatment and mechanical step as final disruption, can solve cell disruption problems for most microalga, and is a more feasible cell disruption industrialization technology. Prospectively, biological method is feasible economically and theoretically for most microalga because of its low energy cost and mild process conditions, and tends to be a deservable method.
Keywords:
other subjects in bioengineering; microalgae; cell wall disruption; mechanical cell lysis; non-mechanical cell lysis
微藻是一類在陆地、海洋广泛分布的自养单细胞生物,具有光合作用效率高、环境适应性强、生长快、周期短、占地面积小、生物质产率高和环境效益显著等特点[1]。近年来,利用微藻生产虾青素、叶黄素、藻胆蛋白(藻红蛋白、藻蓝蛋白和变藻蓝蛋白)、高不饱和脂肪酸、生物柴油的研究与技术开发,受到人们的普遍关注。从
2015—2019年的5年内,围绕微藻发表的CNKI论文有2 306篇,申请中国发明专利1 591项。微藻在食品、医药保健、基因工程、液体燃料等领域具有很好的开发前景。
尽管微藻存在很多优势,但大规模应用仍面临很多问题。微藻中这些令人类感兴趣的物质大多存在于细胞内,这些物质的提取过程通常需要先对微藻进行细胞破壁。与一般微生物细胞壁相比,微藻细胞壁结构致密,破壁难度大,同时还要保证各种生化产物在破壁过程中的生物活性不被破坏,因此细胞破壁成为各种藻类产物提取的关键环节[2]。本文就此进行总结,讨论了微藻破壁技术的研究现状与发展趋势,为相关研究提供理论参考和实践依据。
1 微藻细胞壁的结构特点
讨论微藻细胞的破壁技术,有必要先研究微藻细胞壁的结构特点。本文主要对最受关注的3大类微藻进行讨论。
1.1 雨生红球藻(Haematococcuspluvialis)
雨生红球藻因为能在体内大量积累虾青素和不饱和脂肪酸而广受关注,其细胞壁因生长阶段和生长环境的变化而变化。当营养条件充分时,雨生红球藻外形近球形,绿色,带鞭毛,富有运动性;当营养条件不良时,其颜色逐渐由绿色转变为红色,并且伴随着虾青素的不断积累,雨生红球藻由游离状态变为不动孢子聚合体状态,鞭毛丧失,运动性丧失,呈休眠状态,细胞壁变得厚而致密[3-4]。此不动孢子聚合体细胞壁干重占整个细胞干重的16%,成分如下:糖类70%(其中甘露糖占89.4%、葡萄糖6.4%、阿拉伯糖1.6%、木糖1.3%),纤维素3%,蛋白质6%[3]。
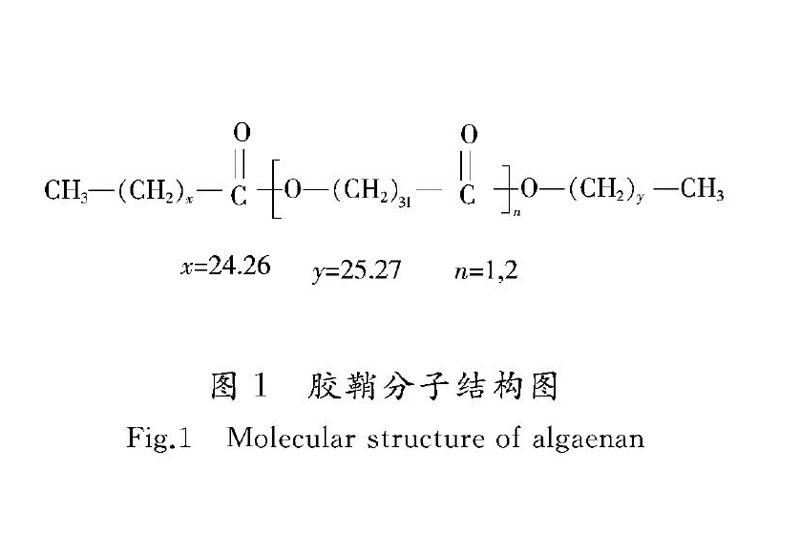
生产花青素过程中需要破壁的雨生红球藻细胞是结构最致密的不动孢子聚集体。处于不动孢子聚集体状态的细胞壁分为2层:外层是耐酸的algaenan(胶鞘),厚度30~40 nm;内层是甘露糖和纤维素,厚度400~700 nm。胶鞘是一种不易水解的疏水脂肪族生物大分子,分子质量为400~2 000 Da,由饱和26C和28C脂肪酸与饱和30C或32C的醇或脂肪酸缩合成酯,结构式如图1所示[5]。这种细胞壁结构在微球藻属中属于常见结构。
1.2 小球藻(也称绿藻,Chlorella spp.)
近几年小球藻属在单细胞蛋白的生产、生物能源等领域一直是研发热点。小球藻细胞直径2~10 μm,无鞭毛,似亲孢子无性繁殖,18~24 h繁殖一代。新生子细胞细胞壁最薄,只有几纳米,而含有目的产物的大多属于成熟细胞,细胞壁厚达20~25 nm。成熟细胞细胞壁分为内外2层:外层为耐酸的胶鞘,与雨生红球藻一样,内层为类几丁质[2]。
NORTHCOTE等[6]针对蛋白核小球藻的研究表明,藻细胞直径3~4 μm,细胞壁厚度21 nm,占细胞总干重的13.6%。细胞壁中蛋白质含量约占27%,脂类9.2%,alpha-纤维素15.4%,半纤维素31.0%,葡萄糖胺3.3%,灰分5.2%。其中:alpha-纤维素由葡萄糖、半乳糖、阿拉伯糖、甘露糖、木糖和鼠李糖构成;葡萄糖胺组分可以溶于稀碱溶液中,因此细胞壁中可能不含有几丁质。电子显微镜研究结果表明,细胞壁结构类似于植物细胞的初生细胞壁结构。纤维束直径为3~5 nm,分2个方向不规则地连续交织在一起,细胞壁的内侧和外侧结构上没有明显差别,细胞壁中不含有木质素。
小球藻细胞壁成分受培养条件的影响很大。比如二氧化碳浓度升高时,会导致细胞壁糖醛酸和氨基糖含量升高,而中性糖组分降低[4]。而在高盐培养基中,小球藻细胞壁的厚度会增加70%[7]。
1.3 微绿球藻(Nannochloropsis spp.)
因含有大量不饱和脂肪酸,微绿球藻在营养保健及生物能源领域倍受重视。SCHOLZ等[8]利用电镜、傅里叶变换红外光谱等技术,研究了指数生长期的微绿球藻细胞,发现其细胞壁由内外2层构成,内层含有75%(质量分数)的纤维素,外层疏水性,以胶鞘为主成分。ARNOLD等[9]的研究也证实了这一点。BEACHAM等[10]研究了6种微绿球藻的细胞壁结构,发现这6种微绿球藻细胞(指数生长期中期)的细胞壁厚度范围在63~119 nm,而盐水微绿球藻(Nannochloropsissalina)细胞壁最薄,易于破壁,也最适用于生产生物柴油。
2 微藻细胞破壁技术
2.1 机械法破壁
2.1.1 高压均质机法破壁
KWAK等[11]研究了一种新的提取方法,利用高剪切应力混合,造成细胞破碎从而使油脂直接从浓缩湿生物质(>350 g/L)中提取出来。用高剪切混合器(HSM)从海洋微藻(Aurantiochytrium sp.)中提取油脂。结果表明:HSM能显著提高油脂的产率,且有效消除阻止溶剂分子穿过细胞膜的水屏障,其与正己烷、异丙醇和乙醇的配合使用效率更高。可以看出,HSM能够提供一种强大的机械手段,用非极性和毒性较小的溶剂从湿生物质中提取脂质。
OLMSTEAD等[12]的研究表明,高压均质机法适用于高浓度(20%~25%,质量分数)的微藻料液。800 MPa压力,均质10次,小球藻的油脂提取率约达到90%。鲁龙等[13]研究了高压匀质法破碎小球藻细胞,得到最佳工艺为:藻液质量浓度为140 g/L,匀质压力为94 MPa,匀质时间为14 min (均质3-4次)。在此条件下小球藻的油脂得率大约为52%。
由于微藻细胞壁结构致密,高压均质机法破壁受到重视。高压均质机的破碎机理主要是高速撞击、水力空化及强剪切作用[14]。均质破壁的能耗取决于细胞浓度、藻细胞的种类和培养条件,一般1 kg干细胞破壁能耗为0.25 (干细胞浓度1%,氮缺乏培养基培养的细胞) ~147 kW·h (干细胞浓度0.85%,普通培养基培养的细胞)[15]。
高压均质机法适合于大规模生产,破碎效率高,但是能耗高,设备费用较高,因此限制了其应用。
2.1.2 珠磨法
TALEB等[16]采用英国Constant systems 公司生产的高压珠磨机破碎微绿球藻
,操作压力为175 MPa时,细胞破碎率达98%,主要缺陷是能耗高。 PAN等[18]研究了一种改进型涡轮式搅拌珠磨机破碎微拟球藻细胞,得到最佳条件是搅拌切线速度2.3 m/s、藻细胞浓度15%、破碎时间40 min,细胞的破碎率可达到98%以上。POSTMA的研究证实,增加处理时间、切线速度(5~10 m/s)和磨珠用量(不超过磨腔容积的85%)有利于提高细胞破碎率,采用半连续工艺破碎的能耗是1 kg干细胞81 KWh[18]。ZINKON[19]针对珠磨法对微藻连续破壁的过程进行了数学模拟,优化后的工艺条件是玻璃珠直径0.4 mm, 搅拌桨切线速度14 m/s。此条件下,较大细胞的破碎速度比较小细胞的破碎速度快。POSTMA等[20]研究了珠磨法中玻璃珠直径对3种微藻普通小球藻(Chlorella vulgaris)、富油新绿藻(Neochlorisoleoabundans)和四肩突四鞭藻(Tetraselmissuecica)破壁效果的影响。发现直徑小利于提高破壁速率,0.3 mm的玻璃珠比能耗最小;直径0.3~0.4 mm的玻璃珠,破壁效果好,能耗低。珠磨过程没有破坏Rubisco(核酮糖-1,5-二磷酸羧化酶/加氧酶)标识蛋白的结构,说明珠磨法比较温和。GARCIA等[21]采用建模方法研究了珠磨法对微藻的破碎过程,目的在于预测2种微藻在不同玻璃珠大小和用量,以及在2种不同的珠粒研磨机鳞片上的破碎速率。所得数学模型可以支持过程开发、优化和放大研究,并且可以优化操作条件,实现低能耗、高选择性、温和的藻细胞破碎工艺。
SAFI 等[22]针对微绿球藻研究了高压均质机、珠磨机、脉冲高压电场和酶法4种破壁方法的破壁效果,发现高压均质机和珠磨机效果最好,破壁率在95%以上,酶法破壁率最小。
珠磨法设备成熟,便于控温,易于放大,劳动强度低,是规模化破壁常考虑的方法。其主要缺陷是磨珠之间以及磨珠与容器壁之间的机械摩擦造成能量损失,并影响生物产物的活性。磨珠可以选用玻璃、不锈钢或陶瓷材料,最佳直径为0.5 mm,直径增加或减小都会使破碎效率下降。高黏度的料液使用高密度的磨珠(比如氧化锆)效果更好,而低黏度的料液使用低密度的磨珠(比如玻璃)效果更好[23]。
2.1.3 水力空穴法
水力空穴法的基本原理是流体在流过文丘里管、多孔板等装置时,会出现湍动,造成局部静压下降。当某点静压低于液体所在温度下的空气分离压时,原来溶于液体中的气体会分离出来,产生气泡(100 nm~3 mm),这就叫空穴现象。当流体流速恢复静压时,空穴会塌陷,空穴周围伴随产生强烈的冲击波,瞬间局部压力可达10.13~506.62 MPa(100~5 000 atm),局部温度可达500~1 500 K,对周围流体中存在的细胞、脂肪微粒等颗粒产生强烈的剪切作用,导致其破碎[24]。
LEE 等[25]研究了水力空穴法破碎微藻细胞。与超声波技术相比,在消耗同样能量前提下(500~10 000 KJ/kg),水力空穴法的油脂收率为25.9%~99.0%,远高于超声波技术(16.2%~66.5%)。
刘明磊等[26]将多孔板、文丘里管及尾涡空化等技术融为一体,结合Fluent数值模拟软件,设计了一套水力空化细胞破壁循环装置,并进行了细胞破壁处理。数值模拟结果表明:对于多孔板,减小孔径、增加孔板厚度和孔数,空化强度增强;圆形交错的孔分布方式空化效果要优于圆形阵列分布。对于文丘里管,尖角过渡型的文丘里管空化效果最佳;喉部直径增加,文丘里管的空化效果减弱,但对空泡开始溃灭的位置无影响;渐缩段长度的变化对空化效果影响不大,但对空泡开始溃灭的位置有较明显的影响;增加渐扩段长度和减小管道直径使得空化效果加强,空泡开始溃灭的位置离喉部变远。利用水力空化装置对微拟绿球藻进行破壁处理试验,试验结果表明:对于不同细胞密度的微藻悬浊液,处理时间达到30 min,破壁率均可达到90%以上,但随着细胞密度的提高,破壁效果下降;入口压力由0.1 MPa提高到0.25 MPa,细胞破壁率提高约30%;空化器转速由0增加到1 200 r/min,破壁率提高约20%;与超声空化相比,水力空化法破壁更充分、更均匀,且处理量远高于超声空化。
WAGHMARE等[27]对超声波法和水力空化法的操作参数和各种预处理进行了优化,以获得最高的细胞破碎效能。研究表明,超声破碎的最佳条件是:固体负荷1%、占空比80%、功率输入54 W、时间为90 min。采用0.5%氢氧化钠预处理后,用超声法细胞破裂所需的时间减少到50 min。文丘里管空化装置,时间为180 min,压力为0.5 MPa和藻细胞浓度为0.45%。用0.5%氢氧化钠预处理后,用水力空化法进行最大细胞破碎所需时间减少到105 min。此外,計算了使用超声法和水力空化法细胞破碎所需的能量,发现水力空化法对于微藻细胞破碎有着更显著的能量效率。
水力空穴法具有能量消耗低、易于放大、破碎效果好的特点。作为一种破壁新技术,易于放大,适合于大规模生产,破壁效果好,能耗比珠磨法和高压均质法低,值得大力推广应用。
2.2 基于波(能量场)的细胞破壁
2.2.1 超声波破壁
刘明磊等[26]针对超声空化法开展了小球藻细胞破壁试验。研究结果表明,各因素对油脂提取率的影响程度的大小顺序为:功率>细胞密度>藻液量>时间>温度>分散剂浓度。综合考虑对油脂提取率和能量消耗的影响,试验最优的参数组合为:超声功率 220 W、温度 25 ℃、处理时间6 min、细胞质量密度0.2 g/mL、处理量120 mL、分散剂质量浓度0.4 g/mL。WANG等[28]的研究表明,藻细胞依赖钙离子或三价铝离子絮凝形成絮体后,超声破壁的效果会下降。为了减少超声波破壁过程中所消耗的能量,常配合使用化学法破壁,即预先向料液中添加酸、表面活性剂或有机溶剂等[29]。YEL等[30]用不同类型的细胞破碎方法来回收微藻油脂。结果表明,正己烷法超声处理可显著提高总油脂的得率,且外观澄清透明。与单独使用溶剂相比,油脂产率提高了1.4倍,最佳提取条件下,油脂得率为30.2%。SKORUPSKAITE等[31]研究了超声波法和超均质法对小球藻的细胞破碎效率。超声60 min,同时冷冻微藻,最大微藻细胞破碎效率为52.6%。超均质法在破碎微藻细胞时效率较低,但随着转速的增加,效率逐渐提高。转速为24 000 r/min,冷冻微藻,在60 min内效率达到48.5%。
超声波法也依赖于空穴效应,只是产生空穴依赖的是超声波,而不是流体的湍动。超声波法破壁具有效率高、时间短、适应性广等优点,有利于节约能源和改善环境污染。但一般用于实验室,难以在大生产中使用,超声波器件也无法实现在线不停机维修。
2.2.2 微波法破壁
微波法破壁的基本原理为细胞内的极性物质(如水分子等)吸收微波能量,使细胞内温度急剧升高,细胞内水分汽化从而产生巨大的内压力,使细胞膜和细胞壁受到冲击。另外,微波带来的电穿孔效应以及自由基效应使细胞膜的通透性增大,细胞壁中的果胶和纤维素组分受到严重破坏,导致细胞破壁[32]。频率为2 450 MHz的微波破壁,加热、干燥的效果最好,此外,低浓度的料液破壁效果比高浓度的料液破壁效果好[33]。CHENG等[34]研究表明,微波处理时间从0 min升高到20 min后,小球藻细胞壁的厚度由0.11 μm增加到0.59 μm,而细胞壁上的孔径由0.005 μm增加到0.18 μm,即微波处理使细胞壁变得厚而疏松。
LEE[35]采用高压均质法、酸热法、微波法、超声法和10% NaCl溶液浸泡预处理后,利用甲醇-氯仿(体积比为1∶1)分别提取葡萄藻、小球藻和栅藻中的油脂,结论表明微波法的油脂提取率最高。BALASUBRAMANIAN等[36]设计了一套连续微波破壁提取系统:1.2 kW,2 450 MHz,处理湿藻含量50%的料液, 95 ℃,30 min,提取率达到76%~77%,而同样条件下的热水浴提取率只有43%~47%。HEO等[37]研究了高温蒸煮、微波法、渗透压冲击法以及超声波法对小球藻的破壁过程,几种方法在保证油脂提取率的前提下,微波法处理过的小球藻糖类物质的提取收率最高,便于藻类培养产物的综合利用。
目前,微波破壁技术成为实验室微藻细胞破壁的有效方法,但是微波破壁受到设备功率的限制,且存在电离辐射风险,难以实现大规模应用。与此相对应的是,市场上有多家厂商提供实验室用微波破壁机,然而提供工业规模微波破壁机的厂家极为罕见。
2.2.3 高频脉冲电场破壁
脉冲电场破壁是指通过在细胞壁上施加大于36 V/μm的高频交流电,产生高于360 kV/cm 的电位梯度,微藻中带电荷离子在不同位置的浓度随电流方向周期性变化,细胞内极性分子的空间取向也随电流发生高频变化,离子之间、分子之间相互摩擦和碰撞,从而实现细胞结构的破坏。
LAI等[38]研究了高频脉冲电场(强度为30.6 kW·h/m3)处理后,栅藻(Scenedesmus sp.)的脂肪酸甲酯的提取率比未处理组提高3.1倍。同时,SYTOX-green染料细胞结合率由4.7%提高到96.8%,意味着细胞通透性地急剧增加。LUENGO等[39]的研究说明,从微藻中提取叶黄素,微藻经25 kV/cm高频电场处理后,叶黄素的提取率提高了3.5~4.2倍。OriginOil公司的一步法采用电磁法和超声法破壁,结合pH值调节,使藻细胞壁破裂,将细胞中的油脂释放出来[40]。
张若冰等[41]研究了利用清华大学自主研制的高压脉冲电源系统,对小球藻破壁,发现高压脉冲电场强度和脉冲注入能量密度是影响高压脉冲电场处理效果的关键因素,而脉冲宽度、脉冲重复频率、电场极性对小球藻的处理效果影响不大。当电场强度从2.5 MV/m增加到5.0 MV/m时,20 mS/m电导率下的小球藻细胞破碎率从17.21%增加至83.29%;当脉冲注入能量密度从8.9 kJ/L增加到149.52 kJ/L时,4.5 MV/m电场强度作用下的小球藻细胞破碎率从9.78%提高到81.78%。
杨倩等[42]研究优化了脉冲电场辅助下以低毒溶剂提取微藻油脂的过程,得到的最佳工艺为场强20 kV/cm、流速5.4 L/h,频率130 Hz,脉宽6 μs,循环次数3次。该条件下油脂提取率为61.1%,与传统方法相比提高了15.9%。
CARULLO等[43]研究了脉冲电场和高压均质法对小球藻的破壁过程,发现细胞膜的通透性随脉冲电场的增加而增加,并不产生细胞碎片,而高压均质法会产生大量细胞碎片。脈冲电场法在细胞低通透性时,可促进糖类和低分子质量蛋白的选择性提取。而高压均质法则无差别地提高胞内各种产物的提取收率,糖类的提取率比脉冲电场法高1.1倍,蛋白的提取收率比脉冲电场法高10.3倍。这说明脉冲电场法适合小分子胞内产物的选择性提取,而高压均质法可以作为破壁工序的最后一道环节是提取大分子质量的胞内产物。
LAM等[44]采用莱茵衣藻(C.reinhardtii)的细胞壁缺失突变藻种来模拟去除细胞壁的微藻,研究使用脉冲电场技术促进胞内蛋白的释放。结果表明,细胞壁缺失突变藻种的胞内亲水性蛋白可以完全释放,即便是低能量(0.05 kW·h/kg)输入时,仍有70%的蛋白可以释放。而疏水性的叶绿体完全留存于藻细胞内部。电镜照片表明:脉冲电场仅仅是打开了藻细胞,而没有把藻细胞破碎。
高频脉冲电场破壁是一种比较温和的方法,在细胞外形基本不变的情况下,增加其通透性,可选择性释放细胞内的色素、糖、脂类等物质。作为一种新技术,目前仍在研究探索阶段,还没有足够的证据和工业设备来支撑工业化破壁需求。
2.3 热解法破壁
2.3.1 蒸汽爆破法破壁
蒸汽爆破法早先被用于木质纤维素材料的预处理,木质纤维素加热到180~240 ℃,0.10~0.35 MPa(1.03~3.45 atm),维持几分钟,然后压力突然降为常压,木质纤维素就会爆破膨化,也会造成细胞壁的严重破坏。黄睿等[45]通过瞬时弹射式蒸汽爆破处理湿藻细胞。当蒸汽爆破预热时间增加到5 min时,藻细胞的分形维数从初始的1.53増大到1.65;随着蒸汽爆破的生物质填充率降低,藻细胞平均直径从1.69 μm降低到1.44 μm。藻细胞表面产生的爆破缺口面积(0.08~0.22 μm2)随着蒸汽爆破压的升高而增大。蒸汽爆破使微藻细胞的破壁能耗由传统方法的33~529 MJ/kg显著降低到8.15 MJ/kg,使湿藻油脂萃取率由未处理时的56%提高到93.9%。CHENG等[46]研究了瞬时弹射式蒸汽爆破技术处理微拟球藻,发现微藻细胞壁孔面积随蒸汽压力的升高(1.0~2.1 MPa)而增大,配合溶剂提取技术,油脂的收率达76.5%,而对照组只有36%。蒸汽爆破法高能耗的特点限制了其应用的推广。GNERKEN等[47]开发了一种新的连续装置和方法,以CO2为基础的爆炸减压处理微藻生物质。
新型连续装置与传统间歇式的实验比较表明,该装置的处理时间缩短了3.2~9.6倍,生物量和生化释放效率提高了2倍以上,CO2消耗量降低了2~4倍。
蒸汽爆破法由于需要高温、高压的条件,因此仅适用于细胞壁结构致密,目标产物耐高温高压、稳定不易分解的情况,比如油脂提取等,小型或者规模生产的设备都可以买到。
2.3.2 热解液化法破壁
热解液化法指的是利用超临界或亚临界的水(280~370 ℃,10~25 MPa),其密度、介电常数、离子积、黏度、热导率、扩散系数和溶解性能都发生明显改变。在超/亚临界水中,水作为溶剂及反应物,具有高效溶解、快速传质及有效打断高分子碳链的作用,因此能够破坏细胞壁分子,进而直接液化为生物柴油,藻类生物油的主要成分包括苯酚及其衍生物、含氮杂环化合物、长链脂肪酸、烃类、植物醇和胆固醇的衍生物等,其产物油的热值可高达39 MJ/kg[48]。YOO等[49]报道了相对低一些的温度(200 ℃)有益于获得高质量的生物油脂。HU等[50]研究了化学法(NaOH/尿素法,硫酸法以及超声波法)作为热解液化的预处理手段,NaOH/尿素预处理法导致33.7%的干物质损失,77.2%糖类的损失,46.3%的蛋白质损失,但是其热解液化过程的能耗显著降低,且油脂的提取收率高,油脂的流动特性很好。LI等[51]研究了利用热解液化法从小球藻提取油脂的过程,优化后的条件是320 ℃,60 min,油脂的提取收率是38.1%。
CHENG等[52]在亚临界水(310~350 ℃,0~17 MPa)条件下热解液化高油脂含量微藻盐水微绿球藻以及低油脂含量。红藻(Galdieriasulphuraria),在最佳条件下,盐水微绿球藻和红藻的生物柴油得率分别是59%和31%。能量平衡分析表明:盐生红藻有85%的能量进入生物柴油,而红藻只有59%的能量进入生物柴油。CHEN等[53]合成了负载过渡态金属 (Ni, Pd, Co和Ru)的中孔SBA-15分子筛用于催化微藻的热解液化过程。结果表明,负载的金属在613 K温度下表现出很好的热解液化稳定性。该催化剂显著影响了液化产物的组成,糠醛类产物增加,而脂肪酸以及含氮产物下降,生物柴油的质量显著提升,转化率达到78.78%,生物柴油的产率达到24.11%。WADRZYK等[54]研究了以热解液化法亚临界水处理栅藻细胞获得生物柴油的过程,推断了反应机理,发现所得生物柴油的特性参数可以通过调整亚临界水热解液化的工艺参数实现。
热解液化法与蒸汽爆破法类似,反应条件苛刻,也仅适用于细胞壁结构致密,产物耐高温高压、稳定不易分解的情况,比如油脂提取、纤维素提取等。其他生物产物,比如虾青素等,不能采用这种方法破壁。
2.4 化学法破壁
2.4.1 离子液体破壁
离子液体作为离子化合物,一般由有机阳离子和无机或有机阴离子构成,常见的阳离子有季铵盐离子、季鏻盐离子、咪唑盐离子和吡咯盐离子等,阴离子有卤素离子、四氟硼酸根离子、六氟磷酸根离子等,可在0~140 ℃呈现液态,其熔点低的主要原因是结构中某些取代基的不对称性使离子不能规则地堆积成晶体所致。由于其不易燃,具有良好的热稳定性,高热容,低蒸汽压,用于藻类破壁及提取具有一系列优点:缩短操作时间,溶剂可重复使用,萃取率高等。KIM等[55]利用离子液体[Bmim]CF3SO3,以甲醇作为助溶剂,油脂提取率达到19%,远高于采用氯仿/甲醇的提取率(11%)。PRAVEENKUMAR等[56]尝试使用各种离子液体从雨生红球藻中萃取花青素,配合使用生物萌发工艺,以[Emim]EtSO4为萃取剂,1 min可使花青素的收率达到19.5 pg/g,是传统高压均质法有机溶剂萃取法收率的82%。
作为一种新型破壁技术,离子液体破壁具有操作时间缩短,溶剂可重复使用,萃取率高等优点,缺陷主要是离子液体价格昂贵,且在产物中的残留对人体健康的影响不明确,因此距离大规模应用尚有一定的距离。
2.4.2 纳米粒子破壁
低浓度的金属离子,如铁和镍一般对微生物代谢是有益的,但是过量的金属离子会破坏细胞的生理功能。由于金属氧化物纳米颗粒能够产生活性氧,进而破坏细胞,吸引一些人利用金属氧化物纳米颗粒进行细胞破壁,同时氧化镍(铁)纳米颗粒能够被磁铁吸附,因而便于应用磁分离技术从水中提取藻类细胞。
HUANG等[57]研究了利用纳米氧化镍颗粒(小于50 nm)提取并破壁藻细胞。结果表明,1 min,pH值为7的条件下,藻细胞的提取率达到98.8%,而且经过96 h的氧化镍纳米颗粒处理后,油脂的提取率达到91%。阳离子表面活性剂修饰的铁氧化物纳米颗粒[58],十六烷基三甲基溴化铵-四氧化三铁(CTAB-Fe3O4),在0.46 g/(g细胞)的剂量下小球藻提取率达到96.6%。另外,通过添加十二烷基硫酸钠SDS,可以使藻细胞与CTAB- Fe3O4纳米颗粒分离,使得纳米颗粒得以循环利用,应用前景良好。WANG 等[59]利用纳米催化剂M/TiO2(M=Fe, Co, Ni, Mo, Mn)催化微绿球藻的热解液化过程,Ni/TiO2催化效率最高,其最佳反应温度为300 ℃,转化率为89.28%,可添加Ni/TiO2降低体系黏度,所得生物柴油中的低沸点组分增加。
作為一种新型破壁技术,纳米粒子破壁尚处于尝试探索阶段,距离大规模应用还很远。
2.4.3 氧化法破壁
LEE等报道以二氧化钛为光催化氧化剂,在紫外光照射下,通过水氧化产生羟基自由基(OH·),可有效攻击藻细胞。HUA等[60]设计了反应式电化学膜过滤系统(Ti4O7-REM),旨在将藻细胞的膜过滤分离与藻细胞的电化学氧化预处理偶合在一起。结果表明,在保证过滤通量的前提下,双型栅藻(Scenedesmus dimorphus)藻细胞的形态明显受到破坏,光合作用活性明显下降,可归因于多孔二氧化钛催化的氧化作用,油脂提取的收率也增加了50%左右。ULKER等[61]研究了使用臭氧破壁微藻细胞,1 g干细胞0.5 g臭氧剂量下,臭氧的破壁效率显著高于酸、碱溶液以及超声波处理。CARDEA等[62]研究了以臭氧处理微藻细胞来促进厌氧酵解甲烷的过程。结果表明,臭氧处理可以显著提高甲烷的产量,1 g微藻挥发性固体产生甲烷的量最高可达432.7 mL,比对照组高出66%。电镜图片表明,臭氧处理对藻细胞壁结构的完整性造成了显著破坏。
生物法破壁指的是利用生物體自身或者其他生物体生长代谢过程中产生的一系列酶,催化水解细胞壁。该方法具有酶法裂解细胞的所有优点,条件温和、能量需求低,主要缺点是需要筛选特异的菌株或病毒。
3 总结与展望
与微生物细胞相比,微藻细胞壁结构致密,含有难以分解的多糖类物质(纤维素、半纤维素以及几丁质),含量在45%以上,破壁难度大,成为微藻产业化的一大制约因素。目前的破壁方法在技术可行性或者在经济性上存在不足,距离大规模生产的需求尚有一定距离。
化学法与机械法二者结合使用,是一种比较可行的产业化技术路线。采用化学法,用酶、酸、表面活性剂等进行预处理,再用高压均质机或珠磨进行机械法破壁,可以解决大部分藻细胞的破壁问题。
如果目标是生物油脂,可将有机溶剂浸提与高压均质机法配合,优化各工艺条件(溶剂种类及用量、破壁温度、均质压力与次数等),以油脂收率评价破壁效率,油脂收率可以达到90%以上。如果目标产物是小分子生物活性物质,比如虾青素、叶黄素等,分子结构中存在不少共轭不饱和碳碳双键,易氧化,对光热敏感,破壁工艺的选择尤其要考虑目标产物的活性。采用机械法破壁时,需考虑配备冷却系统,以保证料液不会因机械破壁导致温度大幅升高,从而破坏目标产物的生物活性。而且机械破壁过程中,会带来泡沫,增加目标产物被氧化的可能性,因此破壁前需考虑适当添加还原剂保护目标产物。
生物法破壁最具发展前景。自然界生态平衡使得任何一种生物都存在天敌,藻类也逃脱不了这一定律。任何一种藻类都可以筛选到与其对应的杀藻菌或病毒,同时藻类自然萌发破壁技术,因此生物法破壁对于绝大多数藻类具有技术可行性。同时生物法具有条件温和、常温常压、pH值近中性、低能量消耗的特点,使其具有经济可行性。对光热敏感、怕氧化的生物活性物质,生物法破壁是更好的选择。由于生物之间具有相互作用的特异性,因此可根据不同微藻的特性,采用适宜的天敌生物进行破壁,需要加大在科研与技术开发方面人力、物力的投入。待适宜的生物法破壁工艺成熟后,如能长期应用于工业生产中,日积月累,生物法破壁的环境效益和经济效益就会超过化学-机械法破壁。
目前,微藻相关产业正处在从实验室走向商业化大规模生产的阶段,规模化微藻培养系统不断出现,而与此配套的规模化破壁技术仍是限制性环节。建议研究者们应加强研发力度,积极开发生物法破壁技术。
参考文献/References:
[1] 樊华,韩佩,王菁晗,等.微藻生物采收技术的现状和展望[J].生物学杂志,2017,34(2):26-32.
FAN Hua, HAN Pei, WANG Jinghan,et al. Status and prospects of microalgae harvesting with biological flocculation[J]. Journal of Biology, 2017,34(2):26-32.
[2] GNERKENAB E, D'HONDTA E,EPPINK M H, et al. Cell disruption for microalgae biorefineries[J]. Biotechnology Advances, 2015,33(2):243-260.
[3] HAGEN C, SIEGMUND S, BRAUNE W. Ultrastructural and chemical changes in the cell wall of Haematococcuspluvialis(Volvocales, Chlorophyta) during aplanospore formation[J]. European Journal of Phycology,2002, 37(2):217-226.
[4] CHENG Y S, LABAVITCH J M, VANDERGHEYNS J S. Elevated CO2 concentration impacts cell wall polysaccharide composition of green microalgae of the genus Chlorella[J]. Letters in Applied Microbiology,2015,60(1):1-7.
[5] ALLARD B, TEMPLIER J. High molecular weight lipids from the trilaminar outer wall (TLS)-containing microalgae Chlorella emersonii, Scenedesmus communis and Tetraedron minimum[J]. Phytochemistry, 2001, 57(3):459-467.
[6] NORTHCOTE D H, GOULDING K J, HORNE R W. The chemical composition and structure of the cell wall of Chlorella pyrenoidosa[J]. Biochemical Journal,1958,70(3):391-397.
[7] GERKEN H G, DONOHOE B, KNOSHAUG E P. Enzymatic cell wall degradation of Chlorella vulgaris and other microalgae for biofuels production[J]. Planta, 2013,237(1):239-253.
[8] SCHOLZ M J, WEISS T L, JINKERSON R E, et al. Ultrastructure and composition of the Nannochloropsisgaditana cell wall[J].Eukaryot Cell,2014,13(11):1450-1464.
[9] ARNOLD A A, GENARD B, ZITO F, et al. Identification of lipid and saccharide constituents of whole microalgal cells by 13C solid-state NMR[J]. Biochimica et Biophysica Acta, 2015,1848:369-377.
[10]BEACHAM T A, BRADLEY C, WHITE D A, et al. Lipid productivity and cell wall ultrastructure of six strains of Nannochloropsis: Implications for biofuel production and downstream processing[J]. Algal Research, 2014, 6:64-69.
[11]KWAK M, KANG S G, HONG W K, et al. Simultaneous cell disruption and lipid extraction of wetaurantiochytrium sp. KRS101 using a high shear mixer[J]. Bioprocess and Biosystems Engineering, 2018,41:671-678.
[12]OLMSTEAD I L, KENTISH S E, SCALES P J, et al. Low solvent, low temperature method for extracting biodiesel lipids from concentrated microalgal biomass[J]. Bioresource Technology,2013,148:615-619.
[13]魯龙,毕生雷,金洪波,等.高压匀质法破碎小球藻细胞工艺优化[ [J].食品工业科技,2017,38(6):304-307.
LU Long, BI Shenglei, JIN Hongbo, et al. Optimization of Chlorella cell disruption process by high pressure homogenization[J]. Science and Technology of Food Industry, 2017,38(6):304-307.
[14]HALIM R, HARUN R, DANQUAH M K, et al. Microalgal cell disruption for biofuel development[J]. Applied Energy, 2012,91(1):116-121.
[15]GRIMI N, DUBOIS A, MARCHAL L, et al. Selective extraction from microalgae Nannochloropsis sp. using different methods of cell disruption[J]. Bioresource Technology,2014,153:254-259.
[16]TALEB A, KANDILIAN R, TOUCHARD R, et al. Screening of freshwater and seawater microalgae strains in fully controlled photobioreactors for biodiesel production[J].Bioresource Technology,2016, 218:480-490.
[17]PAN Z D, HUANG Y, WANG Y M, et al. Disintegration of Nannochloropsis sp.cells in an improved turbine bead mill[J]. Bioresource Technology, 2017,245:641-648.
[18]POSTMA P R, MIRON T L, OLIVIERI G, et al. Mild disintegration of the green microalgae Chlorella vulgaris using bead milling[J]. Bioresource Technology, 2015,184:297-304.
[19]ZINKON T R, GIFUNI I, LAVENANT L, et al. Bead milling disruption kinetics of microalgae: Process modeling, optimization and application to biomolecules recovery from Chlorella sorokiniana[J]. Bioresource Technology,2018, 267: 458-465.
[20]POSTMA P R, SUAREZ-GARCIA E, SAFI C, et al. Energy efficient bead milling of microalgae: Effect of bead size on disintegration and release of proteins and carbohydrates[J]. Bioresource Technology,2017,224:670-679.
[21]GARCIA E S, LO C, EPPINK M H M, et al. Understanding mild cell disintegration of microalgae in bead mills for the release of biomolecules[J]. Chemical Engineering Science, 2019,203:380-390.
[22]SAFI C, RODRIGUEZ L C, MULDER W J, et al. Energy consumption and water-soluble protein release by cell wall disruption of Nannochloropsisgaditana[J]. Bioresource Technology, 2017,239:204-210.
[23]DOUCHA J, LVANSK K. Influence of processing parameters on disintegration of Chlorella cells in various types of homogenizers[J]. Applied Microbiology and Biotechnology, 2008,81(3):431-440.
[24]LEE I, HAN J I. The effects of waste-activated sludge pretreatment using hydrodynamic cavitation for methane production[J]. Ultrasonics Sonochemistry, 2013,20(6):1450-1455.
[25]LEE I, HAN J I. Simultaneous treatment (cell disruption and lipid extraction)of wet microalgae using hydrodynamic cavitation for enhancing the lipid yield[J].International News on Fats, Oils and Related Materials,2015,186:246-251.
[26]劉明磊. 微藻细胞空化破壁技术研究[D].青岛:中国石油大学, 2014.
LIU Minglei. Study on Microalgae Cell Disruption by Caviation Technology[D]. Qingdao: China University of Petroleum,2014.
[27]WAGHMARE A, NAGULA K, PANDIT A, et al. Hydrodynamic cavitation for energy efficient and scalable process of microalgae cell disruption[J]. Algal Research, 2019,40:101496.
[28]WANG W, LEE D J, LAI J Y. Aggregate formation affects ultrasonic disruption of microalgal cells[J]. Bioresource Technology, 2015,198:907-912.
[29]PRABAKARAN P, RAVINDRAN A D.A comparative study on effective cell disruption methods for lipid extraction from microalgae[J]. Letters in Applied Microbiology,2011,53(2):150-154.
[30]YEL N V, YELBOA E, TTER M, et al. Comparison of cell disruption and lipid extraction methods for improving lipid content of schizochytrium sp.[J]. Mol Biol Biotechnol,2017,1(1):9-12.
[31]SKORUPSKAITE V, MAKAREVICIENE V, SENDZIKIENE E, et al. Microalgae Chlorella sp. cell disruption efficiency utilising ultrasonication and ultrahomogenisation methods[J]. Journal of Applied Phycology, 2019,31(4):2349-2354.
[32]CHOI I L, CHOI S J, CHUN J K, et al. Extraction yield of soluble protein and microstructure of soybean affected by microwave heating[J].Journal of Food Processing and Preservation,2006,30(4):407-419.
[33]AMARNI F, KADI H. Kinetics study of microwave-assisted solvent extraction of oil from olive cake using hexane: Comparison with the conventional extraction[J]. Innovative Food Science and Emerging Technologies,2010,11(2):322-327.
[34]CHENG J, SUN J, HUANG Y, et al. Dynamic microstructures and fractal characterization of cell wall disruption for microwave irradiation-assisted lipid extraction from wet microalgae[J]. Bioresource Technology, 2013,150:67-72.
[35]LEE J Y, YOO C, JUN S Y, et al. Comparison of several methods for effective lipid extraction from microalgae[J].Bioresource Technology, 2010, 101(1):75-77.
[36]BALASUBRAMANIAN S, ALLEN J D, KANITKAR A, et al. Oil extraction from Scenedesmusobliquus using a continuous microwave system-design, optimization, and quality characterization[J]. Bioresource Technology, 2011,102:3396-3403.
[37]HEO Y M, LEE H, LEE C, et al. An integrative process for obtaining lipids and glucose from Chlorella vulgaris biomass with a single treatment of cell disruption[J].Algal Research, 2017,27:286-294.
[38]LAI Y S, PARAMESWARAN P, LI A, et al. Effects of pulsed electric field treatment on enhancing lipid recovery from the microalga,Scenedesmus[J]. Bioresource Technology,2014,173:457-461.
[39]LUENGO E, MARTINEZ J M, BORDETAS A, et al. Influence of the treatment medium temperature on lutein extraction assisted by pulsed electric fields from Chlorella vulgaris[J]. Innovative Food Science Emerging Technologies,2015,29:15-22.
[40]GREEN N E, FRASER M P, ALEXANDER S. Systems and methods for extracting non-polar lipids from an aqueous algae slurry and lipids produced therefrom[J]. United States Patent,
2015:9085745.
[41]张若兵,傅贤,寇梅如.高压脉冲电场对小球藻破碎效果的影響[J].高电压技术,2016,42(8):2668-2674.
ZHANG Ruobing, FU Xian, KOU Meiru. Influence of high voltage pulsed electric fields on disrupture of chlorella[J]. High Voltage Engineering, 2016,42(8):2668-2674.
[42]杨倩.脉冲电场辅助下以低毒溶剂提取微藻油脂的研究[D].哈尔滨:哈尔滨工业大学,2015.
YANG Qian. Pulsed Electric Fields Assisted Lipid Extraction from Algae Using Low Tocixity Solvent[D].Harbin:
Harbin Institute of Technology,2015.
[43]CARULLO D, ABERA B D, CASAZZA A A, et al. Effect of pulsed electric fields and high pressure homogenization on the aqueous extraction of intracellular compounds from the microalgae Chlorella vulgaris[J].Algal Research, 2018,31:60-69.
[44]'T LAM G P, van der KOLK J A, CHORDIA A, et al. Mild and selective protein release of cell wall deficient microalgae with pulsed electric field[J]. ACS Sustainable Chemistry & Engineering, 2017,5(7):6046-6053.
[45]黄睿.微藻细胞先酯交换再萃取制生物柴油的机理研究[D].杭州:浙江大学,2016.
HUANG Rui. Biodiesel Production from Wet Microalgae through Extraction with Hexane after the Transferification of Lipid[D].Hangzhou: Zhejiang University, 2016.
[46]CHENG J, HUANG R, LI T, et al. Physicochemical characterization of wet microalgal cells disrupted with instant catapult steam explosion for lipid extraction[J]. Bioresource Technology,2015,191:66-72.
[47]GNERKEN E,D'HONDT E, EPPINK M H M, et al. Disruption of microalgae with a novel continuous explosive decompression device[J]. Algal Research, 2019,39:101376.
[48]CHIARAMONTI D, PRUSSI M, BUFFI M, et al. Review and experimental study on pyrolysis and hydrothermal liquefaction of microalgae for biofuel production[J]. Applied Energy,2017,185:963-972.
[49]YOO G, PARK M S, Yang J W, et al. Lipid content in microalgae determines the quality of biocrude and energy return on investment of hydrothermal liquefaction[J]. Applied Energy,2015,156:354-361.
[50]HU Y, GONG M Y, XU C B, et al. Investigation of an alternative cell disruption approach for improving hydrothermal liquefaction of microalgae[J].Fuel, 2017,197:138-144.
[51]LI H G, WANG M,WANG X F, et al. Biogas liquid digestate grown Chlorella sp. for biocrude oil production via hydrothermal liquefaction[J]. Science of the Total Environment,2018,635:70-77.
[52]CHENG F, CUI Z, MALLICK K, et al. Hydrothermal liquefaction of high-and low-lipid algae: Mass and energy balances[J]. Bioresource Technology,2018,258:158-167.
[53]CHEN Y, WU K J, LIN Q S, et al. Catalytic hydrothermal liquefaction of microalgae over metal incorporated mesoporous SBA-15 with high hydrothermal stability[J]. Carbon Resources Conversio,2017,1(3):251-259.
[54]WADRZYK M, JANUS R, VOS M P, et al. Effect of process conditions on bio-oil obtained through continuous hydrothermal liquefaction of Scenedesmus sp. microalgae[J]. Journal of Analytical and Applied Pyrolysis,2018,134:415-426.
[55]KIM Y H, CHOI Y K, PARK J, et al. Ionic liquid-mediated extraction of lipids from algal biomass[J].Bioresource Technology,2012,109:312-315.
[56]PRAVEENKUMAR R, LEE K, LEE J. Breaking dormancy: An energy efficient means of recovering astaxanthin from microalgae[J]. Royal Society and Chemistry,2015,17:1226-1234.
[57]HUANG W C, KIM J D. Nickel oxide nanoparticle-based method for simultaneous harvesting and disruption of microalgal cells[J]. BioresourceTechnology, 2016, 218:1290-1293.
[58]HUANG W C, KIM J D. Simultaneous cell disruption and lipid extraction in amicroalgal biomass using a nonpolar tertiary amine[J]. Bioresource Technology, 2017,232:142-145.
[59]WANG W J, XU Y T, WANG X X, et al. Hydrothermal liquefaction of microalgae over transition metal supported TiO2 catalyst[J]. Bioresource Technology, 2018,250:474-480.
[60]HUA L, GUO L, THAKKAR M, et al. Effects of anodic oxidation of a substoichiometric titanium dioxide reactive electrochemical membrane on algal cell destabilization and lipid extraction[J]. Bioresource Technology, 2016,203:112-117.
[61]ULKER D K S, MIRAT D G. Using ozone for microalgal cell disruption to improve enzymaticsaccharification of cellular carbohydrates[J]. Biomass and Bioenergy, 2017,105:59-65.
[62]CARDEA R, MORENO G, BAKONYI P, et al. Enhancement of methane production from various microalgae cultures via novel ozonation pretreatment[J]. Chemical Engineering Journal,2017,307:948-954.
[63]HALIM R, HARUN R, DANQUAH M K, et al. Microalgal cell disruption for biofuel development[J].Applied Energy,2012, 91(1):116-121.
[64]MOLINA-GRIMA E, BELARBI E H, ACIN FERNNDEZ F G, et al. Recovery of microalgal biomass and metabolites: Process options and economics[J]. Biotechnology Advances,2003,20(7/8):491-515.
[65]HUANG W C, KIM J D. Simultaneous cell disruption and lipid extraction in a microalgal biomass using a nonpolar tertiary amine[J]. Bioresource Technology, 2017, 232:142-145.
[66]MAFFEI G, BRACCIALE M P, BROGGI A,et al. Effect of an enzymatic treatment with cellulase and mannanase on the structural properties of Nannochloropsis microalgae[J]. Bioresource Technology,2018,249:592-598.
[67]WU C C, XIAO Y, LIN W G, et al. Aqueous enzymaticprocess for cell wall degradation and lipid extraction from Nannochloropsis sp.[J]. Bioresource Technology,2017,223:312-316.
[68]ZHANG Y, KONG X Y, WANG Z M, et al. Optimization of enzymatic hydrolysis for effective lipid extraction from microalgae Scenedesmus sp.[J]. Renewable Energy,2018,125:1049-1057.
[69]DEMUEZ M, MAHDY A, TOMS-PEJ E, et al. Enzymatic cell disruption of microalgae biomass in biorefinery processes[J]. Biotechnology and Bioengineering,2015,112(10):1955-1966.
[70]CHENG Y S, ZHENG Y, LABAVITCH J M, et al.Virus infection of Chlorella variabilis and enzymatic saccharification of algal biomass for bioethanol production[J]. Bioresource Technology,2013,137:326-331.
[71]KAVITHA S, KANNAH R Y, BANU J R, et al. Biological disintegration of microalgae for biomethane recovery-prediction of biodegradability and computation of energy balance[J]. Bioresource Technology,2017,244:1367-1375.
[72]KIM D Y, VIJAYAN D, PRAVEENKUMAR R, et al. Cell-wall disruption and lipid/astaxanthin extraction from microalgae: Chlorella and Haematococcus[J]. Bioresource Technology,2016,199:300-310.
[73]邓春芳,崔岩,成家杨,等.溶藻菌破碎微拟球藻细胞及其对油脂提取效果的影响研究[J].可再生能源,2017,35(11):1581-1587.
DENG Chunfang, CUI Yan, CHENG Jiayang, et al. The effects of algicidal bacteria on cell disruption and oil extraction of Nannochloropsis sp.[J]. Renewable Energy Resources,2017,35(11):1581-1587.
[74]DEMUEZ M,GONZALEZ-FERNANDEZ C, BALLESTEROS M. Algicidal microorganisms and secreted algicides: New tools to induce microalgal cell disruption[J]. Biotechnology Advances,2015,33:1615-1625.
[75]CHEN C Y, BAI M D, CHANG J S. Improving microalgal oil collecting efficiency by pretreating the microalgal cell wall with destructive bacteria[J]. Biochemical Engineering Journal,2013,81:170-176.
[76]LENNEMAN E M, WANG P, BARNEY B M. Potential application of algicidal bacteria for improved lipid recovery with specifificalgae[J]. FEMS Microbiology Letters,2014,354(2):102-110.
[77]WANG M, YUAN W Q. Bacterial lysis of microalgal cells[J]. Journal of Sustainable Bioenergy Systems, 2014,4:243-248.
[78]MUOZ C, HIDALGO C, ZAPATA M, et al. Use of cellulolytic marine bacteria for enzymatic pretreatment in microalgal biogas production[J]. Applied and Environmental Microbiology,2014,80(14):4199-4206.
收稿日期:2019-12-11;修回日期:2020-05-07;責任编辑:王淑霞
基金项目:河北省自然科学基金(C2016208052)
第一作者简介:刘俊果(1968-),女,河北冀州人,副教授,博士,主要从事生物产物分离提取与纯化方面的研究。
E-mail:1308676013@qq.com
刘俊果,董尧坤,张园园.
微藻细胞破壁方法研究进展
[J].河北科技大学学报,2020,41(3):257-267.
LIU Junguo, DONG Yaokun, ZHANG Yuanyuan.
Advances in microalgae cell wall disruption
[J].Journal of Hebei University of Science and Technology,2020,41(3):257-267.
