氟离子选择电极法测定玻璃陶瓷配合料中氟化物的含量
2020-07-14江湘辉
江湘辉

摘 要:配合料样品溶于水,其中的氟硅酸钠与纯碱反应,形成氟离子,吸取澄清溶液,使氟离子与沉淀物分离,溶液用酸中和过量的碱,并调节pH值到5.5,加入缓冲溶液,定容体积,通过离子选择电极法测定溶液中氟离子的含量。由工作曲线得到每个配合料样品的氟化物含量,计算各个配合料样品氟化物含量数据的相对标准偏差,判断批次配合料的均匀度是否合格。
关键词:配合料;氟离子选择电极法;均匀度
1 前 言
配合料均匀度是玻璃生产中混料环节的一个重要数据控制手段,对数据分析结果的要求是:准确度、稳定性和及时性,只有这些条件具备了,才能在正确判断的同时,跟上生产节奏,达到数据化控制生产质量的要求。
从表1中可以看到,当前应用较广的玻璃种类是钠钙玻璃,这类玻璃系统是:SiO2-R2O-RO,通常是通过酸碱反应来测定配合料中纯碱的含量,并以此数据来对配合料的均匀度进行判断。
玻璃陶瓷种类的玻璃系统是:SiO2-R2O-F-R2O3- RO。配合料中的氟硅酸钠,在水溶液中,能快速跟纯碱反应生成氟离子,反应原理:Na2SiF6+6Na2CO3=Na2SiO3 +6NaF+3H2O,所以无法用传统的酸碱反应来测定;而是通过测定溶液中氟离子的含量来获得氟硅酸钠含量的数据,并根据此数据判定配合料均匀度是否合格。
2 实验部分
2.1 试剂
(1)氟化物标准溶液
1)A标准溶液(1000mg/L),称取0.2210g在100℃烘干后的氟化钠基准物,用水溶解后,转移到100ml的聚乙烯容量瓶中,用水定容至刻度,摇混均匀。
2)B标准溶液(100mg/L),吸取10ml的A标准溶液到100ml聚乙烯容量瓶中,用水定容至刻度,摇混均匀。
(2)盐酸溶液1:1,量取100ml水和100ml浓盐酸,混均匀待用。
(3)酚酞溶液1%:称取1g酚酞,溶于100ml的乙醇中,混合均匀待用。
(4)缓冲溶液:称取294.1g的柠檬酸钠,溶于600ml水中,用1:1盐酸溶液调节pH值到5.5左右,用水定容到1L,溶液混合均匀,待用。
2.2 仪器及设备
(1)电子天平,精确度:0.01g;
(2)磁力搅拌器;
(3)离子计:梅特勒托利多Seven Compact台式PH/离子计,型号S220-F;
(4)电极:perfect IONTM复合氟离子选择电极。
2.3 标准曲线
(1) 分别吸取氟标准溶液:0ml,A标准溶液10ml,B 标准溶液2.5ml、5.0ml、7.5ml、10.0ml,于6个聚乙烯100 ml容量瓶中,加入50ml缓冲溶液,加水至刻度,混均匀。
(2) 打开离子计,参照仪器操作说明书测量各点的电位值,在操作过程中要注意事项:
a)确认空白电位值,测量不同浓度时用蒸馏水清洗干净电极,恢复到空白电位,再进行下一个样品的测量。
b)测量时,应按从低浓度开始到高浓度结束的顺序来进行。
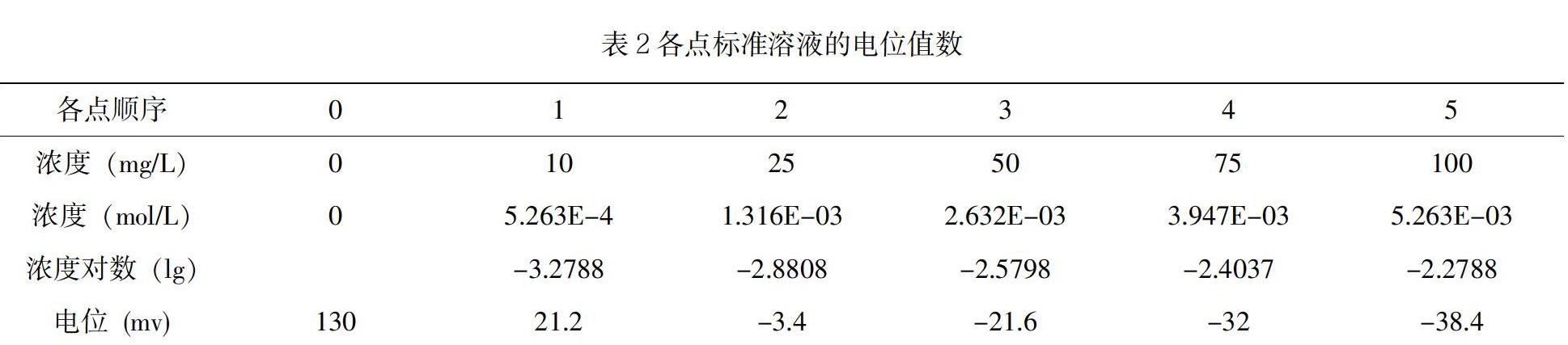
(3) 测得各点标准溶液的电位值数据,明细如表2所示。
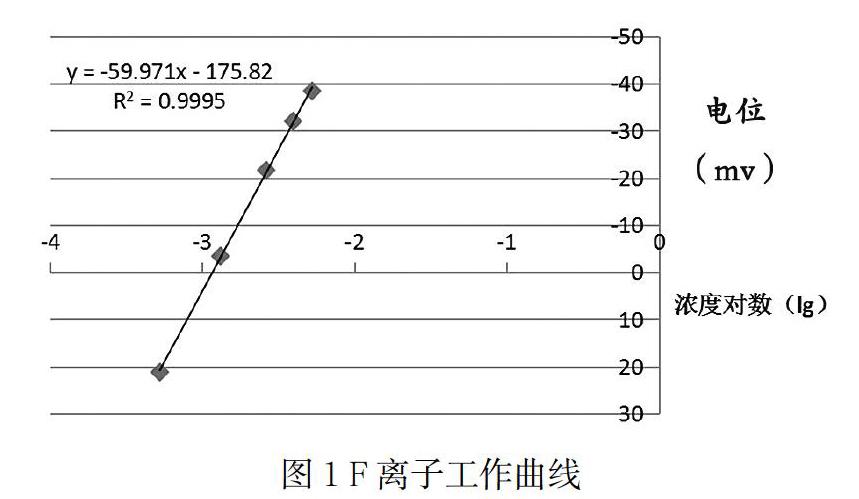
(4)用測量结果作工作曲线,如图1。
1) 从图中可见,方程式的斜率:-59.971。根据电极电位的能斯特方程式,F离子在标准状态下电极电位理论斜率为-59.16 ,两个数值是相接近的。
2) 相关系数是:0.9995,也体现了浓度范围在(10~ 100mg/L)时,电位值跟浓度对数之间存在的良好线性关系。
3) 通过以上两点,可以确保工作曲线的数值准确度与稳定性。
2.4 实验步骤
(1) 称取5g的配合料样品于聚乙烯烧杯中,加入约50ml的热水,烧杯放于磁力搅拌器上,充分搅拌并溶解15min,冷却后转移到500ml聚乙烯容量瓶,用水定容至刻度,静置10min;
(2) 吸取上层清液10ml溶液,滴入3滴酚酞指示剂,用盐酸溶液中和至无色并过量1滴;
(3) 加入50ml的缓冲溶液,定容到100ml的聚乙烯容量瓶,倒出部分测量液于聚乙烯烧杯中,放入氟离子电极,用离子计进行测量并得到电位值数据结果,测量过程中的注意事项参照2.3(2)步骤。
(4) 样品计算
计算公式:R=(R1×V/1000g)×100%
R——计算结果(%);
R1——由工作曲线查得到的对浓度值,并转化为重量单位(mg);
V——总体积,即测量液体积乘以放大体积的倍数(ml);
G——样品重量(g)。
2.5 分析结果
(1)不同样品的分析结果如表3所示。
a) 从表3中可见,在配合料中不同地点选取8个样品,按照2.4相关步骤进行操作,由计算公式得到各个配合料样品中氟硅酸钠的百分含量。8个样品的相对标准偏差数值是4.1%,小于5%,从而判定这批次配合料的均匀度是合格的。
b) 分析试验时间:本次试验从称取到判定结果出来,完成时间约1h。
(2)同一样品的平行分析结果如表4所示。
从表4可见,取配合料样品1号,按照2.4相关步骤进行操作,进行8次的平行样分析,得到样品1号的8个平行样分析结果,并计算出8个平行样的相对标准偏差为0.9。
3 实验讨论
3.1 配合料溶样条件
(1)配合料中氟化物原料有两种,分别是氟硅酸钠与氟化钙,其中氟硅酸钠微溶于水,溶于热水,氟化钙不溶于水。
(2)称取配合料1号样品,参照步骤2.4,改变加入热水体积和搅拌时间,来确定使氟硅酸溶解完全的效果条件,明细如表5所示。
从表5的实验情况,确定配合料溶解条件:时间15 min,热水50ml。在溶解完全的前提下,尽量节省时间。
3.2 干扰元素的处理
玻璃陶瓷配合料中含氢氧化铝、方解石,在进行步骤2.4(2)时,吸取的上层清液中,不可避免的存在微量的Al3+,Ca2+,这些干扰离子会与氟离子形成络合物,使检测结果偏低。通过加入一定量的柠檬酸钠缓冲溶液,与干拢离子发生络合反应来解决这个问题。缓冲溶液的用量确定,明细如表6所示。
通过表6,我们确定缓冲溶液加入量在50ml时,基本可以消除离子干拢。
3.3 酸度的控制
(1) 当滤液呈酸性时,H+会部分与F-结合,形成HF,使得F-无法全部被离子电极检测到。通过让测量液在测试前,将pH值调节至弱酸性,可避免这种情况影响。
(2) 当滤液呈碱性时,滤液中OH- 也产生干拢,因为氟电极同时会对OH- 和F-产生响应。所测得的电位值包含OH- 和F-,从而造成数据偏差。通过对测量液的pH值调节,避免这种情况影响。
(3) 通过采用与表6相似的方法,调节测量液的不同pH值,并测量出不同pH值与电位值的关系,得出pH值在5~6之间时可以消除H+和OH-影响的结论。最终把测量液的pH值确定在5.5。
3.4 回收率测试
称取配合料试样1号5g后,再称取加入不同重量的氟硅酸钠,共称取6个样品,实验步骤参照2.4进行,明细如表7所示。
从表7可见,回收率都处于正常合理范围。
4 结 论
本方法根据玻璃陶瓷配合料的特性,利用氟离子选择电极法测定,得到各个配合料样品含氟原料百分比含量,从而判定出该批配合料的均匀度是否合格;数据准确、稳定,操作简单,时间短,基本满足生产的数据控制要求。
参考文献
[1] 缪征明,仪器分析[M],北京,机械工业出版社,1984:445-572.
