新型便携式RGB色度传感器定量检测水中路易氏剂
2020-07-14于竞翔刘国宏任丽君刘萌黄志平李建李丹萍肖艳华
于竞翔 刘国宏 任丽君 刘萌 黄志平 李建 李丹萍 肖艳华

摘要基于路易氏剂及其水解产物在碱性条件下与亚铜离子反应,溶液呈红色的原理,构建了定量检测水中路易氏剂的新型便携式RGB色度传感器。对增溶剂、还原剂的种类、还原剂浓度、CuCl2浓度、NaOH浓度、乙酸用量、反应温度、反应时间等因素进行优化,得到最优反应条件: 增溶剂为明胶, 还原剂为盐酸羟胺, 盐酸羟胺浓度为0.32 mol/L, CuCl2浓度为0.15 mol/L, NaOH浓度为30%(m/m), 36%(m/m)乙酸用量为30 μL, 反应温度为室温, 反应时间为5 min。在检测中采用源于归一化RGB系统的RGB(红绿蓝)色度法,克服了基于RGB模型的由于光强变化会导致3个刺激值的变化的问题。在最优条件下,色度值与路易氏剂浓度的标准曲线的线性范围为0.40~10.05 mg/L。本方法对R值和B值的理论检出限为0.389 mg/L和0.391 mg/L,实际检出限为0.40 mg/L。将本方法应用于人工水样中路易氏剂的测定,回收率为96.9%~106.9%。本方法具有较高的选择性、灵敏度和较好的重复性。
关键词RGB色度传感器; 路易氏剂; 水
1引 言
路易氏剂是一种含砷的毒剂,其化学名称为2氯乙烯二氯砷(ClCH=CHAsCl2),属于卤代脂肪族胂化合物,曾被称为“死亡之露”[1,2]。路易氏剂具有细胞毒性、毛细血管毒性和神经毒性作用。路易氏剂通过与含有巯基的蛋白质,尤其是与酶结合发挥其毒性作用,选择性钝化糖代谢中某些含巯基的酶,因此可抑制丙酮酸氧化作用(糖代谢)的关键步骤;同时,路易氏剂的脂溶性也有助于其渗透皮肤,发挥其全身毒性作用[3]。路易氏剂除直接引起接触部位的细胞损伤,引发局部疼痛、起疱外,还可快速透过完整的皮肤和粘膜进入体内,对微血管有强烈的损伤作用,可引起广泛渗出、精神症状、低血压、水肿和明显出血等症状,甚至休克和死亡[4,5]。
尽管路易氏剂在使用和生产上受到禁止化学武器组织(OPCW)的许多限制,但由于其具有穿透力强、作用持久、中毒途径多、防护与消毒困难、生产容易、成本较低等特点,在化学战剂中具有重要地位[6]。由于路易氏剂与其它毒剂相溶,在配制战术混合剂时也具有一定的意义。路易氏剂自1918年发明以来,在各国受到了极大的关注和广泛的研究,某些国家进行大量装备,甚至用于战争中,而战后遗弃的化学武器, 对生态环境和人民的生命安全造成严重威胁[7]。
人类的生命活动离不开水源,饮用水系统可能成为恐怖分子袭击的对象。尽管路易氏剂微溶于水,在水中的溶解度为0.5 g/L,但已经达到饮用安全浓度的200倍以上[8]。路易氏剂遇水可发生水解,生成氯乙烯氧胂。氯乙烯氧胂在水中的溶解度小,路易氏剂液滴水解时,外层为氯乙烯氧胂包裹,阻碍了液滴内层的路易氏剂进一步水解,可造成水源的长期染毒。因此,当皮肤接触路易氏剂染毒水源,甚至饮用被污染水源都可引起中毒或者死亡,对周围民众、动物和牲畜等构成极大威胁。因此,研发灵敏、选择性检测水中路易氏剂的方法具有重要意义。
目前,检测水中路易氏剂常用的方法有紫外分光光度法[10]、气相色谱法[11,12]、柱后衍生液相色谱法[13,14]、高分辨质谱法[12]、中子诱导γ射线法[15]、激光拉曼光谱法[16]、原子发射光谱法[17]、无源远红外遥感法[18]、亚太赫兹波谱法[19]及一些联用方法[20]等。这些方法对于路易氏剂的痕量检测具有良好的灵敏度,但由于携带不便、操作复杂、成本高等缺点,存在一定的局限性。基于纳米材料[21]或荧光探针[22]的化学传感器也被应用于检测路易氏剂。这些传感器具有高敏感性和高选择性,可制成小型轻便的設备。但是,这些化学传感器或无法直接用于水中的路易氏剂的检测,或操作规程复杂。因此,需要建立一种便携、灵敏、高选择性和可靠的方法,对路易氏剂污染的水源进行现场检测。
由红色(R)、绿色(G)、蓝色(B)组成的RGB空间是基于光学原理的设备所采用的色彩空间[23]。RGB空间包含颜色和强度信息,被认为是应用最广泛且最容易被接受的颜色空间[24]。基于RGB原理的颜色设备,如扫描仪、数码相机、手机、网络摄像头等设备,因其光学和结构的特性,具有无需单色光源或者滤光片、可便携性、检测所得信息量较大等优点,在RGB检测中备受关注[25]。基于RGB原理的检测技术应用广泛,并且检测效果较好,主要用于金属离子(如Hg2+[26]、Ni2+[27]、Pb2+[27]、Ca2+[28]等)、无机物(如NH3[29]、CO2[29]、O2[30]、H2O2[31]等)、有机物(如胺[32]、多酚类物质[33]、血红蛋白[34]、色素[35]、易燃易爆物[36,37]等)等物质的检测。
本研究构建了一种便携、高灵敏度和高选择性检测水中路易氏剂的RGB色度传感器。路易氏剂及其水解产物在碱性条件下与Cu+反应,溶液呈红色。在LED光源的照射下,RGB色度传感器中颜色传感器用于检测特定颜色的光,并按红、绿、蓝三色光组成比例输出3个刺激值。在检测中采用源于归一化RGB系统的RGB色度法,克服了基于RGB模型的由于光强变化会导致3个刺激值的变化的问题。各通道的R、G、B色度值均与芥子气浓度呈线性关系。结果表明,此RGB色度传感器具有较高的灵敏度、稳定性和选择性。
2实验部分
2.1仪器与试剂
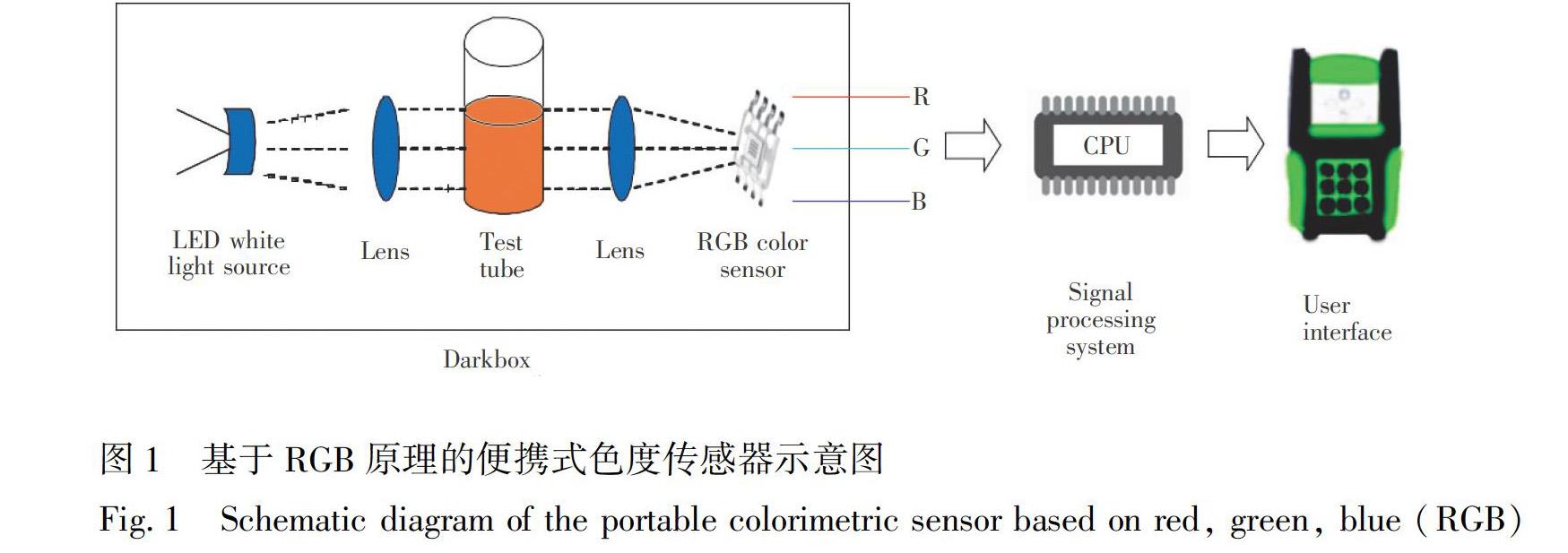
采用自行研制的便携式RGB色度传感器,如图1所示。此传感器选用白色发光二极管作为光源,可产生稳定连续的可见光。在光源和RGB颜色传感器之间,放置一根2 mL试管,试管中装有待测溶液。LED光源直接照射在试管上,RGB颜色传感器获得RGB的 3个刺激值。传感器中得到的数据可用于计算路易氏剂浓度。分别采用郑州沃特测试技术有限公司的ZZW加热器和上海精密仪器的pH计对溶液温度和pH值进行调节和测定。
2.2实验方法
向10 mL玻璃试管中,加入一定浓度的路易氏剂,依次滴加40 μL NaOH溶液和36%(w/w)乙酸,pH值控制在7~8之间,加入纯净水定容至1 mL。取还原剂3 mL和CuCl2溶液1 mL混合,配制4 mL亚铜溶液,加入1 mL明胶溶液。取配制好的亚铜溶液1 mL,加入路易氏剂水溶液中。显色后,将反应后的2 mL溶液转移到比色管中,插入检测口,测得溶液的RGB值,平行测量3次,取平均值。
此显色反应的机理如式(1)~(3)。路易氏剂及其水解产物氯乙烯氧胂遇碱分解产生乙炔。CuCl2提供Cu2+,在还原剂的作用下,Cu2+被还原为Cu+。生成的乙炔与Cu+作用,生成红色乙炔亚铜沉淀。
3结果与讨论
3.1 条件优化
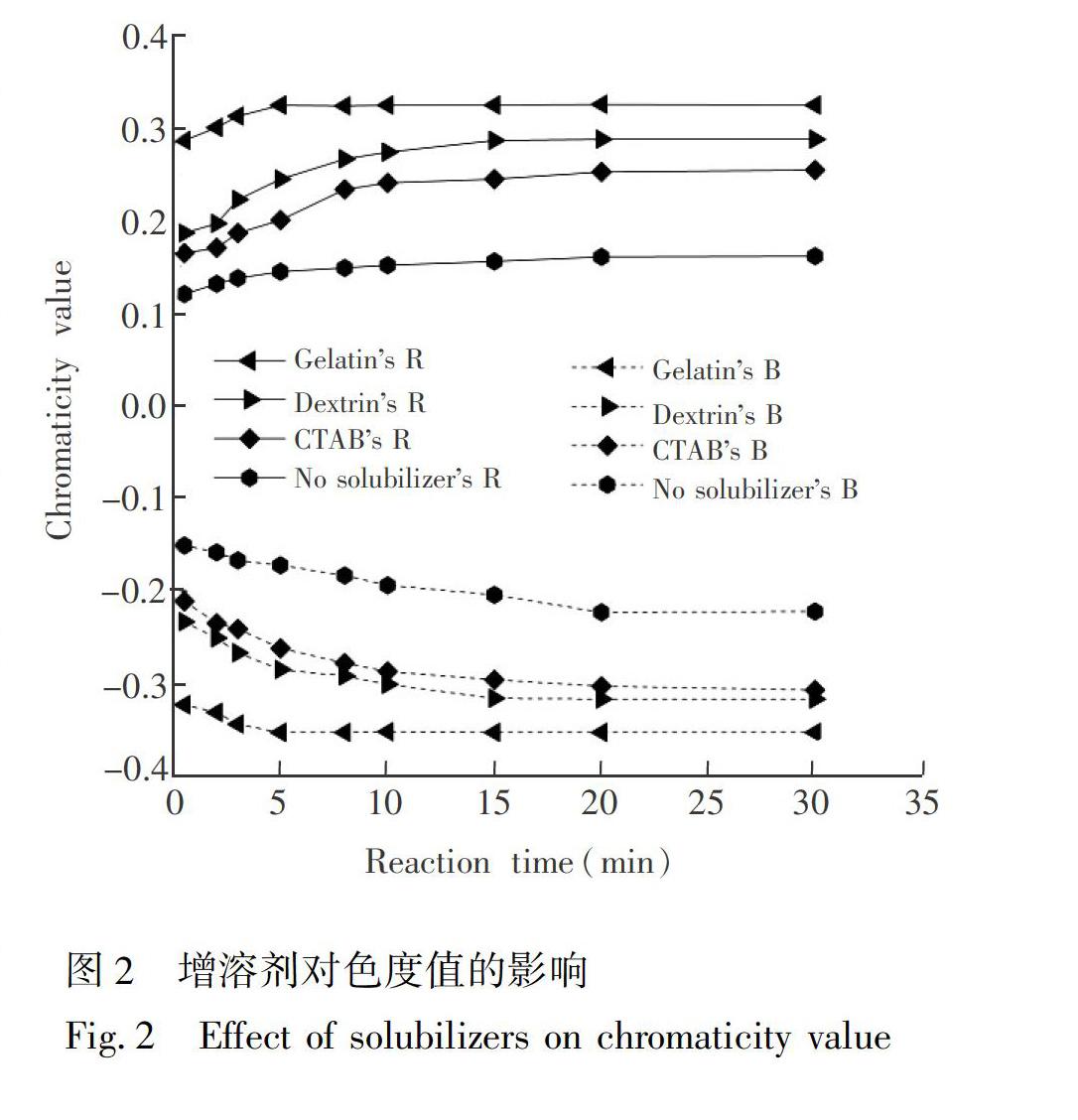
3.1.1增溶剂对乙炔亚铜溶解度的影响乙炔与亚铜试剂反应后生成砖红色的乙炔亚铜沉淀,乙炔亚铜为胶体物质,向溶液中添加增溶剂可增加乙炔亚铜的溶解度。为了比较增溶剂的作用,分别向亚铜溶液中加入5%(w/w)明胶(Gelatin)、糊精(Dextrin)和十六烷基三甲基溴化铵(CTAB)各1 mL,并测量其R、B色度值,测量结果见图2。由图2可见,加入增溶剂的R、B色度值优于不加入增溶剂的R、B色度值。
3.1.2还原剂种类对色度值的影响还原剂是影响反应产物颜色的关键因素。为了比较还原剂的作用,分别用0.43 mol/L的还原剂(盐酸羟胺、Na2SO3、Na2S2O3、KBH4、NaBH4)和1.47 mmol/L CuCl2溶液配制5组亚铜溶液, 各取1 mL,分别加入至8.04 mg/L路易氏剂溶液中。由图3可见,还原剂不同,显色溶液的显色效果显著不同。各显色剂的G值普遍较低,R色度值为正值,B色度值为负值,比较R值和B值可知,使用盐酸羟胺作为还原剂的效果最好。
3.1.3盐酸羟胺浓度对色度值的影响选取盐酸羟胺作为还原剂,在0.17~1.00 mol/L范围内,考察盐酸羟胺浓度对8.04 mg/L路易氏剂溶液检测效果的影响。由图4可见,随着盐酸羟胺的浓度的增大, 显色体系的色度值先增加后减小。当盐酸羟胺浓度为0.32 mol/L时,其相对应的色度值最高。当盐酸羟胺浓度大于0.32 mol/L时,反应体系色度值随之降低。后续实验中选择盐酸羟胺的浓度为0.32 mol/L。
3.1.4CuCl2浓度对色度值的影响在0.00015~0.45 mol/L范围内,考察CuCl2浓度对8.04 mg/L路易氏剂溶液检测效果的影响。实验结果表明,随CuCl2的浓度增大, 显色体系的色度值先增加后减小。当CuCl2浓度为0.15 mol/L时,其相对应的色度值为最高。当CuCl2浓度大于0.15 mol/L时,反应体系色度值随之降低。后续实验选择CuCl2浓度为0.15 mol/L。
3.1.5NaOH浓度对色度值的影响考察5%~40%(w/w)NaOH溶液对8.04 mg/L路易氏剂水溶液检测效果的影响。结果表明,随着NaOH的浓度的增加, 显色体系的色度值先增加后减小,当NaOH浓度为30%(w/w)时,其相对应的色度值为最高。后续实验中,选择NaOH的浓度为30%(w/w)。
3.1.636%乙酸用量对色度值的影响选取36%(w/w)乙酸调节路易氏剂与NaOH反应后溶液的pH值。考察36%乙酸用量(10~60 mL)对8.04 mg/L路易氏剂水溶液显色效果的影响。实验结果表明,随36%(w/w)乙酸的用量增大, 显色体系的色度值先增加后减小。当36%(w/w)乙酸用量为30 μL时,其相对应的色度值为最高。 因此,选择36%(w/w)乙酸的用量为30 μL。
3.1.7反应温度对色度值的影响温度是影响显色反应速率的关键因素。研究了不同温度(10℃、20℃、30℃、40℃、50℃、60℃)对8.04 mg/L路易氏剂水溶液显色效果的影响,测量结果见表1,显色效果的相对标准偏差(RSD)小于1%,温度对显色效果影响不大。因此,本研究选择在室温下进行测定。
3.1.8反应时间对色度值的影响在上述优化条件下,考察了反应时间(0.5、2、3、5、8、10、15、20、30、60和90 min)对检测结果的影响。结果表明,显色体系的色度值随着反应时间的延长而逐渐增大,并趋于平衡。当反应时间达到5 min时,色度值最大且稳定。因此,本研究选择反应时间为5 min。
3.2标准曲线
配制一系列不同浓度的路易氏剂溶液,在最优条件下进行测定,得到浓度范围为0.40~10.05 mg/L的路易氏剂标准溶液的标准曲线方程,如图5所示。结果表明,R、G和B值作为响应值,可用于测定水中的路易氏剂浓度。从每个颜色的坐标方程中可知,R值和B值的标准曲线用于测定水中的路易氏剂浓度具有较好的效果,而G值的标准曲线的斜率较小,检测效果相对不佳。
3.3重复性和检出限配制不同浓度路易氏剂溶液,在最佳条件下对1.41和7.03 mg/L的路易氏剂溶液进行10次平行实验。对于1.41 mg/L路易氏剂, R色度值的RSD=1.60%,B色度值的RSD=1.85%;对于7.03 mg/L路易氏剂,R色度值的RSD=0.93%,B色度值的RSD=1.36%,RSD均小于2%,因此,RGB色度法检测路易氏剂的方法是可行的。
通过测量空白的色度值(n=20),计算空白的标准差,其中R为0.00454,B为0.00482。根据IUPAC规定的以3倍的标准偏差计算检出限。通过计算得到本方法对R值和B值的理论检出限分别为0.389和0.391 mg/L。由于G值随路易氏剂浓度变化较小,本研究只計算了R和B值的检出限。在实验中,实际检出限为0.40 mg/L。
3.4干擾研究
为了探究本方法对水中路易氏剂的快速定性与定量检测能力,考察了本方法对水中常见离子的抗干扰能力,同时也需研究本方法对其它毒剂的敏感响应是否影响到对路易氏剂的检测。 在最佳的实验条件下,考察了不同因素对测量8.04 mg/L路易氏剂的影响。
4结 论
基于RGB色度法,建立了水中路易氏剂的快速定量检测方法。实验结果表明,本方法具有较高的选择性、灵敏度和较好的重复性,并成功应用于人工水样中路易氏剂的测定。本方法在分析环境中有毒有害物质方面具有潜在的应用前景。
[HT5”SS][HJ*4]表3饮用水中路易氏剂浓度回收实验结果
Table 3Recovery experiment results of Lewisite in drinking water samples (n=4)
[HT6SS][BG(][BHDFG4,WK4,WK8。3W]No.加入值Added(mg/L)测定值Found(mg/L)回收率Recovery(%)1[]0.51
0.54±0.01106.92[]2.242.17±0.0296.93[]8.508.40±0.0298.8[BHDFG1*2,WKZQ0W][BG)W][HT5][HJ]
References
1Goldman M, Dacre J C. Rev. Environ. Contam. Toxicol., 1989, 110: 75-115
2Vilensky J A, Redman K. Ann. Emerg. Med., 2003, 41(3): 378-383
3Athar M, Li C, Srivastava R K. J. Invest. Derm., 2015, 135: S98
4Goswami D G, Agarwal R, TewariSingh N. Toxicol. Lett.,2018, 293: 112-119
5TewariSingh N, Goswami D G, Kant R, Ammar D A, Kumar D, Enzenauer R W, Casillas R P, Croutch C R, Petrash J M, Agarwal R. Toxicol. Sci.,2017, 160(2): 420-428
6Winkler J R. J. Mil. Hist., 2007, 71(2): 547-548
7Isono O, Kituda A, Fujii M, Yoshinaka T, Nakagawa G, Suzuki Y. Toxicol. Lett., 2018, 293: 9-15
8Vucinic S, Antonijevic B, Tsatsakis A M, Vassilopoulou L, Docea A O, Nosyrev A E, Izotov B N, Thiermann H, Drakoulis N, Brkic D. Environ. Toxicol. Pharmacol.,2017, 56: 163-171
9Choi S K, Jeong Y S, Koh Y J, Lee J H, Nam H W, Lee J. Bull. Kor. Chem. Soc., 2019, 40(3): 279-284
10Cheh M Y, Chua H C, Hopkins F B, Riches J R, Timperley C M, Lee H S N. Anal. Bioanal. Chem., 2014, 406(21): 5103-5110
11Naseri M T, Shamsipur M, Babri M, Saeidian H, Sarabadani M, Ashrafi D, Taghizadeh N. Anal. Bioanal. Chem.,2014, 406(21): 5221-5230
12Palcic J D, Jones J S, Flagg E L, Donovan S F. J. Anal. At. Spectrom., 2015, 30(8): 1799-1808
13Okumura A, Takada Y, Watanabe S, Hashimoto H, Ezawa N, Seto Y, Sekiguchi H, Maruko H, Takayama Y, Sekioka R, Yamaguchi S, Kishi S, Satoh T, Kondo T, Nagashima H, Nagoya T. Anal. Chem., 2015, 87(2): 1314-1322
14Stanelle R D, McShane W J, Dodova E N, Pappas R S, KobelSki R J. J. Anal. Toxicol., 2010, 34(3): 122-128
15Carffrey A J, Cole J D, Gehrke R J. T. Nucl. Sci. IEEE, 1992, 39(5): 1422-1426
16Bahfenne S, Frost R L. Radiat. Eff. Defect. S., 2010, 165(1): 46-53
17Zhou L M, Zhou J M, Liu B, Dong J J, Lu S L, Lu C H. Int. Conf. Bioinform. Biomed. Eng. IEEE(ICBBE), 2008: p2942-2944
18Zhang Y P, Wang H T, Zhang L, Yang L, Guo X D, Bai Y. Spectrosc. Spect. Anal., 2015, 35(2): 466-469
19Vaks V L, Domracheva E G, Nabiev S S, Chemyaeva M B, Babakov A M. Atmos. Ocean. Optics, 2013, 26(1): 1-4
20Valdez C A, Leif RN, Hok S, Hart B R. Rev. Anal. Chem.,2018, 37(1): 1-26
21Bucur I, Serban S, Surpateanu A, Cupcea N, Viespe C, Grigoriu C , Toader C N, Grigoriu N. 33rd. Int. Semicond. Conf. IEEE , 2010: 209-212
22Lee D H, Lee D N, Hong J I. New J. Chem., 2016, 40(11): 9021-9024
23Park D S, Choi S Y, Lee H Y, Kim Y T, Hong J Y, Kim C Y. Proc. IEEE, 2013, 101(1): 18-30
24Broadbent A D. Color Res. Appl.,2004, 29(4): 267-272
25Apyari V V, Gorbunova M V, Isachenko A I,Dmitrienko S G, Zolotov Y A. J. Anal. Chem.,2017, 72(11): 32-37
26Li L, Zhang L P, Zhao Y, Chen Z B. Mirochim. Acta, 2018, 185(4): 235-240
27Feng L, Zhang Y, Wen L Y, Chen L, Shen Z, Guan Y F. Analyst, 2011, 136(20): 4197-4203
28LopezMolinero A, Cubero V T, Irigoyen R D, Piazuelo D S. Talanta, 2013, 103(21): 236-244
29Chen Y, Zilberman Y, Mostafalu P, Sonkusale S R. Biosens. Bioelectron.,2015, 67: 477-484
30LópezRuiz N, MartínezOlmos A, Pérez de VargasSansalvador I M, FernándezRamos M D, Carvajal M A, CapitanVallvey L F. Sens. Actuators B, 2012, 171172: 938-945
31Nitinaivinij K, Parnklang T, Thammacharoen C, Ekgasit S, Wongravee K. Anal. Methods,2014, 6(4): 9816-9824
32Steiner M S, Meier R J, Duerkop A, Wolfbeis O S. Anal. Chem.,2010, 82(20): 8402-8405
33Alimelli A, Filippini D, Paolesse R, Moretti S, Ciolfi G, DAmico A, Lundstrm I, Natale C D. Anal. Chim. Acta, 2007, 597(1): 103-112
34Yang X X, Piety N Z, Vignes S M, Benton M S, Kanter J, Shevkoplyas S S. Clin. Chem.,2013, 59(10): 1506-1513
35Belyaeva E I, Zrelova L V, Marchenko D Y, Dedov A G. Pet. Chem.,2015, 55(1): 74-79
36Kehoe E, Penn R L. J. Chem. Educ.,2013, 90(9): 1191-1195
37Botelho B G, de Assis L P, Sena M M. Food Chem.,2014, 159(6): 175-180
