基于单颗粒电感耦合等离子体质谱技术的金纳米颗粒准确测定和表征
2020-07-14巢静波王静如张靖其
巢静波 王静如 张靖其
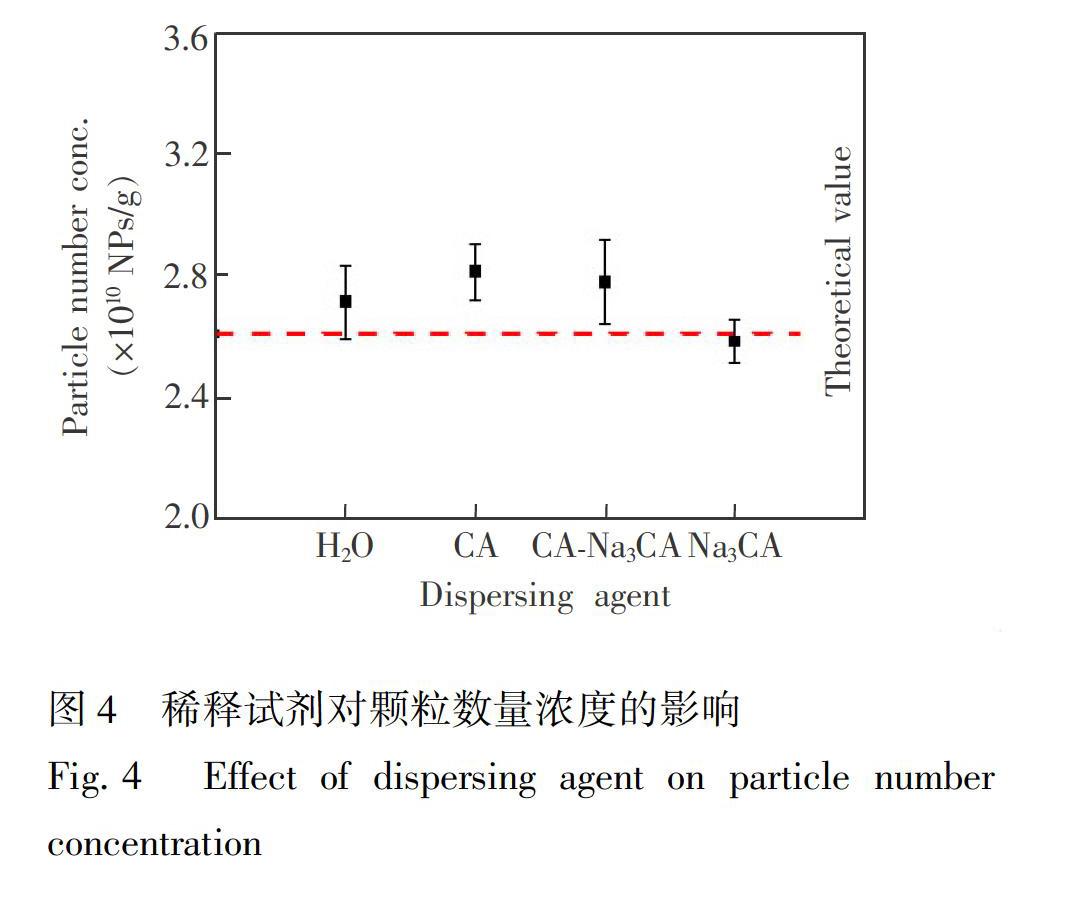
摘要建立了基于单颗粒电感耦合等离子体质谱(SPICPMS)技术的金纳米颗粒(AuNPs)数量浓度和粒径的准确测定方法, 考察了传输效率计算方式、驻留时间、稀释试剂、进样方式等对测定结果的影响。传输效率对结果准确度影响较大, 应根据测量目标参数选择传输效率计算方式, 并在测定过程中保持传输效率的稳定, 利用校准标准对其进行校正。驻留时间的选择直接影响结果的精确程度, 应根据样品类型、粒径等性质慎重选择数据处理模式。当驻留时间为0.1 ms时, 检测30 nm和60 nm AuNPs的线性范围分别为2~40 pg/g和10~200 pg/g, 线性相关系数大于0.9998, 数量浓度测定结果的相对标准偏差小于3.80%, 颗粒数量浓度和粒径的检出限分别为110 NPs/g和9 nm。对合成的4种AuNPs和国际比对样品分别进行了测定, 国际比对样品颗粒数量浓度结果与比对参考值偏差<5%, 测定结果等效一致, 扩展不确定度<15% (k=2), 进一步验证了本方法的准确度和适用性。
关键词颗粒数量浓度; 粒径; 金纳米颗粒; 单颗粒电感耦合等离子体质谱法
1引 言
近年来, 含有纳米材料的产品逐步进入市场且数量逐年增加[1], 其中, 金纳米颗粒(AuNPs)由于其独特的表面效应与小尺寸效应, 广泛用于生物标记、药物载体、癌症治疗等领域。AuNPs可在大鼠的肝脏、脾脏、肾脏大量积累[2], 诱导DNA损伤并增加红细胞核异常的频率[3]。目前, 针对纳米材料在生物体中作用机理的研究尚少, 其经过环境及生物体内的迁移转化是否仍然安全尚需进一步研究[4], 主要的技术难点是缺乏有效的实际生物及环境样品中痕量纳米材料(ng/L级)的准确定量和表征技术。因此, 可靠、准确的复杂基体中纳米材料的定量、追踪和表征技术是纳米科技风险评估的关键[5]。
纳米材料的潜在风险引起了世界各国及区域组织的广泛关注, 欧盟委员会在2011年对纳米材料进行了界定[6], 即“天然、非目的性加入或者人工制造的含有非结合态、聚集或团聚状态的, 粒径分布占50%以上, 有一维或多维尺度在1~100 nm范围内的材料”。另外, 欧盟也出台了化妆品相关指令(EC 1223/2009)[7], 规定在化妆品中使用的纳米材料, 必须在标签中进行标识。可见, 常规的浓度检测已不能满足相关要求, 还必须对纳米材料的颗粒数量浓度、粒径、粒径分布、存在状态等进行检测和表征。单颗粒电感耦合等离子体质谱(Single particleinductively coupled plasmamass spectrometry, SPICPMS)技术是近年出现的納米颗粒粒径、颗粒数量浓度、质量浓度和聚集状态的分析方法[8~11], 其结合了形态鉴别和定量分析双重优势, 具有灵敏度高、直观性强等特点[12], 针对纳米材料的定义有望成为相关法规的标准方法。自Degueldre等[13]提出单颗粒分析的理论基础以来, SPICPMS已用于废水[14]、化妆品[15]、动物组织[16]等基体中纳米颗粒的测定, 对粒径的测定可采用TEM进行验证, 但对颗粒数量浓度仍缺乏有效的确认方法。欧盟标准物质和测量研究院联合研究中心(IRMM JRC)对不同实验室采用SPICPMS测定纳米银粒径、质量浓度和颗粒数量浓度的结果进行评估和考察[17], 结果表明, 实验室间再现性较差, 需对该方法进一步改进。2015年, 美国国家标准与技术研究院(NIST)以AuNPs标准物质为样品, 组织了实验室间比对, 以评估SPICPMS方法对粒径检测结果的重现性、精密度、准确度等方法性能参数[18], 结果表明, 各实验室间对AuNPs粒径的检测结果一致, 但对于AuNPs颗粒数量浓度的测定仍存在一些困难, 有必要进一步对颗粒数量浓度的准确测定及相关不确定度来源进行考察和分析。
为应对相关指令和法规的实施, 2017年国际计量局物质量咨询委员会(CCQM)开展了以AuNPs为目标物的定量和表征方法国际研究型比对(CCQMP194), 由英国政府化学家实验室(LGC)主导, 该比对旨在评价多种方法检测单分散AuNPs颗粒数量浓度的能力。本研究采用SPICPMS技术检测AuNPs, 重点对仪器参数和实验条件进行选择和优化, 分析传输效率计算方式对颗粒数量浓度和粒径的影响, 建立基于化学手段的单分散AuNPs颗粒数量浓度和粒径的准确测定方法, 并以计量学手段开展不确定度评定, 通过合成样品和CCQM国际比对样品的测定验证其准确性和适用性。
2实验部分
2.1仪器与试剂
8800型及8900型三重四极杆电感耦合等离子体质谱仪(QQQICPMS, 美国安捷伦公司), 配有数据采集及处理软件(MassHunter Workstations)和单颗粒分析模块; TEM(JEOL JEM2100F, Japan); XP205型电子分析天平(瑞士MettleToledo公司); 超纯水机(美国MilliQ公司); 50 mL石英瓶和聚丙
2.2SPICPMS相关原理
SPICPMS技术最初由Degueldre等[13]表征水溶液中胶体时提出, Pace等[20]的工作证明了其表征纳米颗粒的潜力。其原理为:在时间分辨(TRA)模式下, 离子云依次在检测器产生脉冲信号, 脉冲信号数量与颗粒数量浓度成正比, 信号强度与颗粒质量或粒径成正比。Pace等[20]通过公式(1)计算纳米颗粒数量浓度NNP (NPs/g), 由公式(2)建立质量强度曲线, 由纳米颗粒强度信号值通过曲线信息求得颗粒质量W (μg), 计算方式见公式(3)。 假设纳米颗粒为实心球形, 可根据公式(4)计算纳米颗粒粒径d (nm)。
3.3方法性能參数
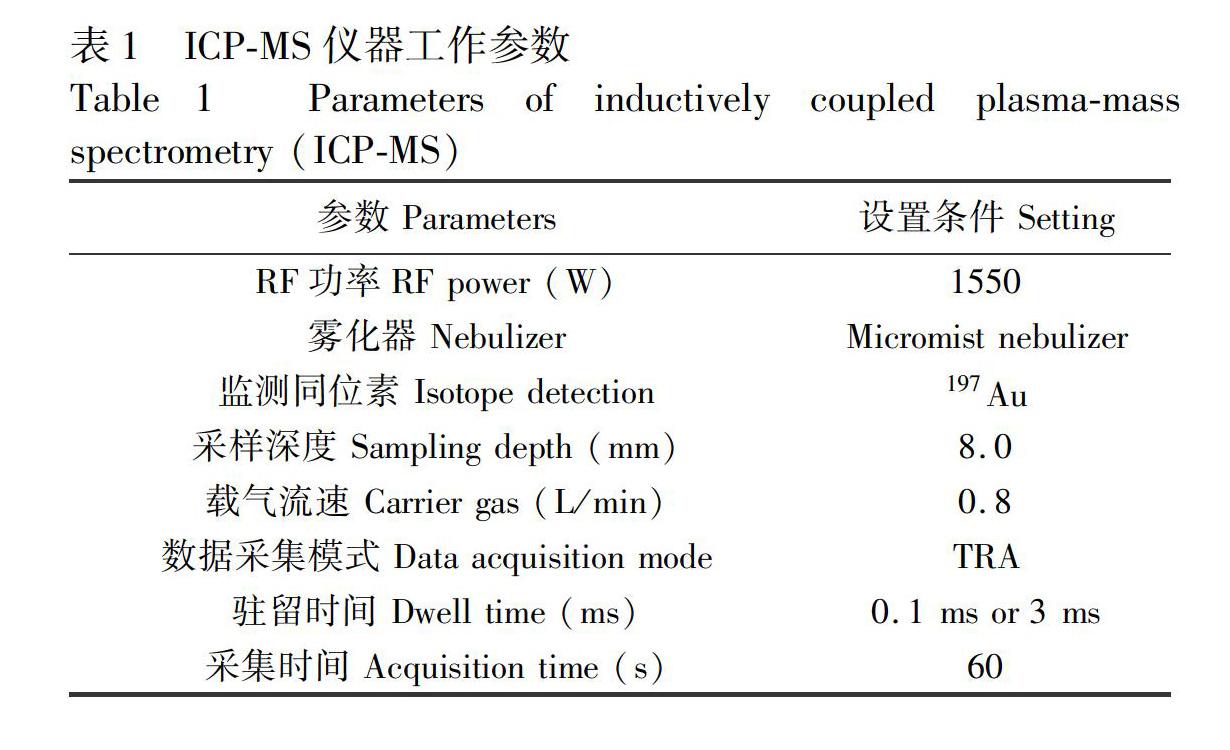
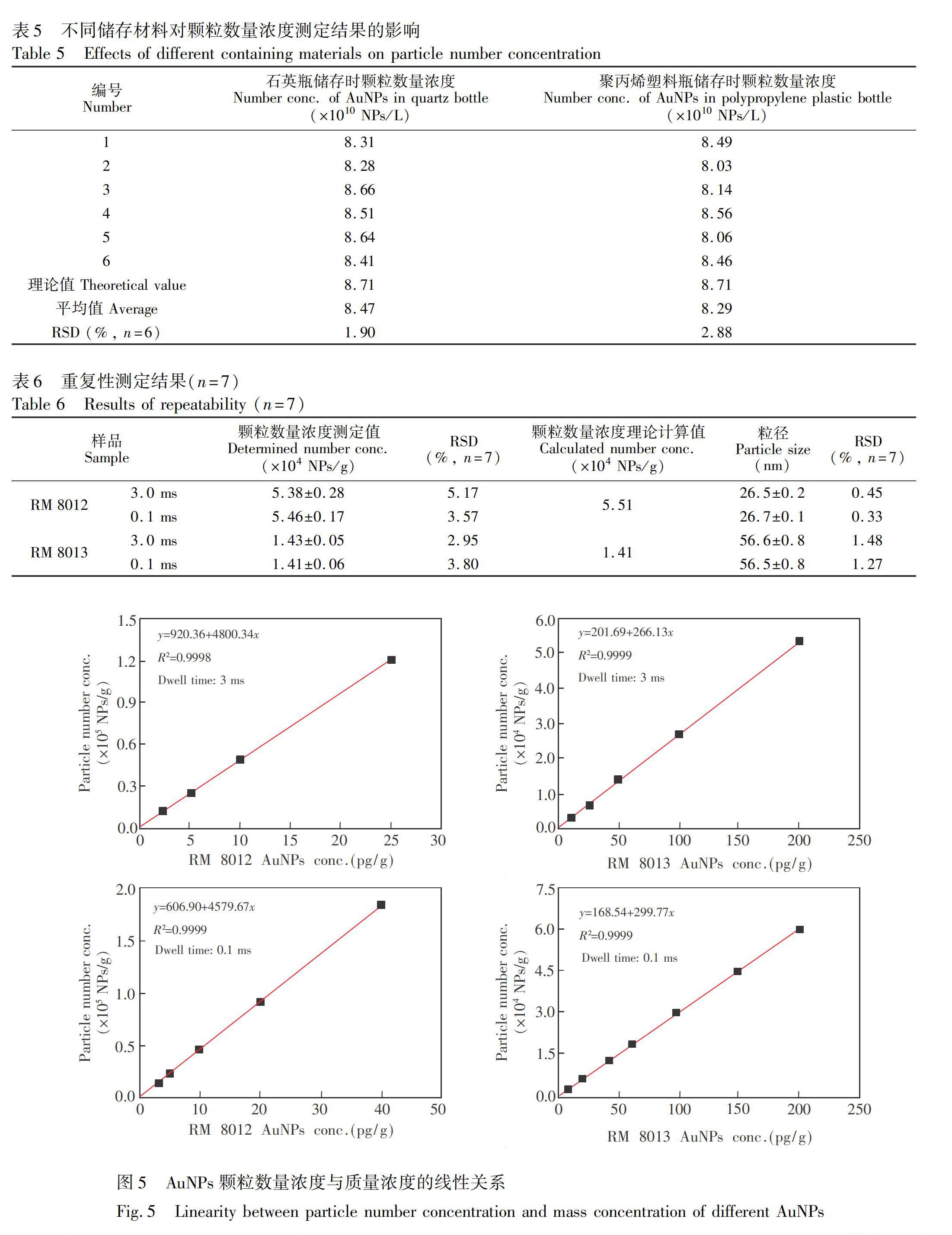
3.3.1方法的准确度和重复性配制10 pg/g RM 8012和25 pg/g RM 8013AuNPs分散液, 以RM 8012为标准, 重复测定7次, 测定结果见表6, 粒径结果与标称值吻合, RSD<1.5%。由不同驻留时间获得的颗粒数量浓度的准确度可知, 0.1 ms驻留时间下的准确度较3 ms有所提高, 与颗粒浓度理论计算值偏差<3%, 3 ms驻留时间可满足常规实验要求。
3.3.2方法的线性关系配制不同浓度的RM 8012和RM 8013溶液, 重复测定3次, 线性关系如图5所示。对于30 nm样品, 驻留时间为3 ms时, 在2~25 pg/g范围内, 颗粒数量浓度与质量浓度的线性相关系数≥0.9998, 高于25 pg/g时, 标准曲线出现弯曲; 驻留时间为0.1 ms时, 线性范围上限可扩展到40 pg/g。对于60 nm样品, 驻留时间为3和0.1 ms时, 在10~200 pg/g范围内, 颗粒数量浓度与质量浓度的线性相关系数均为0.9999。
3.3.3方法的检出限SPICPMS的粒径检出限(LODd) [24]和颗粒数量浓度检出限(LODNP)[25], 可由公式(7)和(8)分别求出:
其中, ρ为纳米颗粒的密度, XM为纳米颗粒的质量分数, KICPMS为检测效率(检测到的离子与进入ICP离子的比值), KM =ANAV/mM, 其中A为原子的同位素丰度, NAV为阿伏伽德罗常数, MM为原子质量, ti为采样时间。 除了溶解态离子或背景对粒径检出限的影响外, 还包括检测效率的影响, 该参数取决于具体的测定仪器。由公式(8)可知, 颗粒数量浓度的检出限与传输效率、样品流速和采集时间有关。经计算, 颗粒数量浓度的检出限为110 NPs/g, 粒径检出限为9 nm。
3.4样品分析结果
采用本方法分别测定比对样品和合成样品, 结果见表7。合成AuNPs的粒径结果与TEM表征结果偏差在Symbolm@@4.5~4.5 nm之间(图6), 国际比对样品粒径测定结果与30 nm的标称值基本一致; 颗粒数量浓度的测定结果与关键比对参考值偏差<5%, 在比对参考不确定度范围内, 测定结果等效一致。
4结 论
建立了一种准确测定单分散AuNPs颗粒数量浓度和粒径的方法, 考察了传输效率计算方式、驻留时间、稀释试剂等对测定结果的影响。以颗粒数量计算传输效率的方式测定颗粒数量浓度, 驻留时间为0.1和3 ms时, 偏差<3%, 满足常规实验需求。采用本方法对合成的4种粒径AuNPs和CCQMP194比对样品进行测定, 颗粒数量浓度检测结果与理论值和关键比对参考值吻合, 粒径检测结果与TEM结果一致。国际比对颗粒数量浓度的检测结果等效一致, 扩展不确定度<15%, 与欧美国家计量机构不确定水平相当。本研究采用化学手段进行AuNPs颗粒数量浓度国际研究型计量比对, 评估了方法的性能参数和不确定度水平, 可为其它典型金属纳米颗粒的准确测定和表征提供参考。
References
1CPI Home. An Inventory Nanotechnologybased Consuner Products Introduced on the Market, http://www.nanotechproject.org/cpi/, 2014
2Alkilany A M, Murphy C J. J. Nanopart. Res., 2010, 12(7): 2313-2333
3Balasubramanian S K, Jittiwat J, Manikandan J, Ong C N, Yu L E, Ong W Y. Biomaterials, 2010, 31(8): 2034-2042
4Barreto A, Luis L G, Pinto E, Almeida A, Paiga P, Santos L, DelerueMatos C, Trindade T, Soares A, Hylland K, Loureiro S, Oliveira M. Chemosphere, 2019, 220: 11-19
5Klaine S J, Alvarez P J J. Environ. Toxicol. Chem., 2008, 27(9): 1825-1851
62011/696/EU, Commission Recommendation of 18 October 2011 on the Definition of Nanomaterial. Official Journal of the European Union
7Regulation (EC) No 1223/2009 of the European Parliament and of the Council of 30 November 2009 on Cosmetic Products, Official Journal of the European Union
8Meermann B, Nischwitz V. J. Anal. At. Spectrom., 2018, 33(9): 1432-1468
9WANG Juan, YAO JiJun. Environ. Chem., 2017, 36(12): 2749-2750
王 娟, 姚继军. 环境化学, 2017, 36(12): 2749-2750
10LUO RuiPing, ZHENG LingNa, LI Liang, WANG Juan, FENG WeiYue, YU XiangHua, WANG Meng. Chinese J. Anal. Chem., 2018, 46(6): 925-930
罗瑞平, 郑令娜, 李 亮, 王 娟, 丰伟悦, 喻湘华, 王 萌. 分析化学, 2018, 46(6): 925-930
11Laborda F, JiménezLamana J, Bolea E, Castillo J R. J. Anal. At. Spectrom., 2011, 26(7): 1362-1371
12CostaFernández J M, MenéndezMiranda M, BouzasRamos D, Encinar J R, SanzMedel A. TrACTrends Anal. Chem., 2016, 84: 139-148
13Degueldre C, Favarger P Y. Colloids Surf. A, 2003, 217(13): 137-142
14Donovan A R, Adams C D, Ma Y, Stephan C, Eichholz T, Shi H. Chemosphere, 2016, 144: 148-153
15Lu P J, Fang S W, Cheng W L, Huang S C, Huang M C, Cheng H F. J. Food Drug Anal., 2018, 26(3): 1192-1200
16Stefan W, Ruud P, Katrin L, Ringo G, Thomas P J L. Anal. Bioanal. Chem., 2017, 409: 4839-4848
17Thomas P J L, Ruud P, Stefan W. Anal. Bioanal. Chem., 2014, 406: 3835-3843
18Antonio R M B, Elijah J R, Antonio P, Michael R W. Anal. Chem., 2015, 87: 8809-8817
19Bastús N G, Comenge J, Puntes V. Langmuir, 2011, 27(17): 11098-11105
20Pace H E, Rogers N J, Jarolimek C, Coleman V A, Higgins C P, Ranville J F. Anal. Chem., 2011, 83(24): 9361-9369
21YANG Yuan, LONG ChenLu, YANG ZhaoGuang, LI HaiPu, WANG Qiang. Chinese J. Anal. Chem., 2014, 42(11): 1553-1560
楊 远, 龙晨璐, 杨兆光, 李海普, 王 强. 分析化学, 2014, 42(11): 1553-1560
22Montao M D, Olesik J W, Barber A G, Challis K, Ranville J F. Anal. Bioanal. Chem., 2016, 408(19): 5053-5074
23AbadAlvaro I, PenaVazquez E, Bolea E, BermejoBarrera P, Castillo J R, Laborda F. Anal. Bioanal. Chem., 2016, 408(19): 5089-5097
24Mitrano D M, Lesher E K, Bednar A, Monserud J, Higgins C P, Ranville J F. Environ. Toxicol. Chem., 2012, 31(1): 115-121
25Laborda F, JiménezLamana J, Bolea E, Castillo J R. J. Anal. At. Spectrom., 2013, 28(8): 1220-1232
