葡萄籽原花青素对山羊精液低温保存效果的影响
2020-07-14李方舟张利坤杜烨青陈美杰胡建宏
李方舟,李 宇,张利坤,杜烨青,温 飞,陈美杰,胡建宏*
(1.西北农林科技大学 动物科技学院,陕西 杨凌 712100;2.杨凌职业技术学院,陕西 杨凌 712100)
精子在保存过程中不断代谢,会产生超氧阴离子、过氧化物、ROS、NO等产物,这些产物可使精子发生脂质过氧化反应,严重影响精液保存质量[1]。因此,稀释液中常添加一些高效抗氧化剂,以抑制精子脂质氧化程度,减少精子损伤。葡萄籽原花青素是植物来源中至今发现抗氧化性最高的物质之一。剧红梅等[2]报道称,葡萄籽原花青素参与了磷酸与花生四烯酸的代谢过程、蛋白质的磷酸化反应,因而能够降低细胞脂质过氧化程度,从而减少细胞损伤;金文泉[3]研究表明,葡萄籽原花青素的抗氧化性可达VC的20倍、VE的50倍,可有效清除羟基自由基、超氧阴离子自由基。
1 材料与方法
1.1 试验材料
1.1.1 试验试剂 精液基础稀释液(详见1.3.1稀释液配制)、葡萄籽原花青素、碘化丙啶(PI)、罗丹明123、姬姆萨染液、总抗氧化能力(T-AOC)试剂盒、丙二醛(MDA)试剂盒。
1.1.2 精液样品的采集 试验精液来源于西北农林科技大学畜禽生态养殖场的西农萨能奶山羊。公羊年龄2~3岁,体况良好且无生殖系统疾病。采精完毕后,先根据颜色、气味选择正常精液放入保温杯中,1 h内带回实验室。37 ℃下显微镜镜检,选择精子活率≥0.8 的精液用于试验。
1.2 试验设计
试验设一个空白对照组,四个试验处理组。空白组为基础稀释液,四个处理组在基础稀释液中分别添加浓度10、30、50、70 mg/L的葡萄籽原花青素。将空白组及各处理组稀释液稀释精液后于4 ℃冰箱低温保存。于0 d、1 d、2 d、3 d、4 d、5 d检测精子活率、顶体完整率、质膜完整率;第0 d、1 d、3 d、5 d检测精子线粒体活性;1 d、3 d、5 d检测精子T-AOC、MDA。
1.3 试验方法
1.3.1 稀释液配制 基础稀释液配制:葡萄糖1.15 g,D-果糖1.45 g,PVA 0.25 g,EDTA 0.23 g,柠檬酸钠1.17 g,碳酸氢钠0.125 g,100 mL双蒸水溶解。青霉素10万IU,链霉素10万IU,卵黄20%现用现配。抗氧化剂添加:将基础稀释液分为5组,向每组稀释液中分别添加浓度0、10、30、50、70 mg/L的葡萄籽原花青素,在37 ℃水浴锅水浴30 min。水浴后室温冷却,放置4 ℃冰箱中低温保存。
1.3.2 精液的稀释 采精前将卵黄、抗生素分别加入各试验组稀释液中,封好口,置于37 ℃水浴锅中保温。采精后,将检查合格的精液平均分为5份,再分别按照精液:稀释液=1∶8的比例同温稀释。采取逐渐稀释法进行(操作时须把稀释液沿着管壁缓慢加入到各组精液中),先用精液和稀释液1∶1 稀释(摇匀),进一步再做精液与混合液1∶3 稀释(摇匀),使精液和稀释液比例最终达到1∶8。稀释结束后检测各组精液质量指标(0 d),然后用厚毛巾包裹盛有稀释后精液的离心管,放入4 ℃冰箱保存。保存过程中注意每隔12 h轻摇精液,防止精液沉积在离心管底部;每24 h从各试验组取样检测保存后相关指标。
1.4 精液质量指标检测
1.4.1 精子活率测定 轻摇精液混匀,用移液枪吸取精液 1 mL于离心管中,放入水浴锅中缓慢升温至37 ℃,37 ℃下再水浴1 min,然后吸取精液10 μL滴到载玻片(有37 ℃恒温加热板)上,制片,用显微镜观察5个视野的精子直线运动状况,各视野至少保证有200个精子,记录数据。
1.4.2 质膜完整率测定 用分析天平按照柠檬酸钠浓度 7.35 g/L、果糖浓度13.5 g/L,准确称取柠檬酸钠和果糖,然后溶于双蒸水中,制成柠檬酸钠-果糖低渗溶液。分别将各组稀释后保存的精液1 mL,与9 mL 低渗液混合,置于37 ℃水浴锅中水浴30 min,注意水浴期间需要轻晃试管,避免精子沉积。水浴结束后,吸取15 μL精液,滴于载玻片制片。显微镜下先于40倍下找到精子,后于400倍下观察精子弯尾现象,计算弯尾率(观察重复5次,每次不少于200个精子)。
1.4.3 顶体完整率测定 用姬姆萨染色法进行精子顶体完整率检测。从各试验组吸取精液30 μL,滴于载玻片上制片,使其风干5 min;然后吸取福尔马林溶液滴于风干的精液上,并要完全覆盖;30 min后将载玻片置于蒸馏水下,冲洗,再风干;再吸取姬姆萨溶液滴对精子染色,2 h后用蒸馏水洗去多余浮色,再次风干;最后将载玻片置于1000倍显微镜下镜检,观察顶体状态并计算精子顶体完整率,共观察5个视野,每个视野精子数不少于200个。
1.4.4 线粒体活性测定 将1 μL PI 贮存液和1 μL Rh123 贮存液混合放入试管,避光静置10 min,将精液用等温稀释液稀释,调整精子密度。然后移液枪吸取50 μL精子加入上述避光放置的PI + Rh123 混合液中,静置30 min,吸取10 μL 滴于载玻片,置于荧光显微镜(400×)下观察检测,各试验组重复观察五个视野,每个视野至少有200个精子。
1.4.5 T-AOC、MDA测定 T-AOC与MDA的检测采用南京建成生物科公司的试剂盒进行。按说明书操作,分别测定空白对照组与不同浓度苹果多酚试验组与不同浓度葡萄籽原花青素试验组的精液在1、3、5 d时的T-AOC和MDA值,记录数值。
1.5 数据分析
试验所记录数值用SPSS 22.2统计软件进行单因素方差分析,计算各试验组中数据的显著性,结果用“平均值±标准差”形式表示,P<0.05代表差异显著,P>0.05代表差异不显著,每个试验组5个重复。T-AOC、MDA画图用origin软件。
2 结果与分析
2.1 葡萄籽原花青素对低温保存的山羊精子活率的影响
根据表1可知,葡萄籽原花青素浓度为10、30、50 mg/L的处理组均可不同程度提高山羊精子活率。浓度为30 mg/L的处理组中精子活率最高,在2、3、4、5 d时均显著高于其余各组(P<0.05)。50 mg/L处理组次之,在3、4、5 d时均显著高于除30 mg/L组外的其他组(P<0.05)。70 mg/L处理组效果最差,1、2、3、4 d均显著低于其他处理组(P<0.05)。
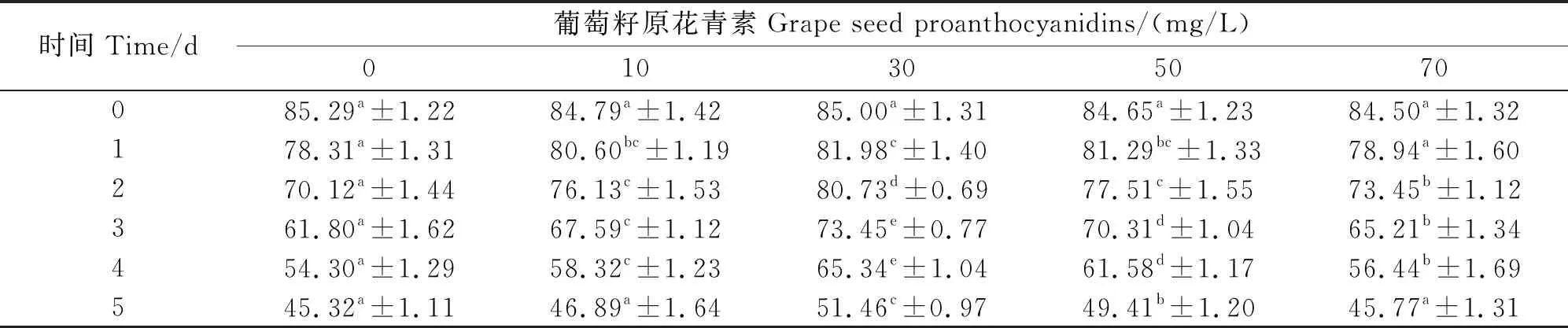
表1 葡萄籽原花青素对低温保存的山羊精子活率的影响
注:同行数据中小写字母不同代表差异显著(P<0.05),相同代表差异不显著(P>0.05))。下同。
Note:Different lowercase superscripts in the same row indicate significant difference(P<0.05),same letter superscripts in the same row indicate insignificant difference(P>0.05).The same blow.
2.2 葡萄籽原花青素对低温保存的山羊精子质膜完整率的影响
根据表2可知,葡萄籽原花青素浓度为10、30、50、70 mg/L的处理组中山羊精子质膜体完整率均大于空白对照组。其中30 mg/L处理组精子质膜完整率最高,其在保存后2、3、4、5 d显著高于50 mg/L处理组之外的其余各组(P<0.05)。
2.3 葡萄籽原花青素对低温保存的山羊精子顶体完整率的影响
由表3可知,在3、4、5 d时葡萄籽原花青素浓度为10、30、50、70 mg/L的处理组中精子顶体完整率均显著大于空白对照组(P<0.05)。其中30 mg/L处理组对精子顶体完整率提高的效果最好,其在保存中后期(3、4、5 d)显著高于其余各组(P<0.05)。

表2 葡萄籽原花青素对低温保存的山羊精子质膜完整率的影响

表3 葡萄籽原花青素对低温保存的山羊精子顶体完整率的影响
2.4 葡萄籽原花青素对低温保存的山羊精子线粒体活性的影响
根据表4可知,葡萄籽原花青素浓度为10、30、50、70 mg/L的处理组中精子线粒体活性都较对照组有所提升。其中30 mg/L处理组中精子线粒体活性最好,在3、5 d时均显著高于其余各组(P<0.05)。50 mg/L 处理组次之,5 d时显著高于除30 mg/L外其他各组(P<0.05)。
2.5 苹果多酚与葡萄籽原花青素对低温保存的山羊精子T-AOC的影响
葡萄籽原花青素浓度30 mg/L处理组的精子T-AOC最高,在保存期间均显著高于其余各组(P<0.05),50 mg/L处理组次之,T-AOC在保存期间显著高于除30 mg/L之外各试验组(P<0.05)。其他各组之间在保存3、5 d时均有显著差异,精子T-AOC含量由高到低为50 mg/L>10 mg/L>70 mg/L>0 mg/L。
2.6 苹果多酚与葡萄籽原花青素对低温保存的山羊精液MDA含量的影响
葡萄籽原花青素浓度10、30、50、70 mg/L处理组的精液MDA含量,在保存期间均显著低于空白对照组(P<0.05)其中30 mg/L处理组的精液MDA含量最低,在保存期间均显著低于其余各组(P<0.05)。

表4 葡萄籽原花青素对低温保存的山羊精子线粒体活性的影响

图2 葡萄籽原花青素对低温保存的山羊精液MDA含量的影响
3 讨 论
在低温保存过程中,精子会随着保存时间的逐渐变长而产生大量的自由基。自由基是一种能独立存在的活泼的化学实体,常见的有超氧阴离子自由基、羟自由基、一氧化氮自由基等[4]。在机体内,自由基对生物的信号转导、细胞程序性死亡、细胞分化分裂等具有重要作用。但活性氧自由基一旦过量时,则会发生氧化应激,损伤细胞蛋白与细胞膜脂质结构,还会导致基因突变,加速细胞死亡[5]。生物膜中脂质部分包含有大量不饱和脂肪酸,自由基对不饱和脂肪酸上的氢有很强的攻击性;另外,一些金属离子如Fe2+等会促进氧化作用,这些因素使得细胞膜很容易发生脂质过氧化反应[6]。因此,精液保存过程中,当ROS大量积累超过一定浓度后,会攻击含有大量不饱和脂肪酸的精子膜,使精子发生脂质过氧化反应。同时,ROS 也会攻击顶体膜,使顶体酶提前释放而不能进行顶体反应,降低受精率,严重影响精子保存质量[7-8]。
原花青素是普遍存在于植物中的一类有强大清除自由基能力的物质,而葡萄籽是原花青素的较好来源[9]。本试验通过向低温保存稀释液中添加葡萄籽原花青素,检测保存过程中精子各项质量指标,结果显示山羊精液品质得到显著提高,这表明葡萄籽原花青对低温保存的山羊精子具有保护作用,这可能与葡萄籽原花青素的结构及其保护机理有关。一方面,葡萄籽原花青素属于断链型抗氧化剂,在反应链进行过程中,其结构中的酚羟基会在氧化后释放,优先与自由基进行结合,使自由基惰化而终止反应,减少脂质受损[10];另一方面,葡萄籽原花青素可与有金属螯和,从而减少氧化反应发生[11]。孙芸等[12]在评价葡萄籽原花青素的抗氧化效果时发现,其抗氧化效果比VC、VE强数倍。郭英等[13]在大鼠离体组织中做葡萄籽原花青素抗氧化性,结果发现大鼠组织中MDA含量明显下降。另有研究发现葡萄籽原花青素可有效提高细胞中SOD、CAT活性[14-15]。Busserolles等[16]在大鼠饲养中饲喂了葡萄籽原花青素,结果发现大鼠的血浆中T-AOC明显增强。上述研究均与本试验结果一致。
本试验中,葡萄籽原花青素的最适添加浓度为30 mg/L。孙艳青[17]在猪冻精保存中探索葡萄籽原花青素的添加浓度,结果表明葡萄籽原花青素最佳添加浓度为40 mg/L。刘斌[18]在猪精液常温保存中添加不同浓度葡萄籽原花青素,结果最适浓度为50 mg/L。上述研究虽然都证实葡萄籽原花青素对精子保存有着显著的改善作用,但最适添加浓度与本研究均有所不同,发生这一现象的原因可能在于,一是保存方式与稀释液成分的不同。本试验中,精液的保存方式分别为常温保存、低温保存、冷冻保存。其中常温保存稀释液中添加的成分相对较少,也缺少抗冻保护剂[19]。低温保存会对精子产生一定的冷打击,稀释液成分中也含有其他保护物质,对精子同样会产生影响。而精液冷冻保存过程最为复杂,除了常规稀释外,还需离心去浆、冷冻、升温等多项操作,同时稀释液成分也更加复杂,常包含多种抗冻保护剂[20]。不同的保存方式与稀释液配方均会对精液保存产生很大的影响,因而造成结果不统一。二是本试验与其余二者研究对象不同,而不同动物精液受不同抗氧化剂的影响不同,因此导致最适添加量略有差异。
4 结 论
在基础液中添加一定浓度的葡萄籽原花青素,可以有效提高山羊精液低温保效果,其适宜添加浓度为30 mg/L。
