桢楠种子萌发过程中内源激素对温度变化的响应
2020-07-14
(1.生物资源保护与利用湖北省重点实验室,湖北 恩施 445000;2.湖北民族大学 林学园艺学院,湖北 恩施 445000)
桢楠Phoebe zhennanS.Lee & F.N.Wei,樟科Rosaceae 楠属PhoebeNees 常绿大乔木,主要分布于四川、贵州、湖北、湖南及浙江等省,是国家二级重点保护树种[1]。桢楠的种子具有休眠特性,不易萌发[2],因此采用辅助方法比如种子去皮处理[3]、添加植物生长调节剂[4]、不同的浸种方式、温度和贮藏时间[5]等方法可以提高种子的发芽率,但实际发芽效果均不甚理想。研究证实不同温度处理对于桢楠种子萌发有一定的促进作用,低温处理可以增加解除休眠内源激素的含量,增加种子的发芽 率[6]。种子休眠与萌发的影响因素有很多,其中植物激素是调控种子萌发过程中重要因素之一[7],它们能通过信号传导途径对种子内各种生理变化做出应答,调节一系列蛋白质、酶的代谢,从而调控种子的休眠和萌发[8]。在种子休眠和萌发过程中GA3、CTK、ABA 分别在萌发中起着原发、许可与抑制作用,对最初萌发起决定作用的激素为GA3[9]。本试验采用低温(4 ℃)处理后的种子在恒温(25 ℃)和变温(15 ℃/25 ℃)条件下研究桢楠种子萌发率,以及低温处理后种子萌发过程中内源激素的变化,为探明桢楠种子萌发机制提供依据,也为其繁育和开发应用提供理论基础。
1 材料与方法
1.1 试验材料
2017年11月上旬于湖北省恩施土家族苗族自治州林业科学研究院(30°17′51″N,109°29′58″E)采集桢楠种子,空瘪粒采用水选法漂出,然后将饱满种子于室温下阴干后调制,室温储藏备用。桢楠种子千粒重为281 g。
1.2 试验方法
将新鲜成熟的种子在4 ℃的低温条件下分别处理0、7、14、21、28 d,以自然状态保存0、7、14、21、28 d 的种子作为对照(CK)。然后将低温处理过的种子放置于培养皿中,在恒温条件25 ℃ 和变温条件15 ℃/25 ℃(夜温15 ℃,昼温25 ℃,各12 h)下进行发芽试验,每个处理100 粒种子,3 次重复。在发芽过程中,每3 天采集1 次样品,立即用液氮速冻并置于-80 ℃冰箱内保存,用于内源激素含量测定。植物内源激素的测定采用酶联免疫吸附测定法(ELISA),为了保证测试数据的稳定可靠,试剂盒由中国农业大学提供,植物激素提取测定方法参照试剂盒附带操作说明书进行,3 次重复。
1.3 数据分析
试验数据采用Excel 2016 和SPSS 20.0 进行分析处理,用邓肯新复极差法(Duncan)进行显著性检验。
2 结果与分析
2.1 不同处理下桢楠种子的发芽率
经过低温(4 ℃)处理不同天数后,在变温(15 ℃/25 ℃)条件和恒温条件(25 ℃)下桢楠种子的发芽率进行方差分析(表1),结果表明:在变温条件种子发芽率有较为明显的提高,低温处理0、7、4、21、28 d 后,桢楠种子发芽率分别为43.3%、50.7%、66.0%、53.3%、55.7%,而在恒温条件下的发芽率不足30%。可见低温处理能显著促进桢楠种子萌发;但并不是低温处理的时间越长,桢楠种子的发芽率越高,由表1可知经过低温处理14 d 的种子在变温条件下的发芽率最高,达到66.0%,而在恒温条件下的发芽率均低于30%。方差分析可知,经过4 ℃低温处理不同天数后的桢楠种子在变温条件下的发芽率和未经过低温处理的种子发芽率呈极显著差异(P<0.01)。
2.2 未经低温处理的桢楠种子发芽过程中内源激素的变化
未经过低温(4 ℃)处理的种子在变温(15 ℃/25 ℃)条件下的GA3、IAA、ZR 含量均高于恒温(25 ℃)条件下的GA3、IAA、ZR 含量,仅ABA含量在变温条件下比恒温条件下略低(图1)。在恒温条件下,GA3、ABA、ZR 含量均呈现出先降低再升高的趋势,IAA 含量呈现出先下降再上升,在发芽结束时又下降的趋势,在变温条件下,GA3和ZR 含量呈现出先上升后下降趋势,ABA 和IAA含量变化趋势则与这两者相反,呈现出先下降后上升趋势。可见变温能够提高自然保存条件下种子内源激素的含量,进而提高种子的发芽率,这也和表1结果相对应,自然保存变温条件下种子的发芽率均高于自然保存恒温条件下的发芽率。
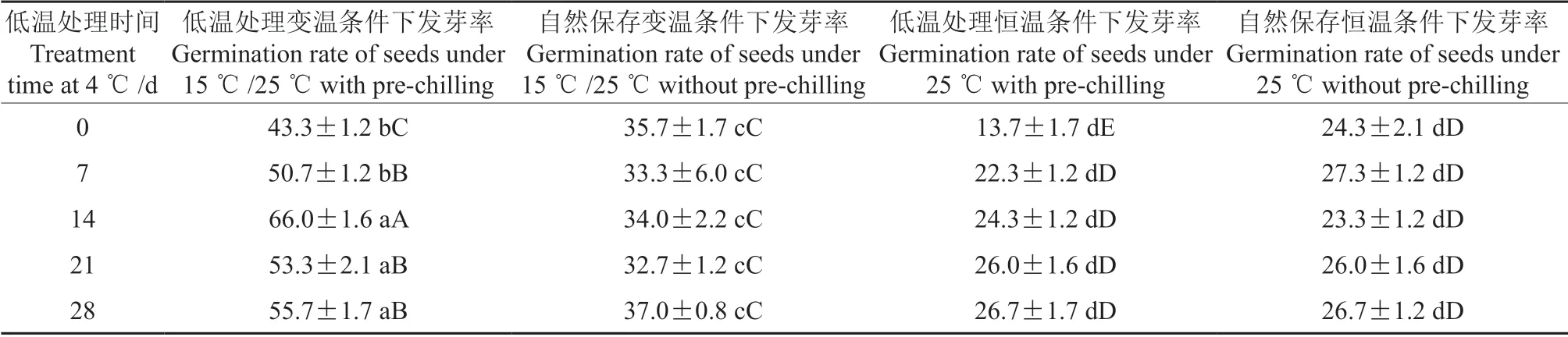
表1 桢楠种子在不同处理下的发芽率† Table 1 The germination rate of phoebe zhennan seeds at different treatments %
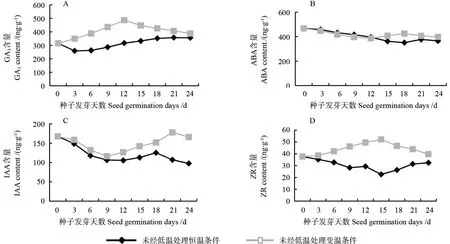
图1 未经低温处理桢楠种子发芽过程中内源激素含量的变化Fig.1 The content dynamics of endogenous hormones of phoebe zhennan seeds in the process of germination without pre-chilling
2.3 低温处理后的桢楠种子发芽过程中内源激素的变化
由表1可知,经过低温(4 ℃)处理14 d 后的种子在变温(15 ℃/25 ℃)条件下的发芽率最高,因此以经过低温处理14 d 的种子为研究对象,研究在发芽过程中种子内源激素的变化。
经过低温(4 ℃)处理后的种子,在变温(15 ℃/25 ℃)条件下的GA3、IAA、ZR 含量均高于恒温(25 ℃)条件下的GA3、IAA、ZR 含量,仅ABA含量在变温条件下比恒温条件下略低。在恒温条件下,GA3含量变化趋势较小,在发芽6 d 略有下降,随后又逐渐缓慢上升,而在变温条件下GA3含量呈现出先升高再降低的趋势,在发芽12 d 时达到最大值为417.17 ng·g-1。而ABA 的变化规律较为一致,均出现先降低后增高的趋势,在发芽12 d 时ABA 均达到最小值,分别为 226.85、276.84 ng·g-1,且ABA 的减小幅度在变温条件下比恒温条件下要大,但在发芽第24 天时,变温条件下的种子ABA 含量要比恒温条件下的含量略高。
IAA 含量呈现出先下降再上升,在发芽结束时又下降的趋势;在发芽前期变温条件下的IAA 含量略高于恒温条件下的IAA 含量,在发芽 18 d 以后,变温条件下的IAA 含量略低于恒温条件下的IAA 含量,在发芽6 d 时达到最低值,分别为153.48、142.64 ng·g-1。ZR 含量在恒温条件和变温条件下的趋势则相反,在恒温条件下ZR 含量随着发芽时间的延长逐渐降低,最小值出现在发芽15 d 时,为25.81 ng·g-1,而在变温条件下ZR含量则随着发芽时间的正在逐渐升高,最大值出现在发芽12 d 时,为47.69 ng·g-1。
2.4 低温处理后桢楠种子在发芽过程中内源激素动态变化
经过低温(4 ℃)处理后,在变温(15 ℃/25 ℃)条件桢楠种子内源激素GA3/ABA、ZR/ABA、(GA3+IAA+ZR)/ABA 均比恒温(25 ℃)条件下桢楠种子内源激素GA3/ABA、ZR/ABA、(GA3+IAA+ZR)/ABA 高,只有发芽前期(18 d左右),在变温条件下IAA/ABA 值高于恒温条件下IAA/ABA 值(图3)。

图2 4 ℃低温处理桢楠种子发芽过程中内源激素含量变化Fig.2 The content of endogenous hormones of phoebe zhennan seeds in the process of germination with 4 ℃ pre-chilling

图3 4 ℃低温处理桢楠种子发芽过程中内源激素动态变化Fig.3 The content dynamics of endogenous hormones of phoebe zhennan seeds in the process of germination with 4 ℃ pre-chilling
2.4.1 桢楠种子内源激素GA3/ABA 的变化
经过低温(4 ℃)处理后,在变温(15 ℃/25 ℃)条件和恒温(25 ℃)条件下桢楠种子的GA3/ABA 值均呈现出先上升后下降的趋势。在发芽第12 天时,变温条件下GA3/ABA 值达到最大,随后又显著下降,与恒温条件相比GA3/ABA 值上升146.43%,;在恒温条件下GA3/ABA 上升幅度没有变温条件下显著;至发芽结束时,无论变温还是恒温,GA3/ABA 比值相差不大,分别为1.09和1.07,与种子开始发芽时的GA3/ABA 值相比分别增加29.36%和27.38%。
2.4.2 桢楠种子内源激素IAA/ABA 的变化
经过低温(4 ℃)处理后,在变温(15 ℃/25 ℃)条件和恒温(25 ℃)条件下桢楠种子的IAA/ABA值都呈先上升后下降的趋势,但最大值出现的时间不同。变温条件下在发芽第12 天IAA/ABA 达到最大值,随后又显著降低,而恒温条件下在发芽第18 天IAA/ABA 达到最大值,随后缓慢下降,至发芽结束时,反而恒温条件下的IAA/ABA 值比变温条件下略高,但都高于发芽开始时的IAA/ABA 值,分别比发芽开始时高31.71%和2.44%。
2.4.3 桢楠种子内源激素ZR/ABA 的变化
经过低温(4 ℃)处理后,在变温(15 ℃/25 ℃)条件和恒温(25 ℃)条件下桢楠种子的ZR/ABA 值呈先上升后下降的趋势。变温条件下在发芽第12 天时ZR/ABA 值达到最大,比恒温条件下上升了90.91%,随后又显著下降。在恒温条件下ZR/ABA 上升幅度没有变温条件下显著,在发芽12 d 时达到最大值,至发芽后期,ZR/ABA 值处于稳定状态。相比开始发芽时的ZR/ABA 值分别增加30%和-10%。
2.4.4 桢楠种子内源激素(GA3+IAA+ZR)/ABA的变化
经过低温(4 ℃)处理后,在变温(15 ℃/25 ℃)条件和恒温(25 ℃)条件下桢楠种子的(GA3+IAA+ZR)/ABA 值呈先上升后下降的趋势。变温条件下在发芽第12 天时(GA3+ IAA+ZR)/ABA 值达到最大,比恒温条件下上升了142.54%,随后又显著下降。在恒温条件下(GA3+IAA+ZR)/ABA 上升幅度较为缓慢,在发芽18 d 时达到最大值。相比开始发芽时的ZR/ABA 值分别增加80%和25.93%。
2.5 桢楠种子内源激素和发芽率的相关分析
桢楠种子在12 d 时发芽率达到最大值,因此以发芽率最大值作为参照,分析此时桢楠种子内源激素与发芽率之间的关系。
经过低温(4 ℃)处理后的桢楠种子,在变温(15 ℃/25 ℃)条件和恒温(25 ℃)条件下的发芽率均与GA3/ABA、IAA/ABA、ZR/ABA 及(GA3+IAA+ZR)/ABA 比值呈显著或极显著正相关,ABA 与发芽率相关性在变温条件下相关性不显著,但在恒温条件下表现为负显著相关,GA3、IAA 和ZR 与发芽率的关系不论在恒温条件下还是变温条件均呈显著或极显著正相关(表2)。

表2 各内源激素与发芽率的相关性†Table 2 The correlation analysis between endogenous hormone and germination rate of phoebe zhennan seeds
3 结论与讨论
3.1 低温处理对桢楠种子发芽率的影响
温度作为一种外界环境因子,在种子的整个生长发育过程中发挥着重要作用,如控制种子的休眠与萌发等,而低温则对于破除种子休眠起着非常关键的作用,有些植物种子需要在特定的温度下才能解除休眠,而有些植物种子的萌发则需要一个变温解除休眠的过程[10],如蔺吉祥在20 ℃(12 h)/30 ℃(12 h)变温条件下,通过对发芽率、发芽速率、开始发芽时间以及50%种子发芽天数等指标进行观察,发现变温处理可以显著提高羊草种子的萌发率[11];Weitbrecht 研究则证实拟南芥种子在4 ℃的温度下3 d 左右即可破除休眠[12]。本研究发现经过低温处理的桢楠种子在自然保存条件下发芽率为32.7%~37.0%,在变温条件下发芽率比自然保存条件下发芽率显著提高,但并不是低温处理的时间越长萌发率越高,在低温(4 ℃) 处理14 d 后在变温(15 ℃/25 ℃)条件下发芽率达到66.0%,随着低温处理时间的延长,发芽率反而有降低趋势;而没有经过低温处理的种子即使在变温条件下发芽率也不足30.0%,说明低温可以解除种子的休眠,显著提高种子的发芽率。
3.2 桢楠种子萌发过程中内源激素的变化
植物激素对种子休眠萌发起着非常重要的调控作用[13-14],Khan 认为多种内源激素共同调控种子的休眠和萌发,不单纯是某一种植物内源激素的增加或者减少就会导致种子的萌发[15-16];Mohammad 等[17]认为种子休眠的解除总是与赤霉素类物质的积累相伴发生;张鹏等[18]对水曲柳种子的研究则发现内源激素ZR 具有抵消发芽抑制物质的作用,从而调控种子发育中的物质和能量代谢;Kucera 等[19]研究发现内源激素ABA 不仅可以诱导种子的休眠,还可以抑制种子的萌发;宋发军等[20]对华重楼种子萌发的结果则表明华重楼种子休眠的解除、萌发和出苗不仅受内源激素含量的影响,还与各激素之间的平衡有关,特别是促进生长激素与抑制生长激素之间的比例和平衡;李应兰等[21]研究发现在厚竹个体发育过程中内源激素IAA、GA 及促进生长类激素总量(IAA+ZR+GA)与抑制生长类激素(ABA)的比值变化均不显著。韩继红等[22]对无患子硬枝扦插研究发现插穗内源激素含量ZR/IAA 和ZR/GA3在4 个时期均呈现为先迅速下降,然后迅速上升,再下降或者相对稳定。
本研究结果发现经过低温(4 ℃)处理后的种子在变温(15 ℃/25 ℃)条件内源激素GA3、IAA、ZR 的含量均明显高于恒温(25 ℃)条件下的内源激素含量,ABA 含量则在变温条件下低于恒温条件,同时种子内源激素GA3/ABA、IAA/ABA、ZR/ABA 及(GA3+IAA+ZR)/ABA 的比值也显著上升,表明变温条件能够打破种子内源激素间的平衡,增加促进种子萌发的内源激素含量,降低抑制种子萌发的内源激素含量,使得种子萌发率显著增加。这与天女木兰[23]、滇重楼[24]、紫椴[25]、东北红豆杉[26]、山桐子[27]等种子内源激素与种子萌发关系的研究结果一致。Khan 和Wafters提出的激素三因子调节学说认为GA3、CTK、ABA 分别在萌发中起着原发、许可与抑制作用,GA3为萌发最初所必需,CTK 可以减缓抑制剂ABA 对GA3的抑制作用,使GA3的作用得以实现,这三种激素相互作用,共同决定着种子的休眠与萌发。本研究测定了不同温度处理下桢楠种子内源激素赤霉素GA3、脱落酸ABA、生长素IAA、玉米素ZR 的含量和动态变化,而没有涉及细胞分裂素CTK 的含量在不同温度处理下的变化,下一步将继续深入研究变温条件下细胞分裂素CTK 对桢楠种子休眠的减缓抑制作用。
