牛病毒性腹泻病毒衣壳蛋白原核表达及多克隆抗体的制备
2020-07-13张忠辉高闪电独军政田占成王建东殷宏
张忠辉,高闪电*,独军政,田占成,王建东,殷宏,3*
(1. 中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室,甘肃 兰州 730046;2. 宁夏农林科学院动物科学研究所,宁夏 银川 750002;3. 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
牛病毒性腹泻(bovine viral diarrhea,BVD)是由牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)感染导致的动物疫病,呈世界性分布[1]。该病主要发生于牛,可出现高热、腹泻、白细胞减少、沉郁、流涎、减奶、停奶、结膜炎、口腔黏膜充血溃疡、怀孕母牛流产、产死胎或畸形胎等多种临床症状,还可由于持续感染导致免疫耐受和免疫抑制。鉴于该病导致的严重经济损失,世界动物卫生组织将其列为法定报告的牛传染性疾病之一,我国农业农村部也将其列为三类动物疫病。
BVDV在分类学上属于黄病毒科(Flaviviridae)、瘟病毒属(Pestivirus),为单股正链RNA病毒[2]。成熟的病毒粒子为球形,直径40~60 nm,其核衣壳位于病毒粒子的中央,呈二十面体对称结构,由脂质双层包裹C蛋白和病毒基因组RNA构成。BVDV基因组全长12.3~12.5 kb,只有一个开放阅读框,编码一个由约4 000个氨基酸组成的多聚蛋白,在翻译同时或翻译后经细胞和病毒基因编码的蛋白酶加工为11或12种蛋白,其中P14(C)、gP48(Erns)、gP25(E1)、gP53(E2)4个蛋白为病毒的结构蛋白,其余为病毒的非结构蛋白[3]。C蛋白是病毒编码的第二个蛋白,分子质量为14 kDa,是一种小的碱性多肽,主要功能是结合病毒基因组RNA并形成核衣壳,在保护病毒基因组RNA方面起重要作用。研究表明,同属的猪瘟病毒C蛋白还具有参与细胞转录调节[4]、影响病毒毒力[5-6]、拮抗病毒增殖等作用[7]。为了进一步研究C蛋白在BVDV感染中起的重要作用,本研究利用原核表达系统进行高效表达获得重组C蛋白,并制备了兔源多克隆抗体。
1 材料与方法
1.1 材料
1.1.1 菌毒株、载体、细胞及实验动物
克隆用pGEM-T easy载体购自Promega公司。原核表达载体pET42a(+)购自Novagen公司。克隆菌株DH5α感受态细胞购自宝生物工程(大连)有限公司。表达工程菌株BL21 Rosetta (DE3) pLysS购自北京全式金生物技术有限公司。实验所用病毒株BVDV-AV69 购自中国兽医药品监察所。牛肾细胞(MDBK)细胞由中国农业科学院兰州兽医研究所家畜病原生物学国家重点实验室并保存。8周龄新西兰白兔购自中国农业科学院兰州兽医研究所实验动物中心。
1.1.2 主要试剂
RNA提取试剂盒RNeasy Mini Kit购自QIAGEN公司。PrimeScript One Step RT-PCR Kit Ver.2 (Dye Plus)、内切酶BamHⅠ和HindⅢ、T4 DNA Ligase、胶回收试剂盒、质粒DNA提取试剂盒购自宝生物工程(大连)有限公司;预染蛋白Marker,购自Solarbio公司;GST·Bind蛋白质纯化试剂盒购自Novagen公司。辣根过氧化物酶(HRP)标记的山羊抗兔IgG均购自Abcam公司。SuperSignal West Pico Chemiluminescent Substrate,购自赛默飞世尔科技(中国)有限公司。兔抗 BVDV全病毒阳性参考血清和阴性血清,均由中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室制备保存;FITC标记的山羊抗兔IgG,购自上海生工生物技术有限公司。
1.2 方法
1.2.1 引物的设计及合成
参照GenBank公布的BVDV基因组序列,设计一对特异性引物,F:5′-CATGGATCCTCCGACACAAATGCAGAAG-3′、R:5′-GACAAGCTTTCCCACTGCAACCTGAAAC-3′,用于扩增BVDV C基因,预期片段大小为306 bp,委托西安擎科泽西生物技术有限责任公司合成。
1.2.2 BVDV总RNA的提取及RT-PCR扩增
根据RNeasy Mini Kit试剂盒说明书,提取BVDV总RNA。以提取的RNA为模板,进行RT-PCR,RT-PCR扩增反应体(50 μL)包括:Primer F:1.5 μL,Primer R:1.5 μL,Enzyme Mix:2 μL,2×1 Step Buffer:24 μL,RNA:4 μL,RNase free H2O:17 μL;PCR反应参数为:50 ℃ 30 min反转录;94 ℃ min;94 ℃,30 s;55 ℃,30 s;72 ℃,35 s;35个循环;72 ℃,10 min,4 ℃,1 min。反应结束后取10 μL产物经琼脂糖凝胶检测鉴定。
1.2.3 基因克隆
胶回收PCR产物,与克隆载体pGEM-T easy于16 ℃连接过夜,转化DH5α感受态细胞。挑取单个克隆利用M13F/R引物进行PCR鉴定,将初步鉴定正确的菌落用氨苄LB液体培养基培养并提取质粒,送至西安擎科泽西生物技术有限责任公司测序。
1.2.4 C基因表达载体的构建
分别将测序正确的pGEM-T easy-C和表达载体pET42a用BamHⅠ、HindⅢ进行双酶切,回收目的片段,用T4 DNA Ligase连接于16 ℃过夜,转化BL21 Rosetta (DE3) pLysS感受态细胞,摇菌并提取质粒经PCR鉴定,将鉴定正确的质粒pET42a-C送至西安擎科泽西生物技术有限责任公司测序。
1.2.5 蛋白的诱导表达与纯化
将筛选到的pET42a-C阳性重组菌,扩大培养至OD600nm达到0.6时,加入终浓度为1 mM的IPTG继续培养8 h后,6 000 r/min离心10 min,收集菌体进行超声波破碎,功率150 W超声时间30 min,12 000 r/min离心5 min,收集上清和沉淀进行SDS-PAGE电泳检测表达情况。确定蛋白表达后,以同样的方法诱导500 mL重组菌,超声裂解后,以GST树脂亲和层析法对上清中的目的蛋白进行纯化并进行SDS-PAGE电泳分析。
1.2.6 Western blot分析
将纯化获得的重组C蛋白经SDS-PAGE后转印至PVDF膜上,加入50 g/L脱脂奶粉室温封闭1 h后分别以兔抗BVDV阳性参考血清(1∶1 000)和兔阴性血清(1∶1 000),37 ℃作用1 h,PBST洗5次,每次5 min。加入辣根过氧化物酶(HRP)标记的山羊抗兔IgG(1∶15 000)作用1 h,PBST洗5次,每次5 min,之后加入SuperSignal West Pico Chemiluminescent Substrate,利用BIO-RAD ChemiDoc XRS 凝胶成像系统分析。
1.2.7 多克隆抗体的制备
将纯化的C蛋白与弗氏完全佐剂等比例混合后乳化成油乳剂,经腘淋巴结和背部皮下多点注射免疫2只雄性白兔,免疫的抗原用量为100 μg。2周后以相同抗原用量的重组C蛋白与弗氏不完全佐剂经乳化后进行二免。二免2周后以相同抗原进行三免。三免结束10 d后经心脏采血,分离血清,备用。
1.2.8 多克隆抗体的鉴定
多克隆抗体效价测定:以纯化的重组C蛋白100 μL(浓度为0.5 μg/mL)包被ELISA反应板,进行间接ELISA对多克隆抗血清进行效价测定。将兔抗C蛋白多克隆血清、免疫前的兔阴性血清分别进行1∶100~1∶25 600倍比稀释,以1∶10 000倍稀释辣根过氧化酶HRP标记的山羊抗兔IgG为酶标二抗,以TMB为底物显色液,以免疫血清OD450 nm值/阴性对照血清OD450 nm值大于等于2为阳性判断标准。
间接免疫荧光(IFA)检测抗体反应性:将MDBK细胞培养于6孔细胞培养板,每孔用500 TCID50的BVDV-AV69 接种,36 h后用无水乙醇固定30 min,PBS清洗后分别加入1∶200稀释的C蛋白多克隆抗体和阳性对照血清、兔阴性对照血清,37 ℃孵育1 h;用PBS清洗5遍后以1∶200稀释的FITC标记的山羊抗兔IgG作为二抗,37 ℃下孵育1 h。用PBS清洗5遍后,吸干并用甘油封片后置于荧光显微镜下观察,判定多克隆抗体与BVDV天然抗原的反应性。
2 结果
2.1 C基因RT-PCR扩增
经RT-PCR扩增,利用3 %琼脂糖凝胶电泳后,在位于306 bp处可见与预期结果大小一致的扩增条带(图1)。
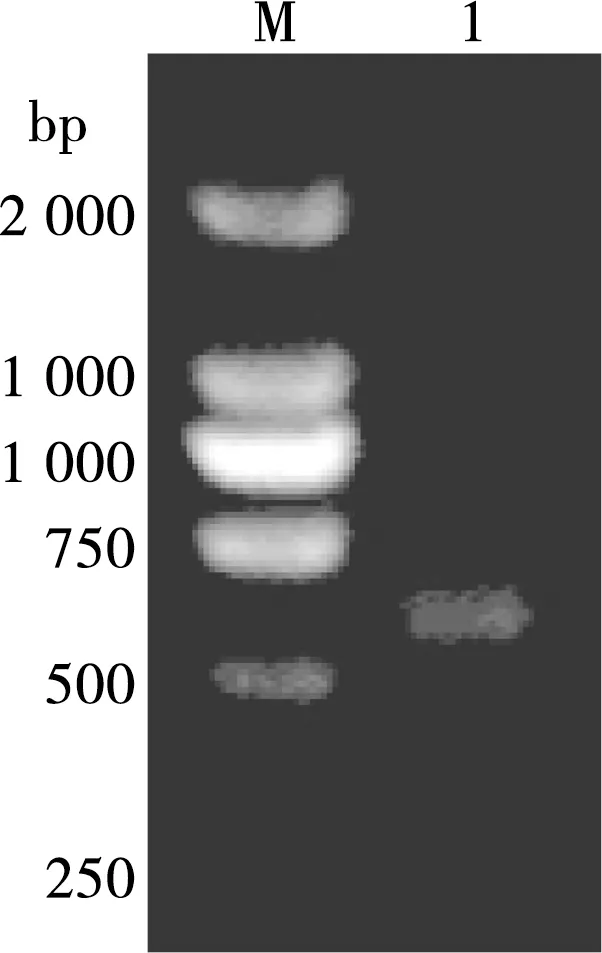
M. DNA标准 DL 2 000 Marker;1. C基因
图1 C基因RT-PCR扩增
2.2 表达载体的构建
利用BamHⅠ和HindⅢ将C基因定向克隆至载体pET-42a表达载体中,转化Rosetta(DE3)pLysS感受态细胞,挑取单菌落进行PCR鉴定,获3个阳性克隆(图2),提取质粒测序表明重组表达载体具有正确的读码框。

M. DNA标准DL 2000;1-5. 菌液PCR扩增产物;6. 阳性对照;7. 阴性对照
图2 重组质粒pET-42a-C的PCR鉴定
2.3 重组蛋白的诱导表达和纯化
将测序正确的重组菌株,经扩大培养至菌液OD600nm值达到0.6时加入终浓度为1.0 mmol/L的IPTG后诱导,8 h后收集菌体超声波破碎菌体,经SDS-PAGE鉴定。结果显示,重组C蛋白以可溶形式表达,经纯化得到分子质量约45 kDa的目的蛋白(图3)。
2.4 重组蛋白的免疫印迹检测
Western blot结果显示,重组蛋白可与BVDV阳性血清发生特异性反应,而与阴性血清未见反应(图4)。

M.蛋白Marker;1.未诱导;2. 诱导2 h;3. 诱导4 h;4. 诱导6 h;5. 超声后沉淀;6. 超声后上清;7. 纯化的C蛋白
图3 重组C蛋白的表达和纯化

M.蛋白分子质量标准;1.纯化的蛋白与阳性血清作用;2.纯化后的蛋白与阴性血清作用
图4 重组表达蛋白的Western blot分析
2.5 多克隆抗体效价的测定
ELISA结果表明(图5),当血清稀释度达到25 600时,两兔抗C蛋白多克隆抗体在OD450 nm值分别为1.592和1.611,明显高于阴性对照兔血清的OD450 nm值,说明成功制备了抗C蛋白多克隆抗体,其效价可以达到1∶25 600以上。

A. 抗C蛋白家兔血清; B. 抗C蛋白家兔血清; N.免疫前家兔血清
图5 间接ELISA法测定兔C蛋白多克隆抗体的效价
2.6 间接免疫荧光试验
MDBK细胞接种BVDV 36 h后,利用制备的多克隆抗体(图6A)和阳性血清(图6B)进行间接免疫荧光试验,可检测到特异的荧光,而未接种病毒的MDBK细胞中未见荧光信号(图6C),表明制备的兔抗C蛋白多克隆抗体与细胞培养物中的BVDV天然抗原具有良好的反应原性。

A. 本研究制备的多壳隆抗体;B.阳性参考血清对照;C.阴性血清对照
3 讨论
BVDV的衣壳蛋白基因编码102个氨基酸,在BVDV多聚蛋白加工过程中,N蛋白由于自我切割从C蛋白N端解离,之后多聚蛋白在C蛋白C端信号序列介导下转运至内质网,在内质网腔内由信号肽酶进行C蛋白和Erns蛋白的切割[8]。信号肽酶进一步切割除去膜锚定序列后产生90个氨基酸组成的成熟C蛋白。成熟的C蛋白与病毒基因组结合,并由内质网来源的蛋白形成囊膜,与Erns蛋白、E1蛋白以及E2蛋白组装成病毒粒子,在内质网腔内转运并最终通过细胞分泌途径释放至胞外[9]。C蛋白在瘟病毒属比较保守,除了结合病毒基因组RNA形成核衣壳,目前发现猪瘟病毒C蛋白还可与宿主SUMO化通路蛋白作用影响病毒毒力、与血红蛋白β亚基相互作用拮抗病毒增殖[7],但尚不清楚BVDV C蛋白是否具有类似的功能。为了进一步研究BVDV C蛋白的功能,本研究选用原核表达系统进行了C蛋白的表达。谷胱苷肽S-转移酶(GST)来源于日本血吸虫,其基因融合表达体系具有蛋白表达产率高、表达产物纯化方便以及利于抗体制备等优点[10],而且该蛋白在哺乳动物细胞并无表达,因此在纯化后我们并未切除GST标签。前期研究发现,去除NADL毒株C蛋白C端13个氨基酸序列有利于其在大肠杆菌系统中的表达,但去除C端10个氨基酸的Erns信号肽序列进行蛋白表达并不能获得足够的可溶性蛋白[11]。在本研究中,表达完整的C蛋白获得了理想的表达量,这可能由于所用毒株基因和载体不同,导致目的基因的表达量存在一定差异。为了获得针对完整C蛋白的多克隆抗体,本试验并未去除C蛋白C端的氨基酸。免疫印迹证实纯化所获C蛋白具有良好的反应原性,在免疫后获得具有较高效价的兔源多克隆抗血清。由于C蛋白抗体不具中和病毒的活性,本研究采用了间接免疫荧光试验的方法验证了所获单克隆抗体与细胞培养物中病毒天然抗原的反应活性。目前,BVDV的衣壳蛋白诸多的功能,包括其介导的内质网转运途径、通过与宿主蛋白互作调控病毒感染等,有待于深入研究。本研究成功制备了BVDV C蛋白多克隆抗体,从而为后续C蛋白功能研究奠定了基础。
