基于钼的磷酸根离子选择电极表面反应过程研究
2020-07-13骆芳萍杨慧中
骆芳萍,杨慧中,2
(1.江南大学物联网工程学院,江苏无锡 214122;2.江南大学轻工过程先进控制教育部重点实验室,江苏无锡 214122)
0 引言

循环伏安法(cyclic voltammetry,CV)是一种常见的电极表面化学反应过程研究方法。张丽等[17]采用CV法研究以乙腈为介质在常压的环境中,电极材料与温度对于二氧化碳还原行为的影响,确定了电极表面发生还原反应形式。聂凯会等[18]运用CV法成功揭示了锂电池的表面反应机理以及电极动力学过程。本研究为探究磷酸盐检测体系中钼电极表面反应机理,首先采用线性扫描法,发现了钼电极在测量磷酸盐过程中的反应为不可逆过程;为了探究钼电极表面产物的具体形式、确认钼的价态,接着使用了能谱仪(energy dispersive spectromeeter,EDS)及X射线光电子能谱分析(X-ray photoelectron spectroscopy,XPS)进行探究。
1 实验部分
1.1 仪器与试剂
本实验使用的器材如下:电化学工作站(RST5000)、EDS(S-480)、XPS(AXIS Supra)、pH计(FE20)、饱和甘汞参比电极(6213)、超声波清洗仪(DA-968)、磁力搅拌器(85-1A型)、钼棒(99.99%,5 mm)。以及化学试剂:无水磷酸氢二钠(Na2HPO4)、氢氧化钠(NaOH)、三氧化二铝粉末(Al2O3)、乙醇(C2H4O)等。实验过程中使用溶液均为去离子水配制。
磷酸盐储备溶液配置过程如下:使用分析电子天平称取141.96 g无水磷酸氢二钠溶于适量去离子水中并使用磁力搅拌器搅拌,完全溶解后使用去离子水定容1 L,得到浓度1 mol/L的磷酸盐标准储备溶液,然后按比例将其稀释成不同浓度的磷酸盐标准溶液。
1.2 基于钼的磷酸根离子检测装置及原理
本研究使用的磷酸盐浓度检测装置结构图如图1所示。基于钼的磷酸根离子选择电极检测装置由2个电极组成。其中,工作电极为钼电极,参比电极为饱和甘汞电极。其与电化学工作站相接并连接至上位机显示测量电位。通过配置10-1~10-7mol/L等7种不同浓度的磷酸盐标准溶液并以磷酸盐离子选择电极测量其相应电位后可拟合出磷酸盐浓度与电位的标准曲线。对于未知浓度的磷酸盐水样,通过使用电极测量其响应电位即可得到其所含的磷酸盐浓度。

图1 磷酸盐浓度检测系统
1.3 实验方法
CV法是双向扫描过程。在给定的一段电压范围内,按照一定的速率,对电池的电压进行双向线性扫描,结果按照电流-电压曲线的形式表示。循环伏安法反应分为可逆体系、非可逆体系、准可逆体系、不可逆体系4种。本研究只使用不可逆体系进行分析。
在不可逆体系中,电子转移动力不足以维持表面浓度的热力学平衡,在反应中峰电流Ip与扫描速度v满足关系:
(1)
式中:n为电子转移数目;D为扩散系数;v为扫描速度,V/s;A为电极表面积,cm2;c为被测物浓度,mol/L。
峰电位(Ep)与扫描速度(v)的关系满足Laviron方程[19],如式(2)所示:

(2)
式中:Ep为峰值电压,V;E0为标准电压,V;α为电子转移系数,取0.6;F为法拉第常数,96 485 C/mol;R为标准气体常数,8.134 J/(K·mol);T为温度,K;KS为电化学速率常数,s-1。
1.4 实验步骤
在电化学工作站中,设置电位扫描范围为-0.6~0.1 V,设置灵敏度为10 μA,扫描速度根据不同的实验来设定,磷酸盐溶液的pH值通过滴加氢氧化钠进行调整。在每次检测结束后,将钼电极用1.0 μm的Al2O3粉末在抛光布上进行抛光,再放进乙醇和去离子水中使用超声波清洗装置清洗5 min,以保证电极表面的清洁程度。
XPS的测试条件为:铝靶单色X射线源(AlKα,1 hv=1 486.7 eV)和Ag靶X射线源,最大功率600 W(工作电压15 kV,发射电流40 mA)。
2 结果与讨论
2.1 钼电极表面电化学行为定量分析
2.1.1 pH值的影响
改变溶液的pH值对钼电极表面循环伏安行为具有较明显的影响。图2显示的是不同pH对峰电流影响的实验结果,扫描速率设置为0.01 V/s。图2(a)中显示当pH≤7时,不存在明显的波峰,无法检测到明显的峰电流,只有当pH>7时,才能测得较明显的峰电流。图2(b)为不同pH值下钼电极在浓度为0.03 mol/L的Na2HPO4溶液检测到的峰电流与峰电压。由图2(b)可知,当pH<7时,此时不存在氧化峰以及还原峰,即钼电极表面没有发生电子转移。由此可以推断出在非碱性条件下,电极表面不会发生氧化反应或者还原反应。随着pH值的增加,峰电流呈现上升趋势。但pH过高时,峰电流的增幅不再明显,甚至会下降,此时电极表面会有黑色物质产生。结合图2(b)的比较,发现只有在碱性条件下,存在大量的OH-,才会生成引发电极对磷酸根离子产生电位的中间产物。当pH过高时(pH>11),电极表面的黑色物质对峰电流产生了抑制,最高峰电流会逐渐减小。因此,将 pH=11视为最佳pH实验条件,在以下无特殊说明时,对钼电极表面反应的机理研究都是在碱性反应体系下(pH =11)进行。

(a)6种pH下的循环伏安曲线

(b)6种pH值的峰电流变化曲线图2 pH值对峰电流的影响
2.1.2 吸附时间的影响
在前述实验条件下,再次比较了不同吸附时间下的循环伏安行为变化,实验结果如图3所示。
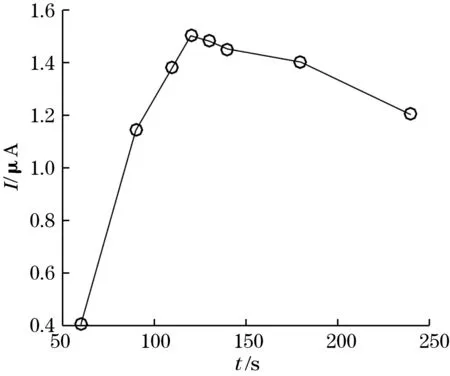
图3 吸附时间对峰电流的影响
图3中,在反应开始的前120 s内,峰电流随着吸附时间的延长逐渐增大,但在120 s以后会渐趋减小。峰电流最大出现在反应开始后的120 s左右,因此,本研究选择最优的反应时间120 s。
2.2 钼电极在碱性条件下的表面反应
为了探究OH-与钼电极表面反应的产物,使用以NaOH调整pH后的Na2HPO4溶液作为待测溶液。首先,以NaOH将10-3mol/L Na2HPO4溶液pH值调整到11.0 ± 0.1,电压范围均设置为-0.6~0.1 V,灵敏度设置为0.01 mV,电化学工作站中设置扫描速度为0.01 V/s,循环扫描4次,得到的循环伏安响应曲线如图4所示。从图4中扫描的CV曲线可以看出,第一次扫描时CV曲线有且仅有一个明显的氧化峰,且不存在还原峰,这表明钼电极表面此时仅发生了氧化反应。由此,可以判断此时钼电极表面发生的是一个完全不可逆的过程。比较4次扫描得到的曲线,发现在峰电流和峰电压的数值都在扫描第一圈时达到最大,但随着扫描圈数的增加,氧化峰逐渐消失,且循环伏安曲线也逐渐呈现重合的趋势。这表明,此时钼电极表面出现了吸附现象。

图4 钼电极在氢氧化钠中的循环伏安曲线
2.3 钼电极表面电化学行为
以NaOH将10-3mol/L Na2HPO4溶液的pH值调整到11.0 ± 0.1,电压范围均设置为-0.6~0.1 V,灵敏度设置为0.01 mV,电化学工作站中扫描速度分别为0.01、0.02、0.03、0.04、0.05、0.06 V/s这6种不同的扫描速度,探究不同的扫描速度对检测到的峰电流、峰电位数值大小的影响。记录不同扫描速率对应的峰电流与峰电压的值,测量结果如图5所示。由图5(a)可知,随着扫描速度增大,峰电流的数值也逐渐增加。在扫描速度为0.01~0.06 V/s,钼电极的氧化峰电流(Ip)与扫描速度(v)成线性关系。采用最小二乘算法对二者拟合,得到线性方程如下:
Ip=1.673v+0.080 47
(3)
计算得到线性相关系数为R2=0.989 9。这表明钼电极在氢氧化钠溶液中发生的表面反应受表面控制。此外,通过绘制氧化峰电流与扫描速度的平方根的散点图,如图5(b)所示,可以发现二者也存在明显的线性关系,拟合得到的线性方程如下:
(4)
计算得到线性相关系数为R2=0.993 8。这说明在扫描速度为0.01~0.06 V/s时,电极表面发生的电化学反应受扩散控制。综上,钼电极在经过NaOH调解的Na2HPO4溶液中发生的是受表面和扩散控制的电化学反应。
图6为对峰电压(Ep)与扫描速度(v)的测量结果。由图6可看出在扫描速率为0.01~0.06 V/s时,峰电压(Ep)与扫描速度(v)以及扫描速率的对数(lnv)都存在线性关系。采用最小二乘算法拟合分别得到2条拟合曲线,其中,峰电压(Ep)与扫描速度(v)拟合结果为
Ep=0.058 86v+0.000 406 7
(5)
线性相关系数为R2=0.985 2。由此公式并利用外推法可以得出当v=0时,标准电势E0=0.406 7 mV。
峰电压(Ep)与扫描速度对数(lnv)拟合结果为
Ep=0.016 29lnv+0.081 83
(6)
线性相关系数为R2=0.947 2。由前述分析可知,钼电极在pH=11±0.1的Na2HPO4溶液中发生的表面反应为受表面控制的、整体不可逆的反应过程。因峰电压(Ep)与扫描速率的对数(lnv)满足式(6),根据式(2)Laviron方程和式(6),可以计算得到n= 5.88≈ 6,所以在该表面反应中,转移电子数为6。由式(2)、式(5)和式(6),可得到电化学速率常数KS(s-1)为227 s-1。

(a)扫描速率与峰电流的关系

(b)扫描速率的平方根与峰电流的关系图5 扫描速率、扫描速率平方根与峰电流之间的关系
由此可知,在碱性条件下,钼电极表面的金属钼首先会与溶液中的OH-发生反应失去电子变成Mo6+。同时发现在每次实验过程中,随着反应进行,钼电极的表面会逐渐附着灰黑色附着物,这表明在反应的过程中,除了存在Mo6+,还存在着Mo3+或Mo4+。但出现的Mo3+或Mo4+具体含量还需配合EDS和XPS进行后续的探究。
2.4 反应产物分析
为确定钼电极表面反应生成的具体产物形式,分别使用了EDS和XPS[常用能量校准结合能内标C 1s(污染碳)= 284.8 eV;能量分辨率0.48 eV(Ag 3d5/2)],对反应后的钼电极表面进行了分析。首先使用EDS分析了在空白溶液(去离子水)、10-3mol/L的Na2HPO4溶液中检测后的钼电极表面,实验结果分析如表1所示。可以看出,空白溶液中检测后的钼电极表面无磷存在,且反应后电极表面钼含量为63.97%;而在10-3mol/L的Na2HPO4溶液中,结果显示有微量磷的存在,且钼的含量有所下降,含量比为62.24%。

(a)扫描速率与峰电压的关系

(b)扫描速率的对数与峰电压的关系图6 扫描速率、扫描速率对数与峰电位之间的关系
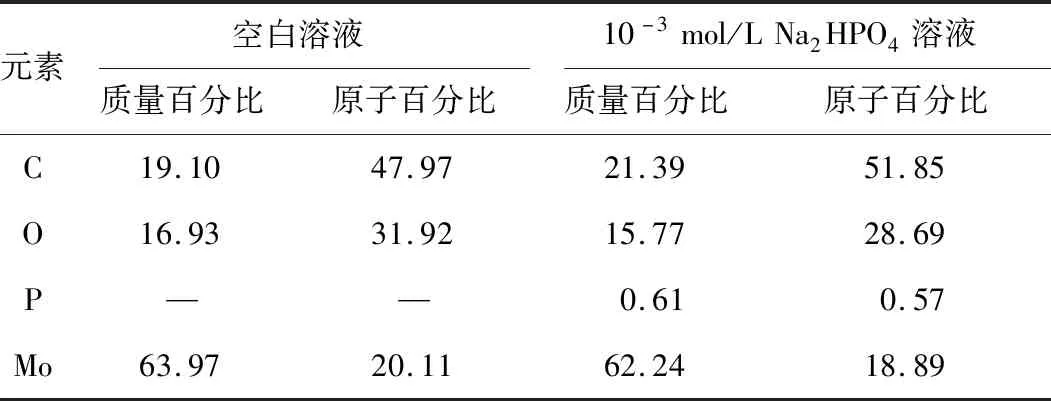
表1 EDS实验结果 %
为确认检测后电极表面存在的具体元素及其价态,选择XPS技术对电极表面成分进行深入分析。选取了空白溶液、pH为8.3的10-3mol/L的Na2HPO4溶液、pH为11的10-3mol/L Na2HPO4溶液和pH为11的NaOH溶液,以XPS的检测结果以及进一步分峰处理结果分别如图7(a)、图7(b)、图7(c)、图7(d)所示。

(a)空白溶液
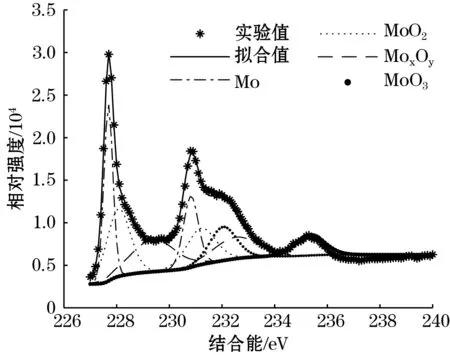
(b)pH=8.3,Na2HPO4(10-3 mol/L)

(c)pH=11,Na2HPO4(10-3 mol/L)

(d)pH=11,NaOH图7 钼电极表面XPS检测结果
钼金属的结合能有2个峰,只根据主峰分峰拟合误差过大,所以在分峰拟合的时候必须将主侧峰同时考虑。根据分峰后峰值的结合能,可知Mo主峰的结合能为228 eV,MoO2结合能为229.5 eV、MoO3结合能为233.1 eV,进而确定检测后的钼电极表面存在4种物质,分别为:Mo、MoO2、MoxOy、MoO3。表2所示是由XPS实验结果计算得到的各物质在电极表面的含量。

表2 钼电极表面物质含量 %

2.5 钼电极检测磷酸盐的机理推测

3 结论
研究了碱性条件下(pH=11)基于钼的磷酸根离子选择电极具有良好响应的原因,采用循环伏安法,以及不可逆反应体系分析方法,通过实验分析论证了非碱性条件下磷酸盐并不会与钼发生氧化还原反应,只有存在足够的OH-,金属钼才会反应生成Mo6+。
以EDS、XPS方法进一步对磷酸盐检测体系中钼电极表面反应机理的研究,推测在钼电极表面金属钼首先与OH-反应生成了MoO3,MoO3含量的升高使得对磷酸根离子的响应电位显著。
