黄芪甲苷增强骨髓间充质干细胞修复大鼠脑缺血再灌注损伤的实验研究①
2020-07-13刘海萌
刘海萌 付 冠
(滨州医学院附属医院康复医学科,滨州 256603)
缺血性脑卒中(cerebral ischemic stroke,CI)又称脑梗死,是全世界三大致死疾病之一,具有发病率高、致残率高、复发率高的特点[1,2]。2009年WHO调查报告显示我国脑卒中发病率以每年8.7%的速度增长[3,4]。目前主要采取以支持治疗为主的综合治疗来改善缺血性脑卒中患者的神经功能障碍,仍缺乏有效的治疗手段。因此,寻找促进神经损伤修复的有效方法一直是国内外研究的热点。近年来随着干细胞研究的不断发展,间充质干细胞(mesenchymal stem cells,MSC)移植治疗缺血性脑卒中获得了较大关注。田立平等[5]采用人脐带血MSCs对90例脑梗死患者进行治疗,发现相比单纯药物治疗,该方法可进一步改善患者神经功能缺损症状。何霞等[6]采用骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BM-MSC)移植治疗实验性大鼠缺血性脑梗死,证实移植BM-MSCs有助于调节大鼠免疫,降低炎症因子水平,能促进神经功能早期恢复。
黄芪甲苷(Astragaloside Ⅳ,AsⅣ)为黄芪中重要的活性成分,是常用的补气中药,味甘、性微温,入肺归脾经,具有良好的补气、益中、养血、利水消肿、益卫固表、敛疮生肌的功效,被广泛应用于治疗缺血性脑血管病。刘海超等[7]研究证实黄芪甲苷可改善大鼠脑缺血再灌注氧化应激损伤,缓解免疫功能紊乱。李媛等[8]研究也证实黄芪甲苷可减轻大鼠局灶性脑缺血/再灌注损伤,保护神经细胞。本研究主要观察在BM-MSCs移植治疗大鼠脑缺血再灌注损伤后,给予AsⅣ灌胃治疗是否可进一步提升神经保护作用。
1 材料与方法
1.1材料
1.1.1细胞 SD大鼠BM-MSCs购于上海酶研生物科技有限公司。
1.1.2试剂 AsⅣ(84687-43-4)购于成都普利斯生物科技有限公司,纯度≥98%;HRP标记羊抗兔IgG购于厦门研科生物技术有限公司;p-STAT-3抗体(sc-293059)、STAT-3抗体(sc-293151)、GAPDH抗体(sc-47724)购于圣克鲁斯生物技术;放射免疫测定试剂盒(SHXFFMDC01)购于上海信帆生物科技有限公司;尼氏染色试剂盒(SBJ-0490)购于南京森贝伽生物科技有限公司。
1.1.3实验动物 成年雄性SD大鼠60只,体质量(230±26)g,SPF级,饲养于 24℃、相对湿度50%~60%、光12 h/暗12 h的环境中,自由进食水。术前禁食12 h,自由饮水。采用抽签法将60只SD大鼠随机分为正常组、模型组、单独细胞组与细胞+药物组,每组15只。实验过程中对动物的处置严格遵循动物伦理学要求,符合3R规则。
1.2方法
1.2.1BM-MSCs的培养与传代 复苏冻存的BM-MSCs,接种于T25培养瓶内,加入足量的完全培养基、置于37℃、5%CO2、饱和湿度的培养箱内培养。第2天更换新鲜的完全培养基,此后每2 d更换新鲜的完全培养基,当细胞达80%~90%的汇合度时进行消化传代,每2~3 d换液1次。选择第3代BM-MSCs进行移植实验。
1.2.2脑缺血再灌注损伤模型的建立 采用线栓法建立脑缺血再灌注损伤模型[9]:10%水合氯醛 40 mg/kg 腹腔注射麻醉大鼠,麻醉生效后将大鼠仰卧位固定在手术台上,颈部常规备皮消毒,取颈正中切口,逐层分离,显露左侧颈总动脉、颈内动脉和颈外动脉,结扎颈总动脉近心端与颈外动脉,以动脉夹夹闭颈内动脉,在颈总动脉与颈外动脉的分支上做一个小切口,导入栓线,随后松开动脉夹,将鱼线从颈总动脉插入颈内动脉,感觉到阻力时停止,以缝合线系住栓线,判定无活动性出血后缝合皮肤,术后2 h 取出线栓。以神经功能评分1~3分判定为造模成功。
取4组SD大鼠,正常组不做任何处理;其余3组大鼠建立脑缺血再灌注损伤模型。造模后第2天,单独细胞组、细胞+药物组尾静脉注射1 ml骨髓间充质干细胞悬液,约含细胞数5×106个,模型组尾静脉注射1 ml生理盐水,细胞+药物组灌胃给予黄芪甲苷50 mg/(kg·d)[7],模型组与单独细胞组灌胃给予等量生理盐水。如在造模过程中有动物死亡,参照同样方法造模,将实验动物补齐。
1.2.3实验取材 给药7 d后,进行神经功能行为学评分,评分后,10%水合氯醛以40 mg/kg腹腔注射麻醉大鼠,剖开胸腔,将灌流针从左心室插入升主动脉,以动脉夹固定,在右心耳放血,向右心耳注入生理盐水,当自右心耳流出的液体变清亮后,缓慢灌流40 g/L的多聚甲醛,待肝脏变硬后断头取脑,剥取大脑组织,进行以下检测。
1.2.4神经功能行为学评分 参照Longa等[10]方法进行神经功能行为学评分,见表1。
1.2.5炎症因子检测 将脑组织放入冰冷的盐水中,将皮质切为2~3 mm小片, 加入pH=4的PBS,均质器研磨获得匀浆液,4℃下3 000 r/min离心15 min,取上清液,利用放射免疫测定试剂盒检测TNF-ɑ与IL-1β浓度。
表1 神经功能行为学评分
Tab.1 Neurological behavioral score
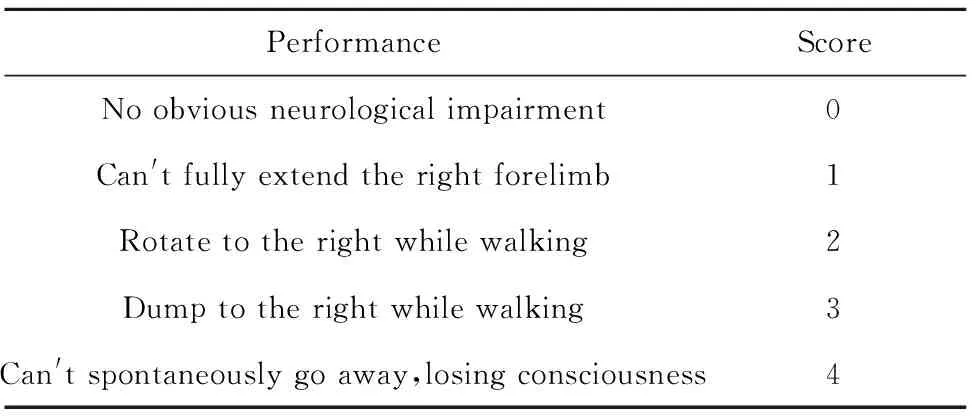
PerformanceScoreNo obvious neurological impairment0 Can't fully extend the right forelimb1 Rotate to the right while walking2Dump to the right while walking3 Can't spontaneously go away,losing consciousness4
1.2.6尼氏染色 取大鼠脑海马组织,制作冰冻切片,切片厚度3 μm,蒸馏水清洗2 min,尼氏体染色15 min,双蒸水清洗2次,95%乙醇分化5 s,常规脱水透明,中性树脂封固,显微镜下观察。
1.2.7脑组织形态学观察 取大鼠脑组织,40 g/L多聚甲醛4℃固定24 h,进行切片制作,常规苏木精-伊红染色,光镜下观察组织病理变化,每张切片随机取6个视野拍照。
1.2.8Western blot检测 取脑组织100 mg,加入400 μl蛋白裂解液,制备组织匀浆,采用BCA蛋白检测试剂盒检测蛋白浓度。取50 μg蛋白样品,加入6 μl 5×SDS-PAGE 蛋白上样缓冲液SDS Reducing Sample Buffer,充分混匀,100℃金属浴10 min;上样到 SDS-PAGE 凝胶电泳中分离蛋白,并转移至PVDF膜;5%脱脂奶粉室温封闭1~2 h; 加入稀释的一抗(p-STAT-3抗体、STAT-3抗体、GAPDH抗体)4℃孵育过夜,TBST清洗后,加HRP标记的二抗室温孵育1 h,ECL显影、曝光。
2 结果
2.1神经功能行为学评分 正常组神经功能行为学评分为0,无神经功能损伤;与正常组相比,模型组神经功能行为学评分明显升高,差异有统计学意义(P<0.05);与模型组相比,单独细胞组与细胞+药物组神经功能行为学评分明显降低,差异有统计学意义(P<0.05); 且细胞+药物组神经功能行为学评分低于单独细胞组,差异有统计学意义(P<0.05),见图1。

图1 各组大鼠神经功能行为学评分Fig.1 Neurological behavioral scores of rats in each groupNote:*.P<0.05,vs.Model;#.P<0.05,vs.Cell.
2.2脑组织形态学观察 苏木精-伊红染色后光镜下观察。正常组神经细胞形态、结构正常,无明显病理变化;模型组可见镂空筛网状软化病灶,间质水肿,病灶周围出现大量炎症细胞浸润,神经细胞变性、坏死,胞体皱缩,核固缩、碎裂、溶解;单独细胞组脑缺血区皮质病理损伤减轻,间质水肿程度减轻,变性和坏死的细胞数量明显减少;相对于单独细胞组,细胞+药物组病理改变进一步减轻,见图2。
2.3尼氏染色 正常组海马区锥体细胞排列规则紧密,细胞结构完整,胞浆内可见丰富的尼氏小体;模型组海马区锥体细胞缺失,排列混乱,细胞轮廓不清晰,胞浆内尼氏小体缩小;相较于模型组,单独细胞组与细胞+药物组海马区椎体细胞明显增加,排列规则有序,细胞轮廓也比较清晰,胞浆内尼氏小体变大,见图3。
2.4炎症因子浓度 与正常组对比,模型组TNF-α与IL-1β浓度明显升高,差异有统计学意义(P<0.05);与模型组对比,细胞组、细胞+药物组TNF-α与IL-1β浓度明显降低,差异有统计学意义(P<0.05);与细胞组对比,细胞+药物组TNF-α与IL-1β浓度明显降低,差异有统计学意义(P<0.05),见图4。
2.5Western blot检测 与正常组对比,模型组、细胞组、细胞+药物组STAT-3蛋白表达无明显变化;与正常组对比,模型组p-STAT-3蛋白表达明显升高,差异有统计学意义(P<0.05);与模型组对比,细胞组、细胞+药物组p-STAT-3蛋白表达明显降低,差异有统计学意义(P<0.05);与细胞组对比,细胞+药物组p-STAT-3蛋白表达降低,差异有统计学意义(P<0.05),见图5。

图2 各组脑组织形态学观察(苏木精-伊红染色,×100)Fig.2 Histomorphological observation of brain in each group(HE staining,×100)

图3 各组脑组织海马区尼氏染色(×200)Fig.3 Nissl staining of hippocampus in each group (×200)

图4 各组脑组织炎性因子水平(n=3)Fig.4 Inflammatory factors in brain tissue of each group (n=3)Note:*.P<0.05,vs.Control;#.P<0.05,vs.Model;△.P<0.05,vs.Cell.

图5 各组脑组织STAT-3与p-STAT-3蛋白表达(n=3)Fig.5 Expression of STAT-3 and p-STAT-3 protein in brain tissue of each group (n=3)Note:*.P<0.05,vs.Control;#.P<0.05,vs.Model;△.P<0.05,vs.Cell.
3 讨论
CI是由多种病因引起的脑动脉闭塞导致脑组织缺血缺氧,进一步导致脑组织出现兴奋性毒性、线粒体功能失调、氧化应激、炎症、离子失衡及酸中毒现象,最终导致脑组织不可逆性损伤,神经细胞坏死,出现神经功能及认知功能缺失。临床研究发现,大脑中动脉闭塞是缺血性脑血管疾病常见的发病部位,通过大脑中动脉栓塞而制作的局灶性脑缺血再灌注模型是目前最接近于人类的缺血性脑卒中模型,也是体内评价抗脑缺血药物效果和探究相应机制的重要模型[11]。由于大鼠大脑中动脉的解剖分布与基底节区血流供应与人类具有极高的相似度,并且大鼠血管变异程度小、抗感染能力强、成本低、存活时间较长,成为实验室现阶段常选用的脑缺血实验动物模型。因此,本实验选择SD大鼠作为脑缺血再灌注损伤的实验动物模型。
在中医理论指导下,大多数人认为CI的病理基础是气虚血瘀、脉络闭阻,以气虚为本,血瘀为标,故缺血性卒中多呈本虚标实,中药治疗以“补气活血通络”为主。而AsⅣ为黄芪中重要的活性成分,是常用的补气中药,可用于治疗CI。体外研究显示,AsⅣ可促进神经干细胞的增殖,诱导BM-MSCs分化为神经细胞[12,13]。因此,本研究采用动物体内实验进一步观察AsⅣ对BM-MSCs移植治疗脑缺血再灌注损伤的影响。采用线栓法建立大鼠脑缺血再灌注损伤模型后,大鼠神经功能严重受损,海马区锥体细胞缺失,排列混乱,细胞轮廓不清晰,胞浆内尼氏小体缩小,神经功能行为学评分明显升高,炎症因子水平明显升高,提示实验造模成功。BM-MSCs移植后,脑缺血再灌注损伤大鼠的神经病理改变有所减轻,海马区椎体细胞明显增加,排列规则有序,细胞轮廓也比较清晰,胞浆内尼氏小体变大,神经功能行为学评分明显降低,炎症因子水平明显降低,提示BM-MSCs对脑缺血再灌注损伤大鼠脑神经具有保护作用,与以往的研究结果一致[14,15]。在BM-MSCs移植治疗的基础上,AsⅣ可进一步提升骨髓间充质干细胞的治疗效果,提示AsⅣ可进一步增强BM-MSCs的脑神经保护作用。
研究发现JAK-STAT信号通路在脑缺血再灌注损伤中发挥重要作用[16]。STATs是JAK-STAT 信号通路中JAKs的下游底物,STAT-3蛋白是其中重要成员之一,广泛分布于神经系统。但目前对于STAT-3在脑缺血再灌注损伤中的作用还没有定论,有学者认为STAT-3在脑缺血再灌注损伤后活化,参与脑缺血再灌注损伤的发生与发展[17];还有学者认为STAT-3活化可通过抑制细胞凋亡而发挥神经保护作用[18,19]。本研究结果显示,脑缺血再灌注损伤大鼠脑组织p-STAT-3蛋白表达升高,提示STAT-3蛋白参与了脑缺血再灌注损伤的发生;而BM-MSCs移植可降低脑缺血再灌注损伤引发的p-STAT-3蛋白表达升高,AsⅣ可进一步增强BM-MSCs对p-STAT-3蛋白表达的抑制作用。因此推测AsⅣ进一步增强BM-MSCs修复大鼠脑缺血再灌注损伤效果的作用途径可能与降低p-STAT-3蛋白表达有关。由于中枢神经系统的抑制与再生机制非常复杂,关于AsⅣ如何作用于STAT-3信号通路且是否还有其他因子的参与还需要进一步的实验验证。
