益生菌对苏尼特羊胃肠道菌群、代谢物及肉品质的影响
2020-07-13王柏辉罗玉龙宝勒格赵丽华
杜 瑞,靳 烨,王柏辉,罗玉龙,宝勒格,赵丽华,苏 琳,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018;2.内蒙古巴彦淖尔市乌拉特中旗农牧和科技局,内蒙古 巴彦淖尔 015300)
苏尼特羊是内蒙古独特的优良羊种,具有育肥能力强、脂肪率低、抗病性强、遗传性能稳定等优点,在我国得到了广泛的推广[1]。苏尼特羊的优良特性不仅与遗传基因有关,还与肠道中的微生物有关。目前,羊肉生产中存在抗生素滥用的现象,因此寻找安全、高效的绿色添加剂替代抗生素是畜牧业的研究热点之一,而益生菌有着安全、高效、低成本的特点,可作为抗生素潜在的替代品,其中嗜酸乳杆菌、链球菌、干酪乳杆菌和植物乳杆菌,能在宿主的消化系统中定植,改善菌群结构,抑制病原微生物,提高畜禽的产肉性能,因此添加益生菌可有效调节畜禽的胃肠道菌群,并在改善肉用品质方面有巨大的潜力[2-3]。国内外的一些学者已经报道了益生菌改善畜禽肉品质的研究,Wang Hesong等[4]将乳杆菌加入到肉鸡的饲料中,发现鸡肠道中的菌群多样性增加,肉中的脂肪沉积降低,鸡的生长性能得到改善。张天阳[5]和赵秀英[6]等给猪饲喂乳酸菌发现,乳酸菌能改善猪的肠道菌群结构,改变厚壁菌门与拟杆菌门的比例,改善肉的风味及嫩度。Herdian等[7]在绵羊饲料中添加益生菌,发现羊肉品质得到明显的改善,肉的保水性提高,且胆固醇含量降低。Li Xiuliang等[8]将复合植物乳杆菌(Lactobacillus plantarum)和发酵乳杆菌(Lactobacillus fermentum)加入高脂小鼠的饲粮中,发现小鼠的肠道菌群发生改变,其中双歧杆菌(Bifidobacterium)的数量增加,大肠杆菌(Enterobacterium)的数量降低。
胃肠道微生物群是一个信号枢纽,它能将饮食等环境输入与影响宿主新陈代谢、免疫和感染反应的遗传和免疫信号结合起来,在饲粮中加入益生菌有助于在胃肠道中建立和维持合适的微生物区系[9-10]。因此,本实验通过饲粮中添加复合益生菌(植物乳杆菌和干酪乳杆菌)研究其对肉羊胃肠道菌群、代谢物及肉品质的影响,以期改善舍饲羊的肉品质,并为益生菌在肉羊产业中的应用提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
3 月龄的苏尼特羊12 只((16.72±1.32)kg)选自内蒙古巴彦淖尔市乌拉特中旗川井苏木哈拉图嘎查顺遂农牧专业合作社,分为对照组和益生菌组(每组6 只),经过7 d的预饲期后,进行90 d的饲喂实验。对照组饲喂基础饲粮,饲粮成分为青贮饲料8 kg、葵花饼5 kg和育肥饲料10 kg,并且每月依次增加青贮饲料8 kg、葵花饼5 kg和育肥饲料1 kg;益生菌组则在基础饲粮中加入60 g复合乳酸菌(1.50×109CFU/g复合益生菌);该动物程序由内蒙古农业大学动物保护和使用委员会批准,并按照科技部《实验动物指南》执行,该研究不涉及任何濒危或受保护物种。
肉羊屠宰放血后采集背最长肌,取500 g用于羊肉品质分析;从直肠中收集粪便样品置于50 mL无菌离心管中用于肠道微生物分析。取4 层纱布过滤瘤胃内容物,收集瘤胃液于2 mL无菌无酶冻存管中,粪便和瘤胃液样品均液氮运输,并保存在-80 ℃冰箱待测。
甘油三酯(triglyceride,TG)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测定试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)测定试剂盒 南京建成生物工程研究所;乳酸菌(植物乳杆菌Lactobacillus plantarum HM-10)、干酪乳杆菌(Lactobacillus casei HM-09)的乳安邦复合微生态制剂 内蒙古和美科盛生物技术有限公司。
1.2 仪器与设备
胴体直测型pH计、TC-P2A全自动色差计 北京奥依克光电仪器有限公司;CL-M嫰度仪 东北农业大学工程学院;GRX-9053A型热空气干燥箱 上海一恒科技有限公司;5424R高速台式冷冻离心机 德国Eppendorf公司;NanoDrop2000超微量分光光度计 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 胃肠道微生物菌群的测定
1.3.1.1 总DNA提取
采用QIAamp DNA Stool Mini Kit试剂盒提取细菌总DNA,用核酸浓度测定仪测定总DNA浓度,于-20 ℃保存备用。
1.3.1.2 菌群Illumina Miseq测序
选取16S rDNA的V4~V5区序列进行高通量测序分析。进一步对目的聚合酶链式反应产物进行文库构建,由上海美吉生物医药科技有限公司在Illumina MiSeq平台上完成测序。
1.3.1.3 生物信息学分析
使用QIIME分析平台开展序列的生物信息学分析[11-12]。PyNAST校准排齐序列,以100%相似性进行UCLUST归并从而建立无重复的926R→515F序列集。采用两步UCLUST归并,在100%相似性归并的基础上进一步进行97%相似性的归并,从而建立操作分类单元(operational taxonomic units,OTUs)。通过Chimera Slayer检测充分去除属于嵌合体的OTU。将OTU代表性序列通过RDP和Greengenes(Release13.8)数据库进行同源性比对,整合两个数据库的比对结果,确定每个OTU最终的分类学地位[13]。对样品进行VENN和主坐标分析。Alpha多样性计算对样品菌群构成的丰度和多样性进行评价。
1.3.2 血脂指标测定
采用分光光度法,根据试剂盒的使用说明书测定血液中TG、TC、HDL-C和LDL-C的浓度。
1.3.3 短链脂肪酸含量测定
1.3.3.1 短链脂肪酸标准曲线的绘制
取短链脂肪酸标准品(纯度为99%)1 mL用甲醇定容至10 mL容量瓶中,依次稀释为6 个梯度(10-1、10-2、10-3、10-4、10-5、10-6)。
1.3.3.2 短链脂肪酸的提取
称取粪便(0.1~0.2 g)与2 mL冰生理盐水,1 mL体积分数50%的硫酸溶液漩涡混匀后离心(10 000 r/ min,5 min),再加入2 mL乙醚充分混匀并离心(10 000 r/min,5 min),静置后取上清液,用0.22 μm有机滤膜过滤后保存待用。
1.3.3.3 气相色谱-质谱条件
气相色谱条件:TR-5色谱柱(30 m×0.25 mm,0.25 μm),载气流速1.2 mL/min,进样口温度250 ℃。程序升温为:初始温度为100 ℃,保持0.5 min,以8 ℃/min升至180 ℃,保持1 min;再以20 ℃/min升至200 ℃,保持5 min。进样量为1 μL,分流比10∶1。
质谱条件:离子源温度250 ℃,传输线温度250 ℃,质量扫描范围m/z 40~450。
1.3.4 羊肉品质测定
肉品质测定参照罗玉龙等[14]的方法,包括肉色、pH值、嫩度和熟肉率。
1.3.4.1 pH值测定
肉羊屠宰后,使用胴体直插式pH计分别测定宰后45 min和24 h背最长肌的pH值,记作pH0和pH24。
1.3.4.2 色泽测定
将肌肉切成3 cm×3 cm×1 cm的肉块,用TC-P2A全自动色差计测定肌肉色差。L*值表示亮度;a*值表示红度;b*值表示黄度。
1.3.4.3 嫩度测定
沿羊肉的肌纤维方向进行取样,肉样排酸24 h后,于水浴锅中75 ℃蒸煮45 min,取出室温冷却后用滤纸擦干表面水分,沿肌纤维方向将其切成3 cm×1 cm×1 cm形状的肉条,用嫩度仪测定剪切力值。
1.3.4.4 熟肉率测定
取50 g左右的肉样记录煮前质量(m1/g),然后在水浴锅中85 ℃煮制40 min,室温冷却后,擦干表面水分,记录煮后质量(m2/g),按照下式计算熟肉率。
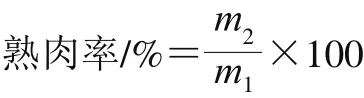
1.4 数据统计分析
数据用SPSS 19.0统计软件进行单因素方差分析和相关性分析(Pearson系数),以P<0.05表示差异显著,以P<0.01表示差异极显著,采用Origin 8.0和Excel 2010软件作图。
2 结果与分析
2.1 益生菌对苏尼特羊胃肠道菌群组成的影响
胃肠道微生物是“第二基因组”,在调节宿主代谢、营养和免疫中扮演着重要角色,而胃肠道菌群失调会引起一系列疾病。通过高通量测序技术对两组羊瘤胃和粪便样品进行测序分析可知:门水平上,胃肠道菌群以拟杆菌门和厚壁菌门为主;在属水平上,测序结果中丰度大于1%的主要包括拟杆菌属、普雷沃菌属和瘤胃球菌属等。
2.1.1 益生菌对苏尼特羊瘤胃菌群组成的影响
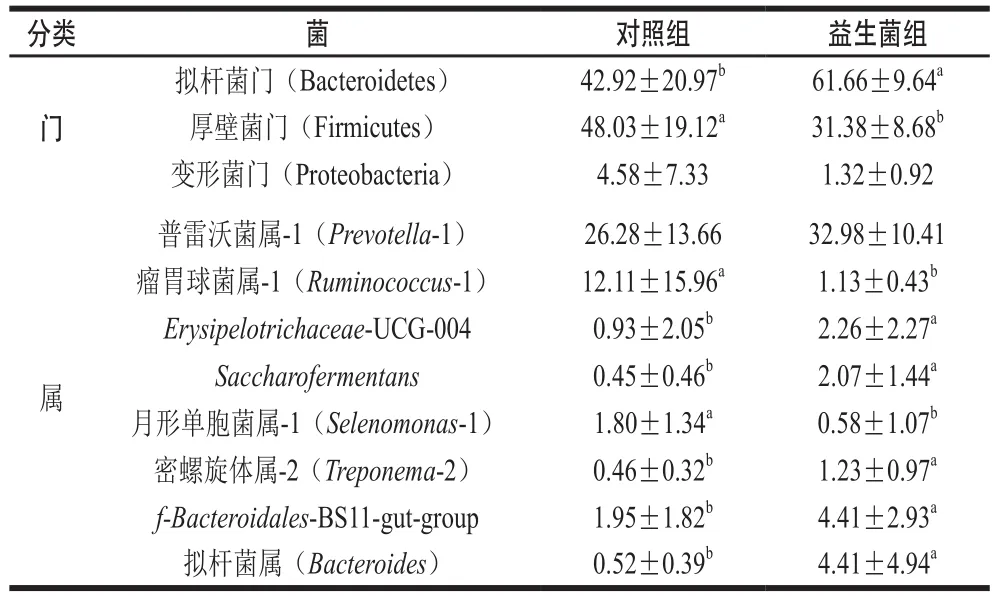
表1 益生菌对苏尼特羊瘤胃微生物相对丰度的影响Table 1 Effect of probiotics on the relative abundance of rumen microflora in Sunit lambs%
由表1可知,在门水平上共检测到25 种细菌微生物,主要包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria),这与Thoetkiattikul等[15]研究结果一致。其中益生菌组中拟杆菌门的相对丰度显著高于对照组(P<0.05),厚壁菌门的相对丰度显著低于对照组(P<0.05),而变形菌门没有显著差异(P>0.05)。厚壁菌门和拟杆菌门均有助于宿主代谢,调节脂质代谢,从而提升能量效率,其中拟杆菌门是促进动物利用碳水化合物的优势菌群,而厚壁菌门是促进动物胃肠道微生物分解纤维素的优势菌群[16-17]。在本实验的结果中,瘤胃中的菌群结构发生变化,这可能与益生菌进入动物瘤胃后,拟杆菌门的数量增加,厚壁菌门的数量降低,厚壁菌门与拟杆菌门的比例改变,能抑制有害菌的生长,维持肠道菌群结构的稳态有关[18]。研究发现,厚壁菌门与拟杆菌门的比值降低,有利于改善畜禽肉的风味[19]。
在属水平上共检测到489 种细菌微生物,苏尼特羊瘤胃中主要包括的微生物(相对丰度大于1%)有:普雷沃菌属-1(Prevotella-1)、瘤胃球菌属-1(Ruminococcus-1)、Erysipelotrichaceae-UCG-004、Saccharofermentans和拟杆菌属(Bacteroides)等。在表1中,益生菌组中f-Bacteroidales-BS11-gut-group(P<0.05)、拟杆菌属(P<0.05)、Erysipelotrichaceae-UCG-004(P<0.05)、密螺旋体属-2(Treponema-2)(P<0.05)和Saccharofermentans(P<0.05)的相对丰度显著高于对照组,而月形单胞菌属-1(Selenomonas-1)(P<0.05)和瘤胃球菌属(P<0.05)的相对丰度显著低于对照组。拟杆菌属(Bacteroides)在帮助宿主分解多糖用于提高营养利用率、加快肠黏膜的血管形成、免疫系统发育及提高宿主的免疫力、维持肠道微生态平衡等方面有着重要作用,在饲粮中添加益生菌能提高拟杆菌属的数量[20-22]。对照组羊瘤胃中分布着大量的瘤胃球菌,能促进瘤胃中不饱和脂肪酸的生物氢化,这不利于不饱和脂肪酸在肉中的沉积。整体上,添加益生菌可以增加羊瘤胃中拟杆菌属和部分瘤胃球菌属的数量,改善瘤胃菌群结构,这对机体多糖等营养物质及纤维素酶分解有益[23]。
2.1.2 益生菌对苏尼特羊肠道菌群组成的影响
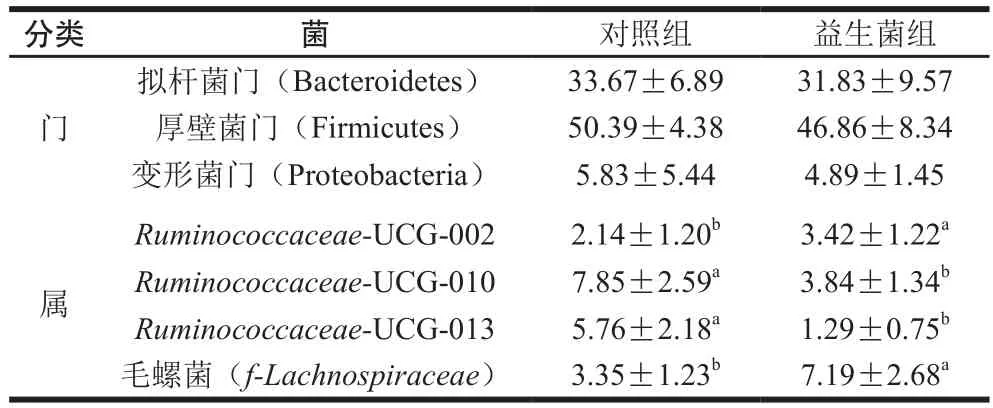
表2 益生菌对苏尼特羊肠道微生物相对丰度的影响Table 2 Effect of probiotics on the relative abundance of intestinal microflora in Sunit lambs%
肠道微生物的组成与多样性有助于维持肌肉的正常生长和代谢[24]。表2中呈现了苏尼特羊肠道中门和属水平上相对丰度较高的微生物。在门水平上,苏尼特羊肠道中共检测到17 种细菌微生物,优势菌门为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria),这些微生物能够有效降解纤维、提高碳水化合物的利用率,进而促进消化,这与瘤胃中的主要微生物呈现一致性,但对照组和益生菌组中的肠道微生物数量不显著(P>0.05)。相比于瘤胃,益生菌组肠道中的拟杆菌门数量下降,而厚壁菌门数量增加,和对照组比较接近,说明益生菌对肠道菌群的影响低于瘤胃。
在属水平上共检测到249 种细菌微生物。苏尼特羊肠道中主要包括的微生物(相对丰度大于1%):Ruminococcaceae-UCG-002、Ruminococcaceae-UCG-010、Ruminococcaceae-UCG-013和毛螺菌(f-Lachnospiraceae)等,这些优势菌不仅能维持肠道的健康稳定水平,而且还能参与剩余营养物质的消化吸收,防止养分的流失。益生菌组中毛螺菌(P<0.05)和Ruminococcaceae-UCG-002(P<0.05)的相对丰度显著高于对照组,而Ruminococcaceae-UCG-010(P<0.05)和Ruminococcaceae-UCG-013(P<0.05)的相对丰度显著低于对照组。Zhang Hao等[25]研究绵羊的肠道菌群发现,菌群的优势菌属为拟杆菌属(Bacteroides)、瘤胃球菌属(Ruminococcus)、乳酸菌属(Lactobacillus)和梭菌属(Clostridium),并且随着肠道的后移(从空肠、盲肠到直肠)乳酸菌属减少,拟杆菌属逐渐增多,这使得乳酸菌属对肠道菌群的影响减少。
2.2 益生菌对苏尼特羊胃肠道微生物代谢物的影响
2.2.1 益生菌对苏尼特羊瘤胃微生物代谢物的影响
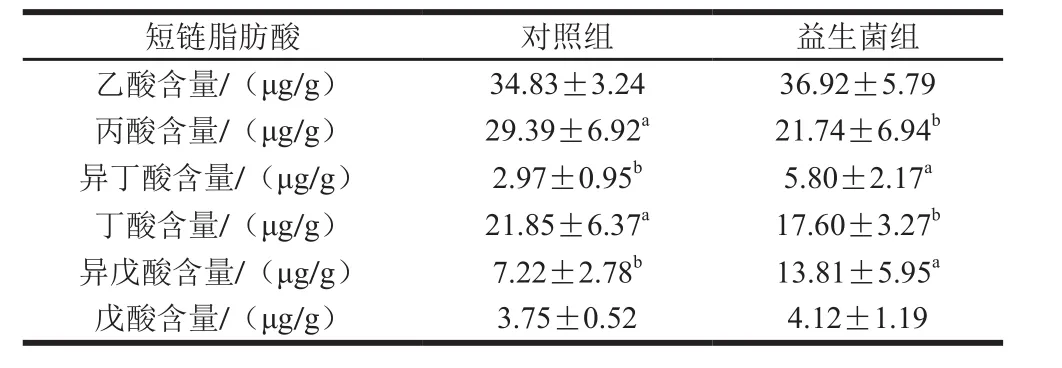
表3 益生菌对苏尼特羊瘤胃微生物短链脂肪酸含量的影响Table 3 Effect of probiotics on contents of ruminal short chain fatty acids in Sunit lambs
由表3可知,益生菌对苏尼特羊瘤胃微生物的短链脂肪酸代谢有显著影响。益生菌组的丙酸和丁酸含量显著低于对照组(P<0.05),而异丁酸和异戊酸含量显著高于对照组(P<0.05),乙酸和戊酸在两组之间没有显著差异(P>0.05)。动物摄食后先进入瘤胃消化,瘤胃微生物参与大部分的代谢,代谢产物主要有短链脂肪酸,包括乙酸、丙酸、丁酸、戊酸和异戊酸等。短链脂肪酸可作为主要的能源物质,为脂肪代谢、蛋白质代谢和碳水化合物代谢等提供能量[26]。
2.2.2 益生菌对苏尼特羊肠道微生物代谢物的影响
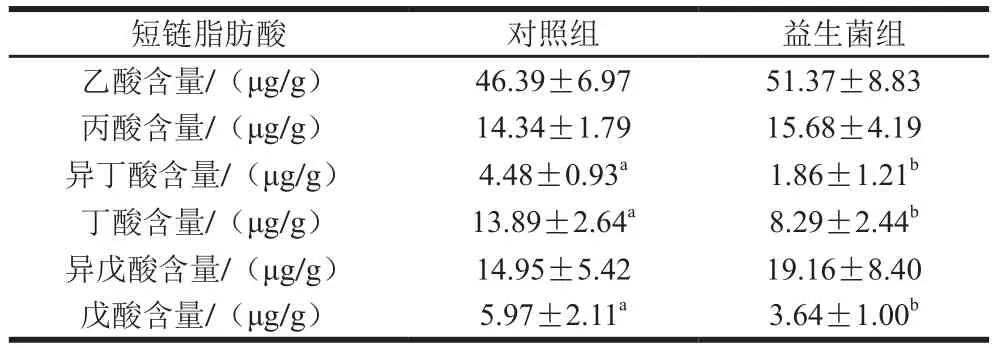
表4 益生菌对苏尼特羊肠道微生物短链脂肪酸含量的影响Table 4 Effect of probiotics on contents of intestinal short chain fatty acids in Sunit lambs
肠道菌群能分解营养物质,并代谢产生一些代谢产物,包括短链脂肪酸、多不饱脂肪酸和胆汁酸等,其中短链脂肪酸既可作为后肠的能量物质,又可以维持肠道屏障功能和调节肠道动力。由表4可知,在苏尼特羊肠道微生物代谢物中,益生菌组的丁酸、异丁酸和戊酸含量显著低于对照组(P<0.05),而乙酸、丙酸和异戊酸含量在两组之间没有显著差异(P>0.05)。丙酸等短链脂肪酸可通过影响糖代谢参与机体的能量代谢,影响肌肉的生长发育。Walsh等[27]研究发现,丁酸能增加肌肉的质量及活性氧和线粒体水平,抑制肌肉萎缩。异丁酸主要来源于微生物对未消化蛋白质的发酵,其浓度高低可反映肠道中未消化蛋白量,益生菌组中的异丁酸浓度低,说明乳酸菌能促进苏尼特羊对蛋白质的消化,因而肠道中未消化的蛋白质相对较少。总之,饲粮中加入益生菌能够调节肠道菌群的数量,进而改变的菌群代谢物,并最终影响肌肉的生长和功能。
2.3 益生菌对苏尼特羊血脂指标的影响

表5 益生菌对苏尼特羊血脂指标的影响Table 5 Effect of probiotics on plasma lipid parameters of Sunit lambs
血液生化指标能反映动物脂肪代谢和能量的利用情况,由表5可知,益生菌对苏尼特羊血液中的代谢指标有影响,其中益生菌组血液中HDL-C的浓度显著高于对照组(P<0.05),LDL-C浓度显著低于对照(P<0.05),说明饲粮添加益生菌可显著增加血液中高密度脂蛋白含量,降低低密度脂蛋白含量。研究发现:日粮能影响动物血液的代谢物,进而影响机体脂肪沉积,其中低密度脂蛋白能将胆固醇和TG转运到肝外组织细胞中贮存和利用;而高密度脂蛋白则是将肝外组织中过多的胆固醇转运到肝脏代谢,防止胆固醇在这些组织中过多的聚集[28]。Huang Ying等[29]在饲粮中添加植物乳杆菌可降低高胆固醇血症小鼠的TG和LDL含量进而促进小鼠机体健康,这与本实验的研究结果一致。因此,饲粮添加益生菌可通过调节高低密度脂蛋白含量改善机体血液脂质代谢水平。
2.4 益生菌对苏尼特羊肉品质的影响

表6 益生菌对苏尼特羊肉品质的影响Table 6 Effect of probiotics on meat quality of Sunit lambs
肉的pH值是决定肉品质的重要因素,实验中两组羊肉的pH值均在正常范围内。如表6所示,益生菌组羊肉pH24值显著低于对照组(P<0.05),饲粮中添加益生菌后可改变宰后羊肉机体内糖酵解速率,使肉中的乳酸增多,进而降低了肉的pH值。色泽能直观评价衡量肉质的好坏,益生菌组羊肉的a*值显著高于对照组(P<0.05),而b*值显著低于对照组(P<0.05),说明益生菌可以提高羊肉的红度值,降低肉的黄度值,从而改善肉的色泽,这与朱爱文等[30]的研究结果一致。研究发现给家禽饲喂乳杆菌也能提高肉的红度值[31]。
嫩度是反映肉质地的重要指标之一,益生菌组的剪切力值显著低于对照组(P<0.05),说明益生菌组的肉较嫩,乳酸菌能改善肉的嫩度,这与张天阳[5]的研究结果一致。分析其原因可能是益生菌改善了苏尼特羊的菌群结构,促进了肉中脂肪的沉积,肌内脂肪增加可使肌纤维的密度降低,并减少肌纤维间的联结组织,进而改善了嫩度[32-33]。本实验中益生菌对羊肉的熟肉率没有显著影响,这验证了Alfaig等[34]的研究结果。但有研究表明,益生菌的添加可降低肉的滴水损失,提高肉的保水力,从而降低熟肉率[35]。
2.5 苏尼特羊胃肠道菌群与代谢产物之间的相关性
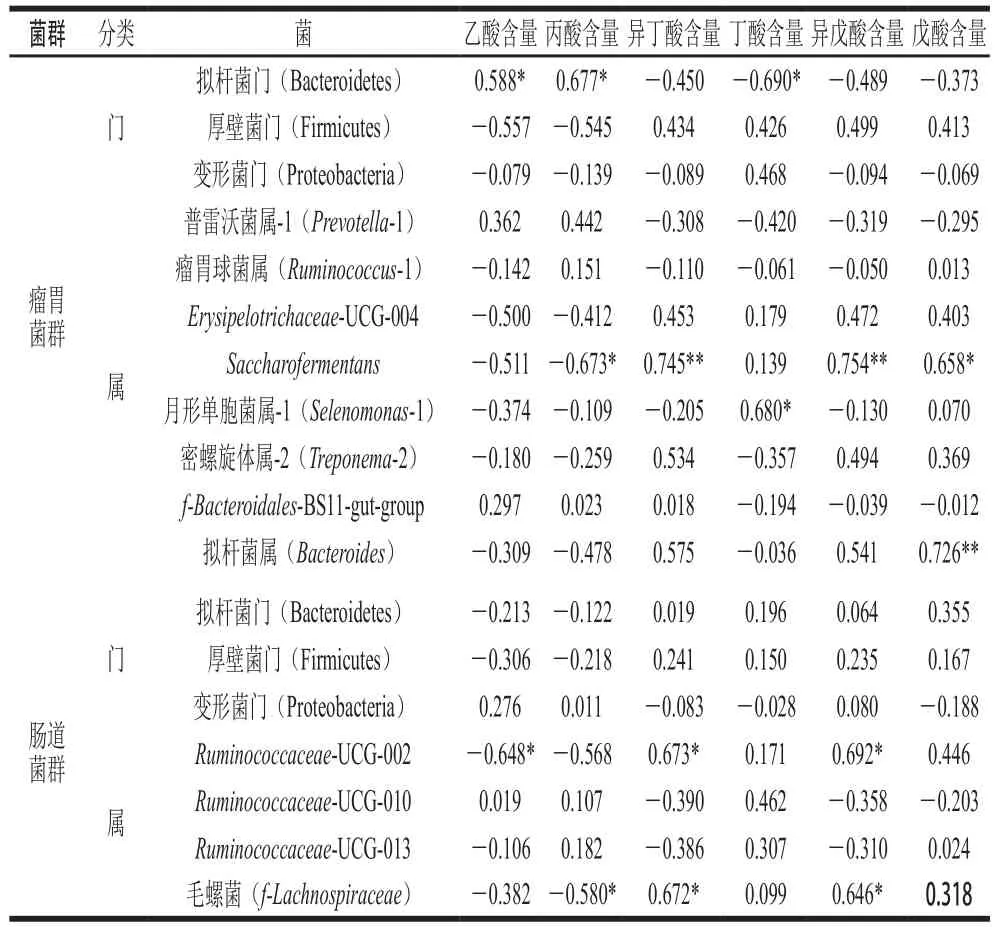
表7 胃肠道菌群与代谢产物的相关性分析Table 7 Correlation coefficients between rumen and gut microbiota and metabolites
由表7可知,瘤胃菌群中的拟杆菌门相对丰度与乙酸、丙酸含量呈显著正相关(P<0.05),与丁酸含量呈显著负相关(P<0.05),这表明拟杆菌门能促进乙酸、丙酸的生成,但能抑制丁酸的产生;Saccharofermentans相对丰度与异丁酸(P<0.01)、异戊酸(P<0.01)和戊酸含量(P<0.05)呈显著正相关,与丙酸呈显著负相关(P<0.05);月形单胞菌属-1相对丰度与丁酸含量呈显著正相关(P<0.05);拟杆菌属相对丰度与戊酸含量呈极显著正相关(P<0.01)。瘤胃微生物可分解可溶性的膳食纤维产生短链脂肪酸,主要包括乙酸、丙酸和丁酸。在本研究中,益生菌组中的异丁酸和异戊酸含量显著高于对照组,说明益生菌能够调节瘤胃菌群,进而促进丙酸和丁酸的生成。
在肠道菌群中,Ruminococcaceae-UCG-002相对丰度与异丁酸、异戊酸含量呈显著正相关(P<0.05),与乙酸含量呈显著负相关(P<0.05);毛螺菌相对丰度与异丁酸、异戊酸含量呈显著正相关(P<0.05),与丙酸含量呈显著负相关(P<0.05);这说明Ruminococcaceae-UCG-002和毛螺菌均能促进异丁酸和异戊酸的生成;在本研究中发现摄入益生菌可对肉羊粪便短链脂肪酸中的乙酸和丙酸含量有上调作用;这两种脂肪酸对机体有促进细胞代谢、影响肌肉生长等积极作用[36]。
2.6 苏尼特羊胃肠道菌群与血脂指标之间的相关性
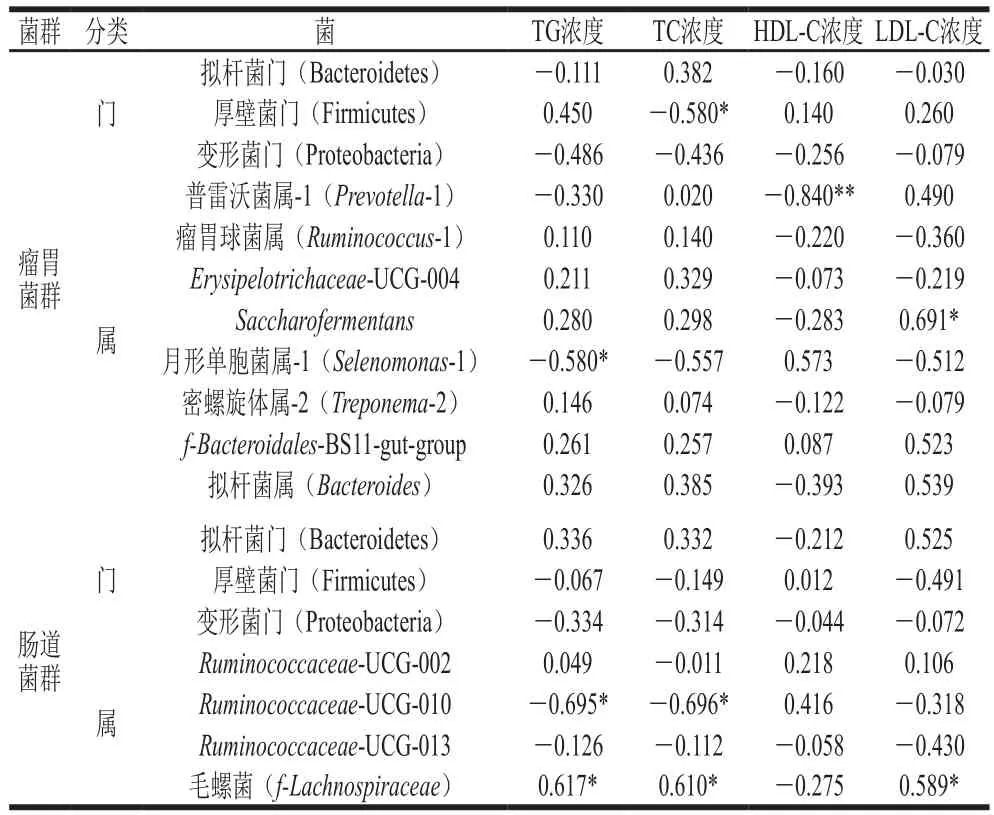
表8 胃肠道菌群与血脂指标之间的相关性分析Table 8 Correlation coefficients between rumen and gut microbiota and plasma lipid parameters
通过分析胃肠道微生物与血脂指标的关系可知(表8),在瘤胃菌群中,Saccharofermentans相对丰度与LDL-C浓度呈显著正相关(P<0.05);厚壁菌门相对丰度与TC浓度呈显著负相关(P<0.05);月形单胞菌属-1相对丰度与TG浓度呈显著负相关(P<0.05);普雷沃菌属-1相对丰度与HDL-C浓度呈极显著负相关(P<0.01);说明瘤胃菌群中Saccharofermentans能促进LDL-C的产生,而厚壁菌门能抑制TC的生成,月形单胞菌属-1能抑制TG的生成,普雷沃菌属-1则能抑制HDL-C生成。
在肠道菌群中,Ruminococcaceae-UCG-010相对丰度与TG、TC浓度呈显著负相关(P<0.05),说明Ruminococcaceae-UCG-010能抑制TG和TC的生成;毛螺菌相对丰度与TG、TC、LDL-C浓度呈显著正相关(P<0.05)。有研究发现毛螺菌丰度与动脉粥样硬化患者血浆中TC和LDL-C的浓度呈正相关(P<0.05),其原因是NPC1L1蛋白是介导小肠对胆固醇吸收的关键蛋白质,益生菌能够抑制肠道NPC1L1蛋白的表达,从而降低血液中的TC和LDL-C浓度[37]。
2.7 苏尼特羊胃肠道菌群与肉品质之间的相关性
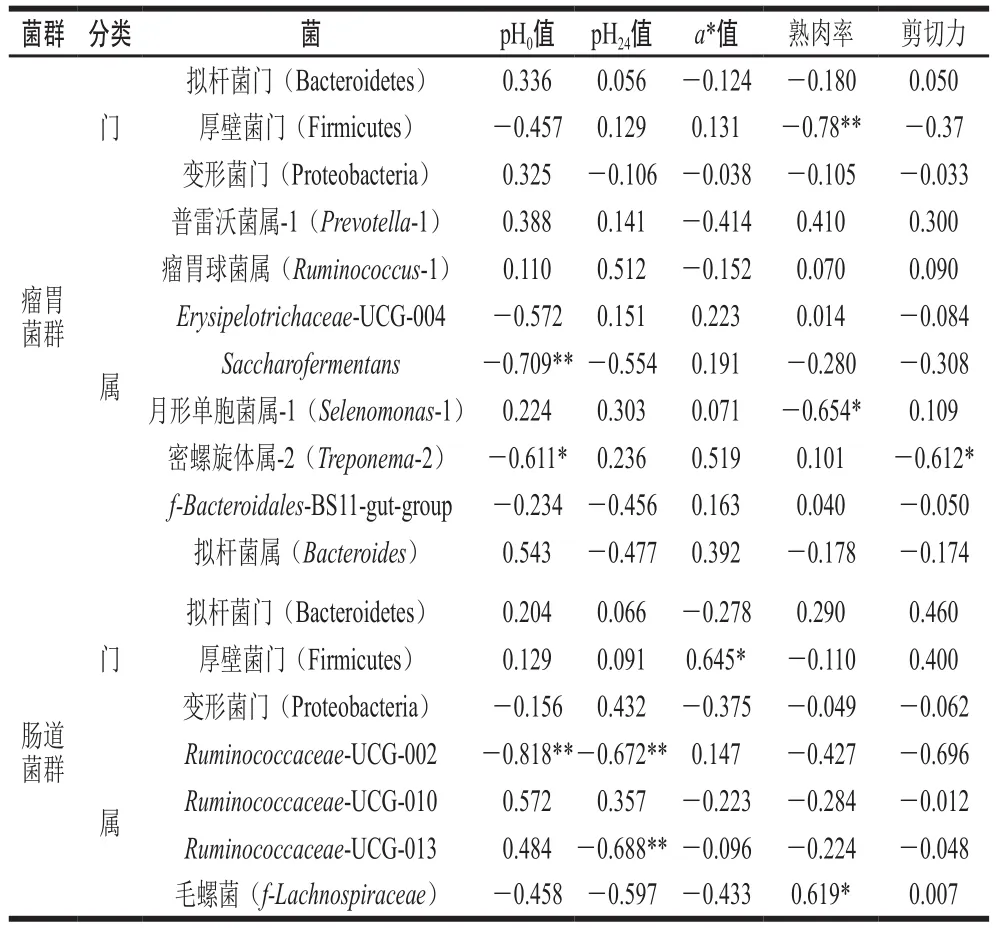
表9 胃肠道菌群与肉品质的相关性分析Table 9 Correlation coefficients between rumen and gut microbiota and meat quality
胃肠道菌群与肉品质的相关性分析结果见表9,在瘤胃菌群中,Saccharofermentans相对丰度与pH0值呈极显著负相关(P<0.01),厚壁菌门相对丰度与熟肉率呈极显著负相关(P<0.01),月形单胞菌属-1与熟肉率呈显著负相关(P<0.05),密螺旋体属-2与pH0值、剪切力呈显著负相关(P<0.05);研究发现Saccharofermentans增多能促进肠道中短链脂肪酸的生成,其中60%~70%被用于能源物质,其余的进入肌肉组织并引起了肉pH值的降低[38-39]。
在肠道菌群中,厚壁菌门相对丰度与a*值呈显著正相关(P<0.05),本研究发现益生菌能够提高肉的红度,这可能是益生菌改变了肠道中厚壁菌门和拟杆菌门的比例,促进了肉中肌红蛋白的合成,进而调控肉色。Ruminococcaceae-UCG-002与pH0、pH24值呈极显著负相关(P<0.01),Ruminococcaceae-UCG-013与pH24值呈极显著负相关(P<0.01),说明肠道中的一些菌属能降低pH值,使肉的pH值保持在正常的范围内。毛螺菌相对丰度与熟肉率呈显著正相关(P<0.05),目前关于毛螺菌影响肉保水性的机理仍不明确,这可能与细胞因子的变化有关[40]。
3 结 论
饲粮中添加益生菌能影响胃肠道菌群的组成,其中益生菌组羊瘤胃菌群中拟杆菌门、拟杆菌属和f-Bacteroidales-BS11-gut-group的相对丰度增加;肠道菌群中毛螺菌和Ruminococcaceae-UCG-002的相对丰度增加。在胃肠道代谢物中,益生菌组瘤胃中的丙酸和丁酸含量降低;益生菌组的肠道中的丁酸、异丁酸和戊酸含量降低;血脂指标中,益生菌组的HDL-C浓度增加,LDL-C浓度降低;肉品质中,益生菌组羊肉的pH24值和剪切力值降低,而a*值增加。苏尼特羊胃肠道菌群相对丰度与代谢物、血脂指标、肉品质的相关性分析中,瘤胃菌群中的拟杆菌门相对丰度与乙酸、丙酸含量呈显著正相关(P<0.05);肠道菌群的Ruminococcaceae-UCG-002相对丰度与异丁酸、异戊酸含量呈显著正相关(P<0.05);肠道菌群的毛螺菌相对丰度与TG、TC、LDL-C浓度呈显著正相关(P<0.05);肠道菌群的厚壁菌门相对丰度与a*值呈显著正相关(P<0.05)。
