早期控制冠状动脉粥样硬化患者的心外膜脂肪体积及炎症因子水平对纤维斑块稳定性的影响*
2020-07-09李大主方叶青谢培益华中科技大学协和深圳医院心血管内科广东省深圳市58000华中科技大学同济医学院附属协和医院心血管内科
王 磊 李大主 艾 文 方叶青 谢培益 华中科技大学协和深圳医院心血管内科,广东省深圳市 58000; 华中科技大学同济医学院附属协和医院心血管内科
冠状动脉粥样硬化会造成动脉血管狭窄或梗阻,临床上大多数会引发高血压、高血脂、糖尿病等心脑血管疾病。心外膜脂肪聚集与心脏及冠状动脉四周,其中单核—巨噬细胞通过扩散而作用于邻近细胞的激素传递方式产生炎症因子,聚集于上皮细胞,对纤维斑块的形成十分重要[1]。炎症因子是很多疾病产生和发展十分重要的中间物质,可促进冠状动脉发生粥样硬化,其中PLA2、MMP-2是人体中十分多见的炎症因子[2]。本文通过对EATV、PLA2、MMP-2水平进行检测,探讨了这些因素对纤维斑块稳定性的影响。
1 资料与方法
1.1 一般资料 收集2017年2月—2019年3月在我院胸外科进行外科手术的患者96例,其中冠心病患者53例(冠心病组),心脏瓣膜病患者43例(瓣膜病组)。排除标准:(1)无手术耐受力;(2)伴有其他各系统重大疾病;(3)会发生系统性炎症反应。所有患者均已知情本次研究。
1.2 方法
1.2.1 EATV检测及纤维斑块的测量:所有患者均进行CT扫描,使用Volumer软件对EATV进行测量。在测量前5~10min,给患者静脉注射CT碘对比剂,并口服硝酸甘油以使冠状动脉平滑肌松弛达到扩张动脉血管的目的,服用倍他乐克将心率控制在正常范围的最低值。CT测量值为-250~30HU定义为脂肪组织,选取心外膜边界,使用Volumer软件生成所选区域的脂肪体积(em)。测量最狭窄血管的斑块,各斑块选择3个不同的区域进行逐一测量,按最小CT测量值进行斑块的分类,其中软斑块为42~47HU;纤维斑块为61~112HU;钙化斑块为126~736HU。血管代偿性扩张通过相关指数阻抗指数(RI)进行测量,倘若RI≥1则为血管代偿性扩张。
1.2.2 定量即时聚合酶链反应(RT-qPCR)提取和纯化脂肪组织总核糖核酸(RNA):选取术中提取的100mg脂肪组织,对其采用差速离心法,使用新型总RNA抽提试剂(TRIZOL)提取和纯化总RNA,采用紫外光谱仪对总RNA的浓度和纯度进行检测。使用反转录试剂将总RNA反转录合成互补脱氧核糖核酸(cDNA),将cDNA作为模板,将MMP-2和β-肌动蛋白(β-actin)作为DNA片段的扩增引物。按下述配比制作PCR缓冲液,20μl PCR反应体系中包含了荧光染料(SYBR) 10μl、上游引物(Forward primer) 0.4μl、下游引物(Reverse primer)0.4μl、RT-qPCR扩增仪染料0.4μl、cDNA 2μl和蒸馏水(dH2O)6.8μl,通过扩增仪使用SYBR Green染料法检测cDNA相应基因的相对表达水平。反应条件为95℃预变性30s,95C°变性5s、60C°退火30s,循环40次。采用公式2-△△Ct,其中公式中△△Ct=(Ct目的基因-Ct管家基因)研究组-(Ct目的基因-Ct管家基因)对照组,计算出目的基因的表达水平,分析MMP-2的相对表达水平,实验重复操作3次。
1.2.3 免疫印迹法(Westernblot):用总蛋白提取试剂提取脂肪组织中的蛋白,用BCA蛋白质检测剂对其浓度进行检测。选取50μg的蛋白进行电泳分离,之后将蛋白转至甲醛浸泡过的聚偏二氟乙烯膜(PVDF膜)上。使用三羟甲基氨基甲烷(TRIS)+氯化钠(NaCl)+非离子型表面活性剂(tween20),即TBST缓冲液室温下密封2h,一抗(与特异性抗原进行特异性结合的蛋白)为获得滴度为1∶1 000的兔抗人MMP-2多克隆抗体,内参获得滴度为1∶2 000的兔抗人β-actin多克隆抗体,二抗(抗体的抗体)为辣根过氧化物酶(HRP)标记的获得滴度为1∶2 000羊抗兔(IgG)抗体;采用凝胶成像仪对蛋白凝胶成像及分析,用图像处理软件测定其灰度值,比较分析MMP-2的水平。
1.2.4 PLA2活性检测:将手术中提取的1g脂肪组织加入2ml 0.9%氯化钠溶液进行捣碎,以1 000r/min离心10min,提取清液层等待检测。使用脂肪组织PLA2荧光定量检测试剂采用ELISA法进行检测。
1.3 统计学方法 采用SPSS22.0软件对数据进行统计分析。计量资料以均数±标准差表示,组间进行t检验;计数资料以百分率(%)表示,进行χ2检验,血管代偿性扩张独立影响因素进行多因素Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组脂肪组织中MMP-2 mRNA表达水平、MMP-2蛋白及PLA2水平水平比较 冠心病组心外膜脂肪中MMP-2 mRNA表达水平、MMP-2蛋白及PLA2水平显著高于瓣膜病组(P<0.05),而胸腔脂肪中MMP-2 mRNA表达水平、MMP-2蛋白及PLA2水平比较,差异无统计学意义(P>0.05)。见表1。
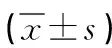
表1 两组患者中不同部位脂肪组织中不同蛋白的表达比较
注:与冠心病组比较,*P<0.05。
2.2 EATV、脂肪中炎症因子与纤维斑块稳定性相关性分析 先行血管代偿性扩张的多因素分析,血管代偿性扩张与非血管代偿性扩张患者的BMI、LDL-C、高血压数、EATV、纤维及钙化斑块体积比较,差异有统计学意义(P<0.05),提示上述因素为发生血管代偿性扩张的相关因素,见表2;对血管代偿性扩张的多因素进行Logistic回归分析,EATV、MMP-2、高血压、PLA2是发生血管代偿性扩张的独立影响因素,见表3。
3 讨论
心外膜下脂肪十分靠近心脏,可经多种途径对心脏及其组织造成不同程度的影响。国内外有研究发现EATV与冠状动脉粥样硬化及冠状动脉狭窄和阻塞程度存在一定的相关性,并且提升了心血管事件的发生率[3]。EATV可通过炎症因子产生作用,促进冠状动脉内膜厚度增加,促进冠状动脉粥样硬化的产生和发展。在冠状动脉粥样硬化患者中,纤维斑块的不稳定会引起斑块破裂、出血,最终导致心血管事件的发生[4-6]。目前有关EATV和炎症因子与纤维斑块稳定性的相关性研究甚少。本文结果显示,冠心病组的EATV、MMP-2、PLA2的水平均显著高于瓣膜病组,且通过多因素Logistic回归分析,发现EATV、MMP-2、PLA2是血管代偿性扩张的独立影响因素。血管代偿性扩张可影响血管内压力、血管上皮细胞生长因子及其他血管活性物质的释放,可加速上皮细胞增生、炎症细胞沉积以及胞外基质降解,是引起冠状动脉粥样硬化患者血管狭窄的重要原因[7-8]。巨噬细胞可产生MMP,当血管发生代偿性扩张时可使上皮细胞增生及胞外基质降解,大量的巨噬细胞聚集在一起,MMPs水平上升,继而使血管上皮细胞生长因子增多,其中MMP-2可促进胞外基质降解,形成斑块,使血管平滑肌增生,上皮细胞下新形成的血管极易进入血管内膜,破坏纤维斑块的稳定性[9-10]。另外,PLA2在血液中与LDL-C结合,使上皮细胞下氧化修饰低密度脂蛋白(OX-LDL)发生水解,产生游离的水解磷脂和脂肪酸,继而损伤血管上皮细胞,引诱血液中单核细胞持续聚集于血管内膜,生成大量的巨噬细胞。巨噬细胞又可吞噬OX-LDL形成泡沫细胞,泡沫细胞也能破坏纤维斑块的稳定性[11-12]。此外,PLA2还可促进LDL-C与MMPs的结合,加速胞外基质的降解,最终引发冠状动脉粥样硬化[13]。本文结果显示,高血压是血管代偿性扩张的独立影响因素。高血压对血管内膜产生较大的压力,加上机体内各种神体液因子的作用,增加了纤维斑块的不稳定性,进而出现斑块破裂和出血以及血栓的形成,最终导致心肌缺血或心梗。虽然本文结果显示MMP-2是血管代偿性扩张的独立影响因素,然而并未进行相关病理检查,因此,未获得相关结果,有待深入研究。
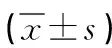
表2 血管代偿性扩张的单因素分析

表3 血管代偿性扩张的多因素 Logistic回归分析
综上所述,本文发现冠心病组心外膜脂肪中炎症因子高于瓣膜病组,通过血管代偿性扩张的多因素Logistic回归分析,发现EATV、MMP-2、高血压、PLA2是纤维斑块稳定性的独立影响因素。对这些因素进行有效控制,可减少心血管事件的发生。
