突触黏附分子NECL4对大脑皮质Ca2+-CaMKII-CDC42信号通路的影响
2020-07-09舒鹏程彭小忠
胡 耕,刘 枭,舒鹏程,彭小忠,2*
(1.中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系 医学分子生物学国家重点实验室 医学灵长类研究中心 神经科学中心, 北京 100005; 2.中国医学科学院 医学生物学研究所, 云南 昆明 650118)
突触结构是神经元之间在功能上发生联系的最小功能单位,是中枢神经系统信息传递的关键部位。突触的结构和功能会随着自身活动的加强与减弱发生较为持久的改变,该过程被称为突触的可塑性。神经元树突棘被认为是突触可塑性所必需的细胞亚结构。树突棘的结构和功能由多种分子组成的复杂信号网络进行调控[1],其中处于中心地位的是钙离子(Ca2+)及其下游大量信号分子介导的生化反应。树突棘接受信号输入时会产生大量Ca2+内流[2],随后CaMKII作为继电器将信号传递到RhoA、Rac1、H-Ras、CDC42等小GTP酶,小GTP酶激活可导致肌动蛋白结合蛋白的激活,从而发生新棘突的聚合和旧肌动蛋白的解聚, 致使树突棘形态及数量发生动态改变[3]。
在影响突触形成的诸多蛋白中,有一类为nectin-like molecules(NECLs),它们是免疫球蛋白样结构域的免疫球蛋白超家族成员。NECLs蛋白家族中的NECL2(nectin-like molecule-2)可以调节突触数量和可塑性,并影响神经元网络[4]。NECL4在脑组织中表达广泛,在外周神经系统中,表达在施万细胞(Schwann’s cell)上的NECL4与在背根节(dorsal root ganglion, DRG)神经元表达的Necl1之间的相互作用有助于髓鞘的形成[5]。但在中枢神经系统中NECL4的功能尚不明确,本文将通过一系列实验对NECL4在树突棘形态和数量中的作用进行研究,进而探讨NECL4在中枢神经系统中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物:高尔基染色实验小鼠分为两组,实验组为Necl4全身性敲除(KO)小鼠[6](3),对照组为Necl4野生型(WT)小鼠(3),对照组与实验组的小鼠为同窝小鼠。所有小鼠饲养在以12 h黑暗/照明为循环的无特定病原体环境中。所有动物护理和实验均已获得中国医学科学院/北京协和医学院动物保护与利用委员会的批准,所有程序均在符合实验动物法规(中国科学技术技术委员会第2号令)下进行。
1.1.2 主要试剂: 高尔基染色试剂盒(FD Neuro Technologies公司);CDC42抗体(Santa Cruz公司);CaMKIIα、Phospho-CaMKIIα抗体、ERK1/2、Phospho-ERK1/2(Cell Signal Technology公司);辣根过氧化物酶交联的兔源IgG、辣根过氧化物酶交联的小鼠来源IgG(北京中杉金桥生物公司);反转录试剂盒(北京全式金生物技术公司);荧光定量PCR试剂盒(TaKaRa公司);引物合成(北京擎科生物技术公司)。
1.2 方法
1.2.1 Golgi-Cox染色及树突棘密度的数量统计:使用美国FD Neuro Technologies公司FD Rapid GolgiStainTMKit对Necl4野生型及敲除型小鼠全脑进行Golgi染色。8周龄小鼠用0.7 %戊巴比妥钠(0.1 mL/10 g体质量)腹腔麻醉后,打开胸腔,剪开右心耳,经左心室用0.1 mol/L(pH 7.4)PBS冲洗至流出液为无色。随后小心分离端脑及小脑,确保组织完整。组织放入0.1 mol/L(pH 7.4)的PBS洗去表面血污后,放入等体积混匀的试剂A+试剂B中,浸泡6 h后更换等体积混匀的新鲜试剂A+试剂B。浸泡14 d 后,将组织转移入试剂C中,4 ℃ 避光放置且第2天更换新鲜试剂C。4 ℃ 避光放置3 d后取出处理好的脑组织,使用振动切片机进行切片,厚度200 μm,切好的脑片黏贴在载玻片上备用。向脑片上滴加ddH2O,5 min/次,共2次;随后向脑片上滴加体积比为1∶1∶2的试剂D +试剂E +ddH2O的混合液,反应10 min。向脑片滴加新鲜ddH2O以洗去反应液,5 min/次,共2次。清洗后将切片进行梯度乙醇脱水,二甲苯透明,中性树脂封片风干并保存。
使用Nikon光学显微镜对脑片大脑皮质第Ⅱ/Ⅲ层椎体神经元二级树突上树突棘进行Z轴扫描呈像,放大倍数1 000倍。使用Imaris 7.2.3对二级树突进行三维重构,并对树突棘密度进行统计。
1.2.2 Western blot检测蛋白表达:提取8周龄小鼠的大脑皮质蛋白,BCA法测定总蛋白浓度,CaMKIIα、phospho-CaMKIIα、ERK1/2、phospho-ERK1/2稀释倍数均为1∶1 000,CDC42抗体稀释倍数为1∶200,辣根过氧化物酶交联的兔源IgG、辣根过氧化物酶交联的鼠源IgG的稀释倍数为1∶5 000。使用Quantity One 软件进行灰度值分析。以目的蛋白与内参蛋白β-actin灰度值比值为各蛋白的相对表达量。实验重复3次。
1.2.3 实时荧光定量PCR检测mRNA水平:采用Trizol法提取8周龄小鼠的大脑皮质总RNA,按照说明书使用反转录试剂盒进行反转录反应。通过荧光定量PCR进行实验,实验步骤如下,PCR反应条件: 94 ℃条件下,预变性5 min,后进行40次循环(循环条件为94 ℃/30 s,60 ℃/30 s,72 ℃/30 s),后在72 ℃的条件下延伸10 min,最后4 ℃冷却。所用PCR引物序列如表1。
1.3 统计学分析
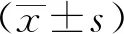

表1 实时荧光定量PCR引物序列
2 结果
2.1 高尔基染色显示Necl4敲除后二级树突上树突棘数量减少
对Necl4敲除小鼠及野生小鼠脑组织进行高尔基染色。结果显示,在4倍光镜下,Necl4 KO小鼠的大脑皮质切片与Necl4 WT小鼠的大脑皮质切片相比无明显变化(图1A);在1 000倍油镜下可以看到Necl4敲除后小鼠大脑皮质第Ⅱ/Ⅲ层锥体神经元的二级树突的树突棘的数量(WT:n=7、KO:n=7)与野生型相比明显减少(P<0.01)(图1B,C)。
2.2 Necl4敲除后CaMKIIα及phospho-CaMKIIα蛋白在大脑皮质表达下降
结果显示Necl4 敲除后,CaMKIIα及phospho-CaMKIIα(Thr286)在小鼠大脑皮质的蛋白表达量与野生型相比明显下降(WT:n=3、KO:n=3)(P<0.05)(图2)。

A.Golgi-Cox staining images of forebrain neurons fromNecl4 WT and KO mice brains(×40),scale bar=500 μm; B.Golgi-Cox staining images of secondary dendritic spines in the mice Ⅱ/Ⅲ cerebral cortex(×1 000), scale bar=50 μm; C.quantitative analysis of spine density;*P<0.01 compared with WT group
图1Necl4野生及敲除小鼠高尔基显色结果
Fig 1 Golgi coloration results ofNecl4 wild and knockout mice(WT:n=7,KO:n=7)
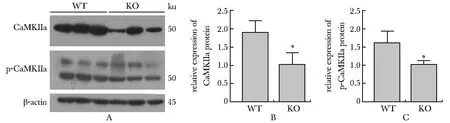
2.3 Necl4敲除后CDC42在大脑皮质的表达下降
Western blot和荧光定量PCR实验分别在蛋白(WT:n=3、KO:n=3)及mRNA(WT:n=9、KO:n=9)水平显示Necl4敲除后CDC42在小鼠大脑皮质的表达水平显著下降(P<0.05)(图3)。
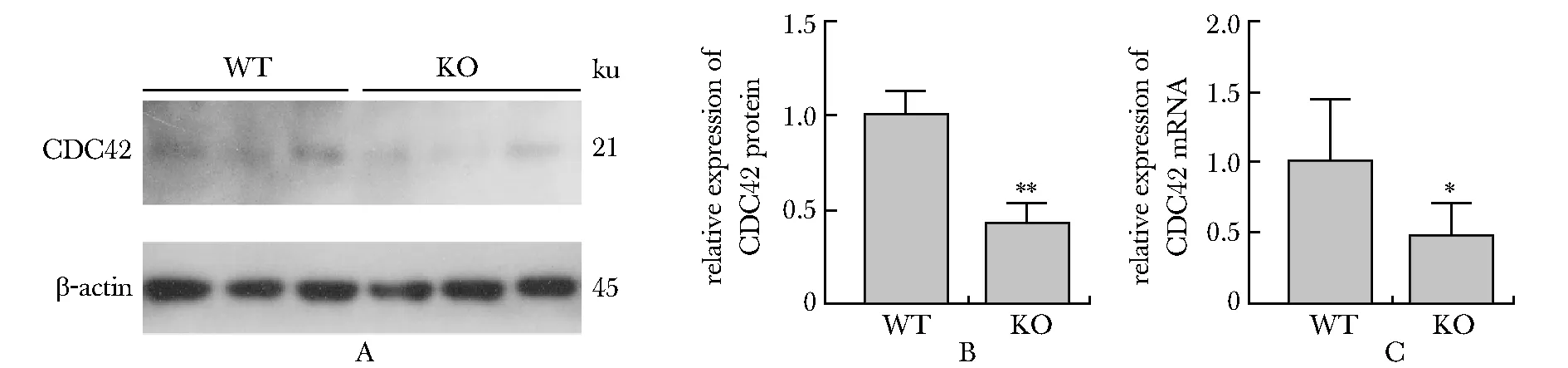
2.4 Rac1、H-Ras、RhoA 3种小GTPase蛋白的mRNA水平在Necl4敲除后有下降的趋势
荧光定量PCR实验结果表明,Necl4敲除后,Rac1、H-Ras、RhoA 3种小GTPase蛋白的mRNA表达水平虽然有下降的趋势,但差异没有统计学意义(WT:n=5、KO:n=5)(图4)。
2.5 ERK及phospho-ERK在Necl4敲除后有升高的趋势
Western blot实验结果显示Necl4敲除后,ERK1/2及phospho-ERK1/2有升高的趋势,但其差异无统计学意义(WT:n=3、KO:n=3)(图5)。
A~C.expression of CaMKIIα and Phospho-CaMKIIα in cerebral cortex and quantitative analysis; *P<0.05 compared with WT group
A.expression of CDC42 in cerebral cortex; B.quantitative analysis of CDC42 protein expression(WT:n=3,KO:n=3),*P<0.05 compared with WT group; C.quantitative analysis of CDC42 mRNA expression,*P<0.05 compared with WT group
图3Necl4野生及敲除小鼠CDC42的蛋白及mRNA表达水平
Fig 3 Protein and mRNA expression of CDC42 in cerebral cortex(WT:n=9,KO:n=9)
A~C.quantitative analysis of Rac1, H-Ras and RhoA mRNA expression
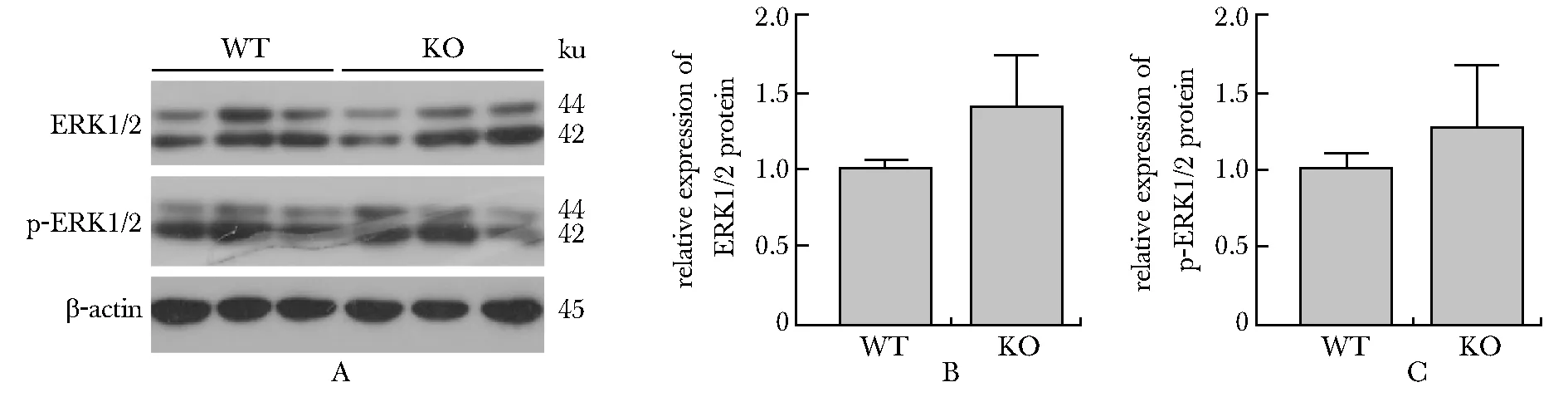
A~C.expression of ERK1/2 and phosphop-ERK1/2 in cerebral cortex and quantitative analysis
3 讨论
突触的形成是神经系统发育所必需的,成熟大脑中突触的动态变化与学习记忆等认知功能有关。树突棘数量的改变也与突触的动态变化息息相关,树突棘的结构和功能受钙离子和大量信号分子介导的生化反应的调节。本研究证明Necl4敲除后小鼠大脑皮质第Ⅱ/Ⅲ层锥体神经元二级树突的树突棘数量与野生型相比明显减少,这说明NECL4可以调节树突棘的密度。树突棘受到刺激后发生Ca2+内流,Ca2+通过NMDAs进入树突棘后与钙调素(CaM)结合,激活CaMKII。Ca2+-CaMKII信号级联是LTP诱导所必需的第一反应。H-Ras、RhoA、CDC42和Rac1是CaMKII的下游信号分子,它们都是参与肌动蛋白聚合和解聚相关信号通路的小GTPase蛋白。Western blot及实时荧光定量PCR结果显示,Necl4敲除后,与Ca信号通路相关的CaMKIIα、phospho-CaMKIIα、CDC42的表达降低,提示NECL4可能通过Ca2+-CaMKII-CDC42信号通路影响信号在树突棘中的传播,进而影响突触的可塑性,并对突触形态产生影响。RhoA、H-Ras作为传播信号分子,可以将树突棘接收的信号向细胞核传递,以激活核内的信号,这一信号传递是由ERK信号通路完成的[7]。RT-qPCR结果显示Necl4敲除后RhoA、H-Ras出现降低的趋势,Western blot结果显示ERK1/2及phospho-ERK1/2出现增高的趋势,这些结果说明Necl4敲除可能导致树突棘的接收信号向下传播紊乱,或许对突触间的信号传递造成影响。
综上所述,细胞黏附分子Necl4敲除后,Ca2+-CaMKII-CDC42信号通路表达紊乱进而影响树突棘的数量。本研究主要聚焦在NECL4对树突棘形态的影响,但是神经元二级树突上树突棘的数量减少是否会对突触功能可塑性乃至个体行为产生影响尚不明确。此外,NECL4对神经元或胶质细胞胞内Ca2+浓度的影响,及NECL4影响Ca2+内流因素的调控机制也尚不知晓。因此,通过电生理、Western blot及免疫组化等技术检测这些关键指标将进一步揭示NECL4在中枢神经系统中对钙信号的调控作用。
