白云山落叶阔叶林土壤细菌群落结构及环境因子的相关性分析
2020-07-09黄萍王楠周紫羽王婷袁志良常介田叶永忠
黄萍, 王楠, 周紫羽, 王婷, 袁志良, 常介田, 叶永忠
(1.河南农业职业学院,河南 中牟 451450;2.河南农业大学生命科学学院,河南 郑州 450002;3.河南农业大学林学院,河南 郑州 450002)
土壤微生物是土壤中最活跃的部分[1],通过氧化、氨化、硝化等过程促进土壤养分的分解与转化[2],是生态系统中物质循环的主要参与者[3-4]。土壤是微生物的“天然培养基”,其中细菌的种类和数量最多[5],占土壤微生物总量的90%以上[6]。土壤细菌对环境的变化敏感,土壤的温度、pH值和性质等变化都会对土壤细菌多样性及群落结构产生影响[7-9]。相对真菌而言,土壤细菌在生态系统中发挥着更加重要的作用[10],其群落结构组成及多样性更能反映土壤的健康状况[11]。森林是陆地上最重要,同时也是最复杂的生态系统类型[12]。自2004年以来,研究学者陆续在宝天曼、长白山、古田山、尖峰岭等地建立多个大型固定监测样地[13-16],为研究物种多样性的维持机制、群落动态、物种空间分布格局等生态学规律和现象提供了良好的研究平台[17-19]。目前,在大型森林样地开展的研究多以木本植物为研究对象,对土壤微生物的研究还相对较少[20]。基于大型监测样地开展土壤细菌的研究,将是了解土壤细菌及植物群落多样性维持机制的重要途经。伏牛山为中国南北区域最重要分界“秦岭—淮河”的主要组成部分,位于暖温带向北亚热带过渡区域,兼具暖温带与北亚热带的气候特征,是进行生态学研究的理想场所[21]。洛阳白云山国家森林公园位于伏牛山腹地。王雪颖等[22]研究了该区域大型真菌多样性;段春燕等[23]调查了该区域珍稀濒危植物资源;欧阳凤等[24]采用样线法和踏查法对该区域两栖动物进行了考察。本研究以洛阳白云山5 hm2长期固定监测样地为研究平台,主要探讨以下三个问题:(1)白云山土壤细菌群落结构;(2)白云山土壤细菌在不同分类水平上的主要菌群;(3)白云山森林监测样地中土壤细菌群落分布与环境因子的相关性。通过本研究加深人们对暖温带-北亚热带过渡区域土壤细菌群落多样性的认识,为该区域土壤细菌及木本植物群落多样性维持机制的研究奠定基础。
1 材料与方法
1.1 研究区概况
白云山国家森林公园位于河南省洛阳市嵩县南部伏牛山腹地(111° 48′~112° 16′E,33° 33′~33°56′N),总面积168 hm2。白云山位于暖温带与北亚热带生态过渡区,地跨长江、黄河、淮河三大流域,平均海拔1 800 m,玉皇顶海拔2 216 m。该区域年平均降水量约1 200 mm,年平均气温为18 ℃,夏季最高气温不超过26 ℃,森林覆盖率98.5%以上。区内土壤质地多以轻壤为主,pH 5.5~6.5。
1.2 样方设置与样品采集
2015年,参照美国史密森研究院的大样地建设与监测技术规范[25-26],选择典型落叶阔叶林群落建立东西长250 m、南北长200 m的5 hm2的长期固定监测样地。前期调查研究表明,样地内共有木本植物34科55属93种,锐齿槲栎(Quercusalienavar.acuteserrata)为样地中的优势物种[27]。
2018年7月,在每个20 m×20 m的子样方中选取3个取样点(取样点的分布如图1所示),并将这3个点的土壤混合为1个样品,取样时先将凋落物和腐殖质层移除,再用土钻采集土层0~10 cm的土壤,通过2 mm筛后分为2份,保存在-80 ℃用于DNA提取和后续试验。
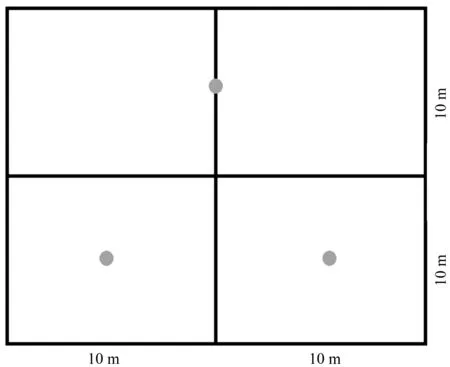
图1 3个取样点的位置分布图Fig.1 The location distribution of the three sample points
1.3 DNA提取、PCR扩增及高通量测序
采用试剂盒提取土壤细菌宏基因组DNA,16S rRNA基因的V4高变区扩增引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGG TWTCTAAT-3′)。PCR反应条件为95 ℃ 5 min;95 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃ 10 min;16 ℃ 10 min。将质量合格的PCR产物进行DNA文库的构建,并使用Illumina公司的Miseq台式测序仪,采用双末端测序法进行高通量测序[28]。
1.4 土壤理化性质测定方法
土壤磷含量的测定采用NaHCO3浸提比色法,土壤有机质(SOM)采用重铬酸钾容量法,使用碱解扩散法测定土壤碱解氮含量(N),土壤含水量(WC)采用105 ℃ 24 h烘干法,土壤pH值通过玻璃电极pH计测定,水土质量比为2.5∶1。
1.5 数据处理与分析
采用序列拼接软件FLASH[2](Fast Length Adjustment of Short reads,v1.2.11),按照重叠关系将双末端测序得到的成对reads拼接成一条序列,所有样品一共得到7 329 751条Tags,平均每个样品61 081条,SD值为428;Tag平均长度为253 bp,SD值为1 bp。
利用软件USEARCH(v7.0.1090)将拼接好的 Tags聚类为OTU(Operational Taxonomic Units),其主要过程为:(1)利用UPARSE在97%相似度下进行聚类,得到OTU的代表序列;(2)利用UCHIME(v4.2.40)将PCR扩增产生的嵌合体从OTU代表序列中去除;(3)使用usearch-global方法将所有Tags比对回OTU代表序列,得到每个样品在每个OTU的丰度。
取样点数-土壤细菌类群曲线的制作:从120个样品中随机抽取1个样品,记下这个样品中包含的细菌类群数目;然后从剩下的119个样品中再随机抽取1个样品数据,和第1次抽到的样品数据合并,记下这2个样品中包含的细菌类群数目,依此类推,直至采样点的数目达到120;重复多次取平均值,制作取样点数-土壤细菌类群曲线。
覆盖率指数表示测序深度指数,本分析通过mothur(v1.31.2)软件计算样品的Alpha多样性值并用R(3.1.1)软件做出相应的稀释曲线图。
冗余分析和相关性分析在R语言中完成,冗余分析(Redundancy analysis,RDA)是一种回归分析结合主成分分析的排序方法,使用的是R语言中的Vegan包[29],相关性分析采用的是随机化排列检验,通过99次数据的随机排列来分析2类环境因子对细菌群落分布影响的显著性。
2 结果与分析
2.1 土壤中细菌多样性
120个样品共检测出12 852个OTU,其中220个OTU为所有样品共有。120个土壤样品中平均有3 549±599个OTU,单个样品中最多的有4 680个,最少的有2 001个,分属于51门173纲325目482科707属。当取样点数在0~20区间时,检测到的OTU数目随取样点数的增加而快速增加;当取样点数在20~80区间时,检测到的OTU数目增速减慢;当取样点数大于80时,检测到的OTU数目增加极少,曲线平缓(图2)。采集的120个土壤样品的覆盖率指数平均值为0.971 191,最大值为0.985 501,最小值为0.961 573,随着检测到的序列数目不断增加,覆盖率指数也越来越接近1(图3)。
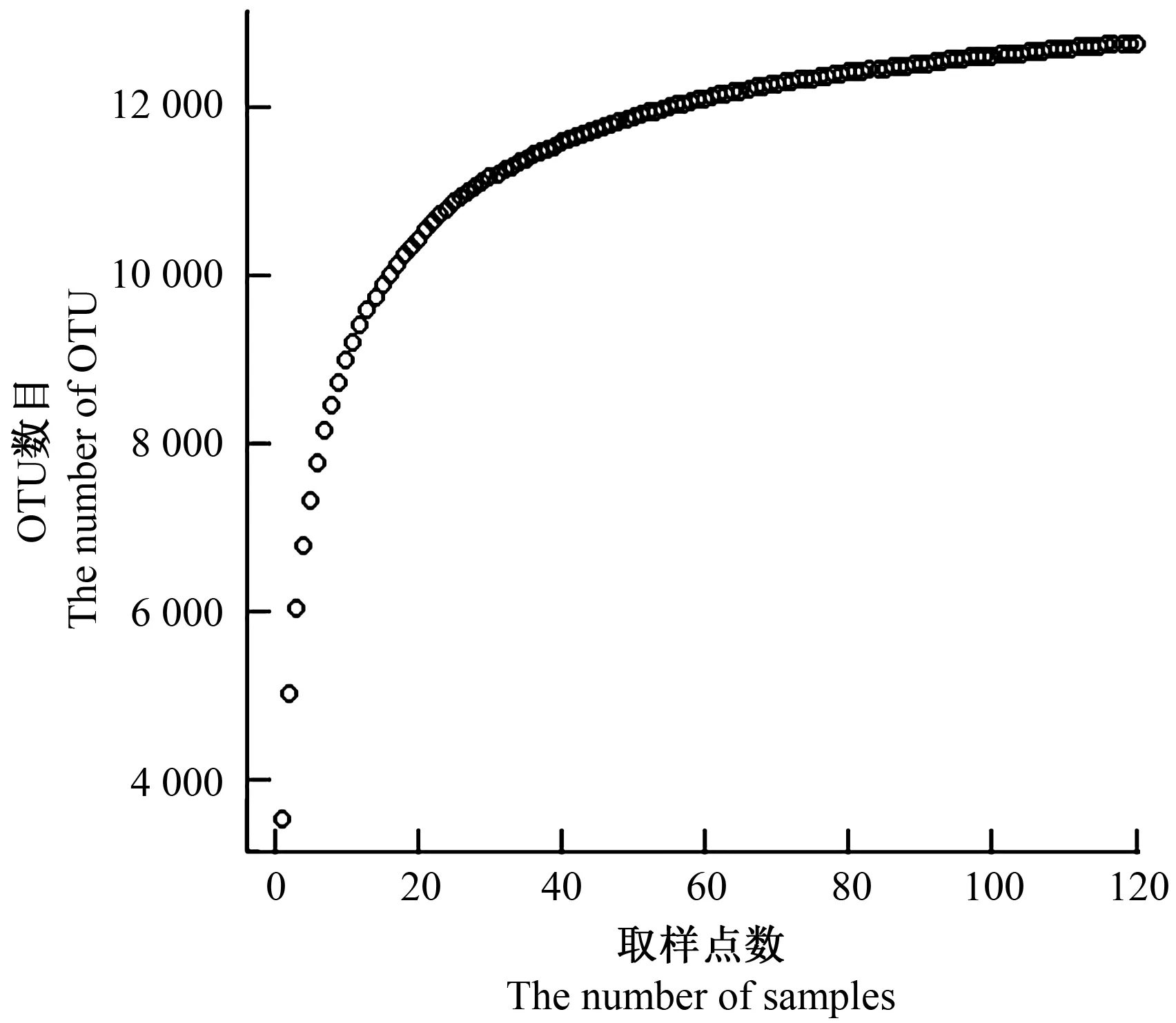
图2 120个土壤样品中检测到的细菌OTU数目随取样点数增加的稀释曲线Fig.2 Rarefaction curve of the number of bacterial OTU detected in soil samples increasing with the number of sampling points
2.2 土壤细菌分类
2.2.1 门 120个土壤样品中平均有细菌38.76±2.93门,其中单个样品中最多的有45门,最少的有30门(图4)。检测到的51个门中49个门有明确分类名称信息,仅2个门没有明确分类名称信息。相对丰度最高的10个门所占比例总和达到94.09%(图5),前5个门分别是酸杆菌门(Acidobacteria)(28.82%)、变形菌门(Proteobacteria)(24.37%)、疣微菌门(Verrucomicrobia0)(18.76%)、浮霉菌门(Planctomycetes)(6.41%)和硝化螺旋菌门(Nitrospirae)(5.14%)。
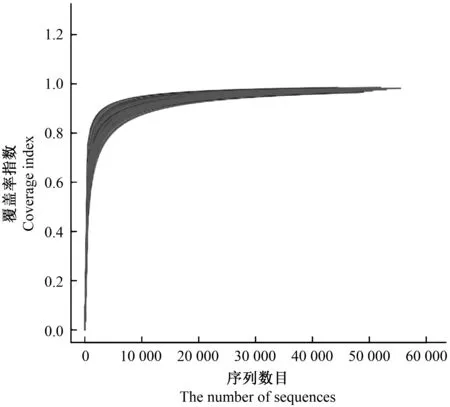
图3 120个土壤样品的覆盖率指数图Fig.3 Coverage index graph of 120 soil samples
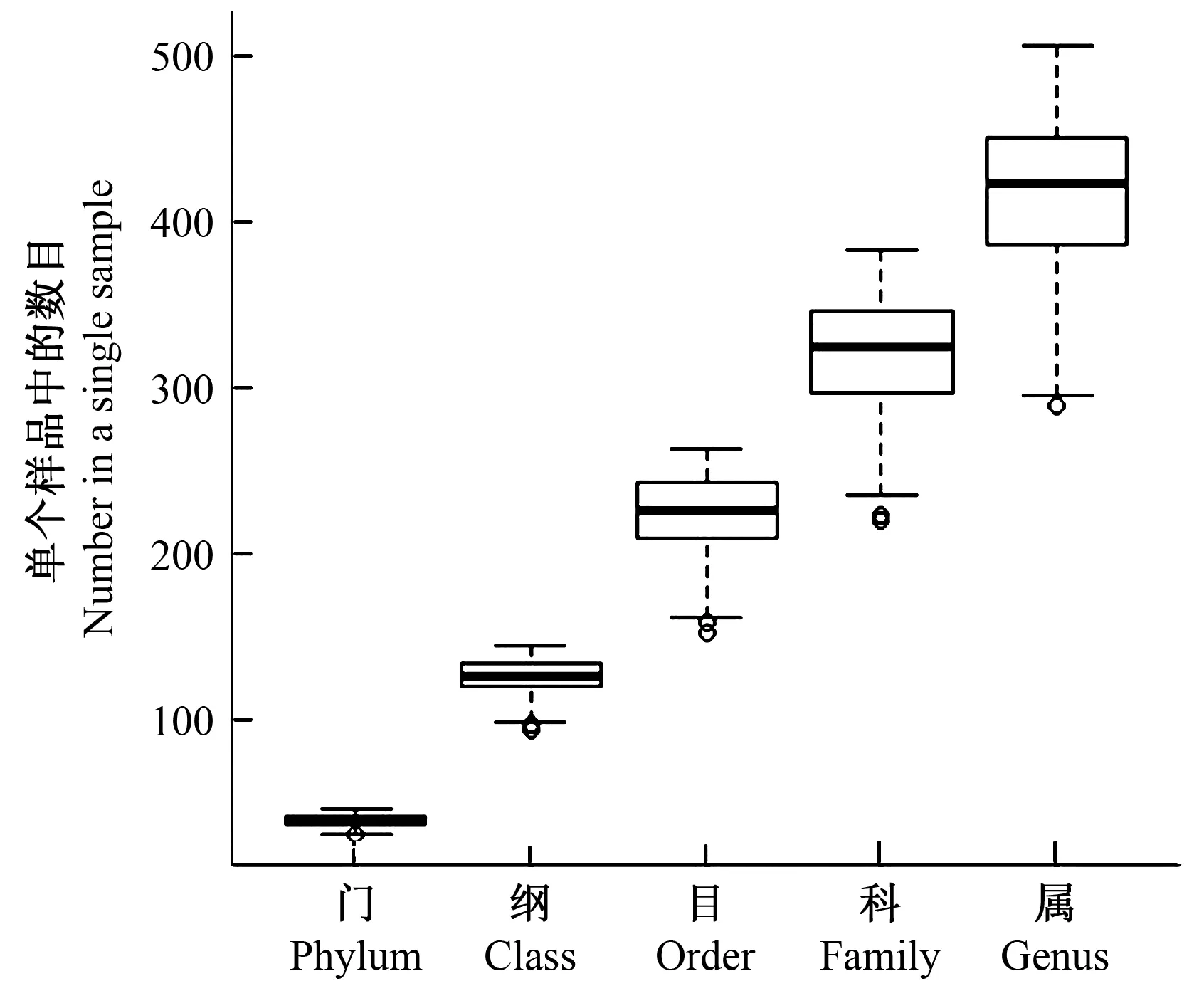
图4 白云山120个土壤样品中检测到的不同分类水平上的细菌数量Fig.4 The number of bacteria at different classification levels detected in 120 soil samples of Baiyun mountain
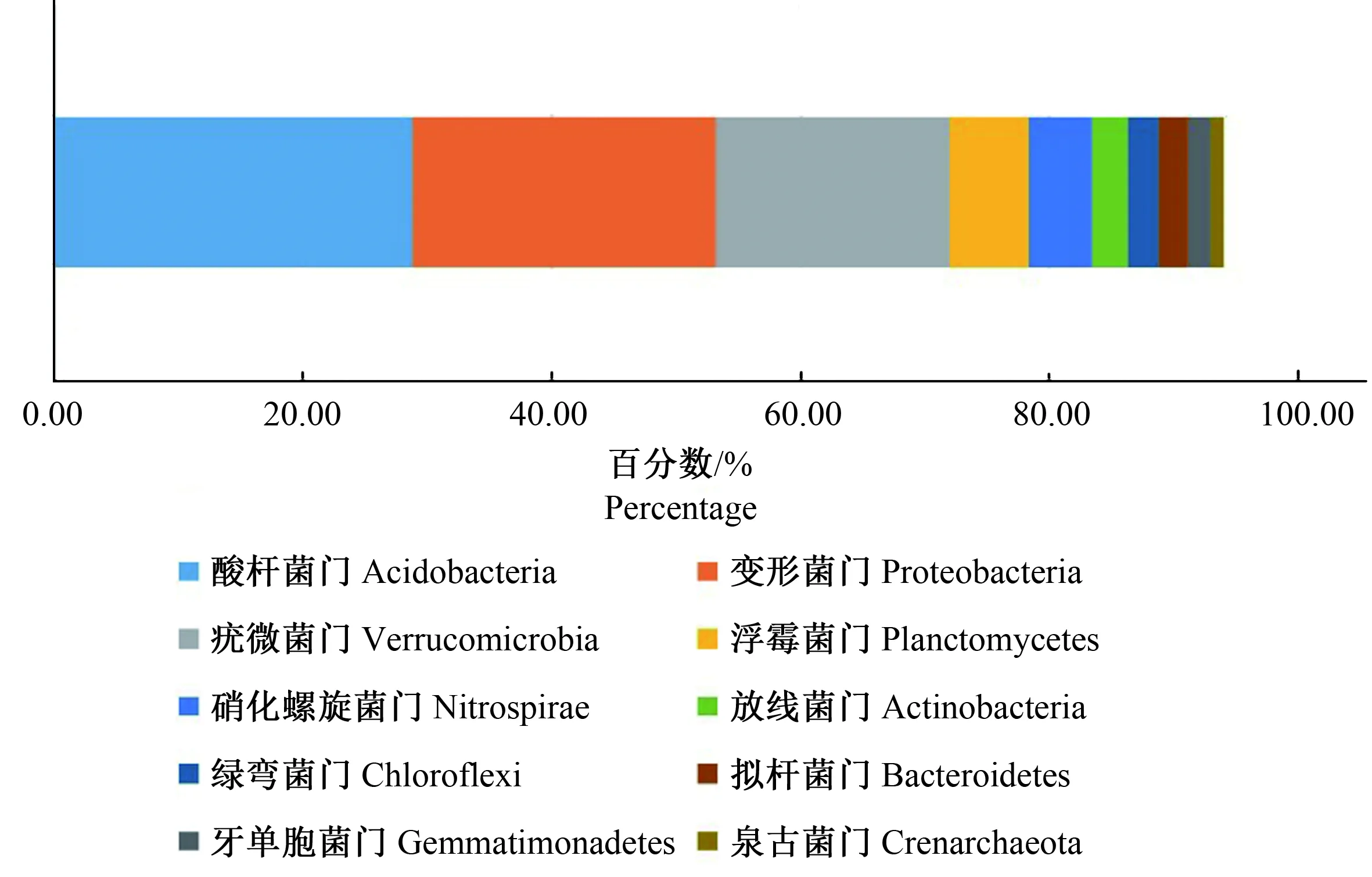
图5 细菌在门分类水平上的条形图(丰度最高的10个门)Fig.5 Bar diagram of bacteria at the phylum level (the ten most abundant phylum)
2.2.2 纲 120个土壤样品中平均有细菌124.7±11.87纲,其中单个样品中最多的有144纲,最少的有93纲(图4)。检测到的173个纲中139个纲有明确分类名称信息,34个纲没有明确分类名称信息。在139个有名称信息的纲中,有50个纲在所有样品中的相对丰度都大于等于0.5%。相对丰度最高的5个纲所占比例总和达到48.01%,分别是Spartobacteria (16.05%)、DA052(10.46%)、α-变形菌纲(Alphaproteobacteria)(9.29%)、酸杆菌纲(Acidobacteria)(6.41%)和β-变形菌纲(Betaproteobacteria)(5.80%)(图6)。
2.2.3 目 120个土壤样品中平均有细菌223.02±25.00目,其中单个样品中最多的有263目,最少的有151目(图3)。检测到的325个目中194个目有明确分类名称信息,131个目没有明确分类名称信息。在194个有名称信息的目中,有63个目在所有样品中的相对丰度都大于等于0.5%。相对丰度最高的10个目所占比例总和达到57.99%(图7),分别是Chthoniobacterales(16.05%)、Ellin6513(10.46%)、酸杆菌目(Acidobacteriales)(6.41%)、硝化螺旋菌目(Nitrospirales)(5.14%)、根瘤菌目(Rhizobiales)(4.23 %)、Gemmatales(3.32%)、互营杆菌目(Syntrophobacterales)(3.29%)、iii1-15(3.24%)、Solibacterales(3.00%)和红螺菌目(Rhodospirillales)(2.85%)。
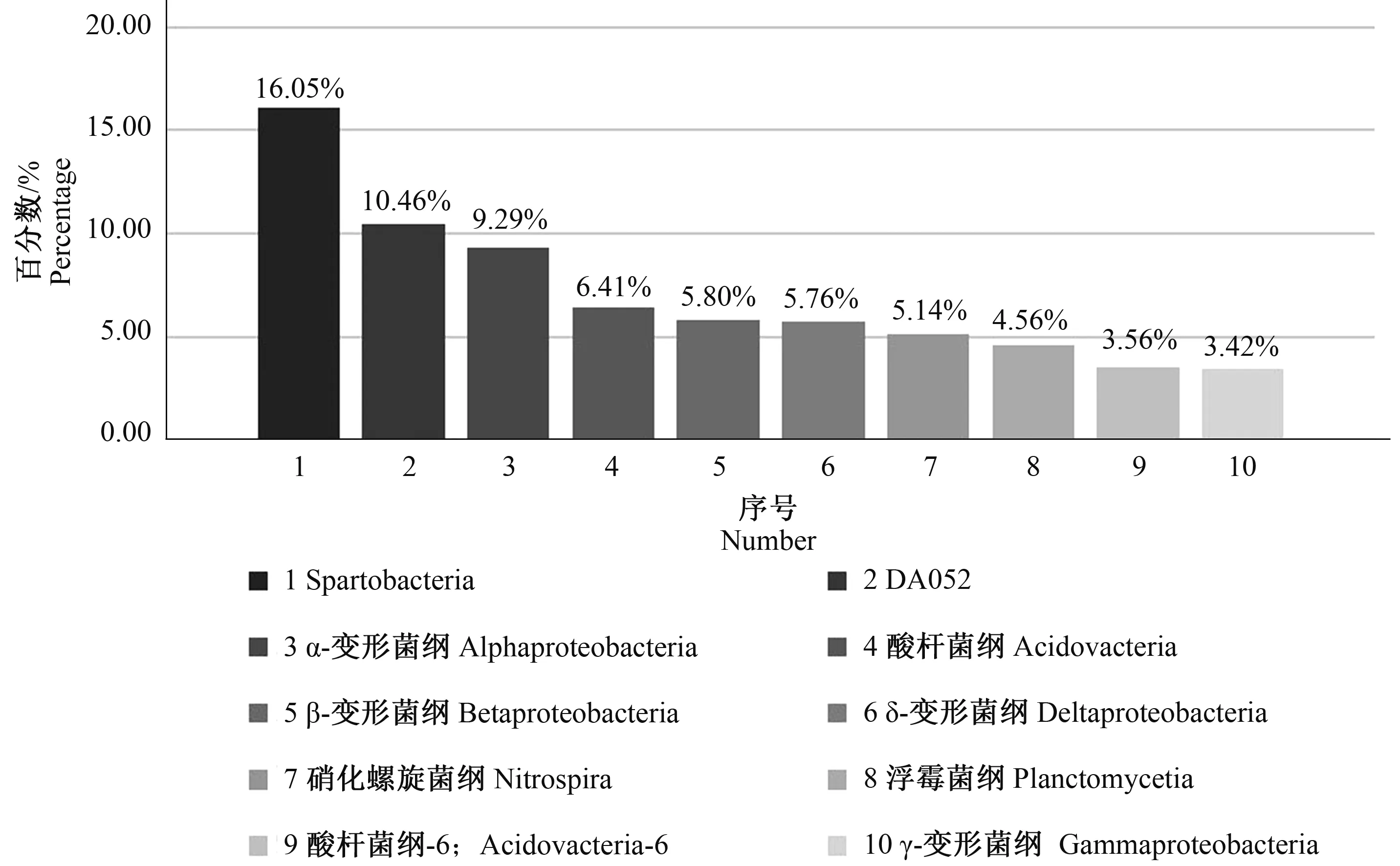
图6 细菌在纲分类水平上的柱形图(丰度最高的10个纲)Fig.6 Bar diagram of bacteria at the class level (the ten most abundant class)
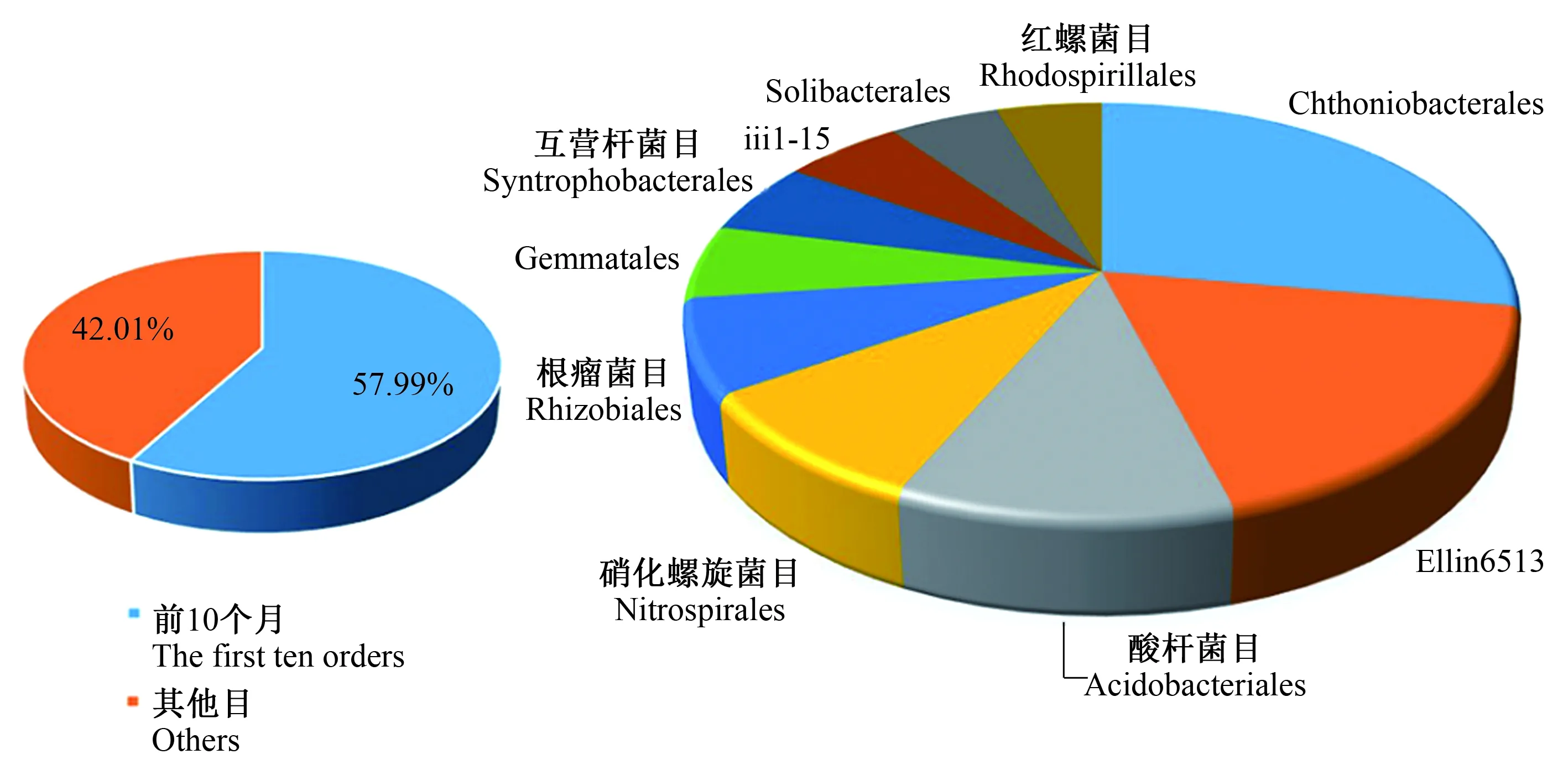
图7 细菌在目分类水平上的饼图Fig.7 Pie chart of bacteria at the order level
2.2.4 科 120个土壤样品中平均有细菌319.13±35.59科,其中单个样品中最多的有383科,最少的有219科(图4)。检测到的482个科中201个科有明确分类名称信息,281个科没有明确分类名称信息。相对丰度最高的5个科所占比例总和达到39.61%,分别是Chthoniobacteraceae (16.05%)、Ellin6513目某科(10.46%)、Koribacteraceae(5.74%)、0319-6A21(4.09%)和互营杆菌科(Syntrophobacteraceae)(3.27 %)。
2.2.5 属 120个土壤样品中平均有细菌417.29±47.35属,其中单个样品中最多的有506属,最少的有288属(图4)。检测到的707个属中267个属有明确分类名称信息,440个属没有明确分类名称信息。相对丰度最高的5个属所占比例总和达到37.09%,分别是DA101 (14.13%)、Ellin6513目某属(10.46%)、Koribacteraceae科某属 (5.14%)、0319-6A21科某属(4.09%)和互营杆菌科某属(3.27 %)。
2.3 细菌群落与环境因子的相关性
图8为土壤细菌群落与环境因子的冗余分析(RDA)结果排序图,第一主轴解释了48.98%的细菌群落分布变异,第一主轴解释了22%的细菌群落分布变异。其中土壤pH值、坡度(SL)、海拔(EL)、土壤N、P和含水量(WC)对细菌群落分布影响显著,凹凸度(CC)和土壤有机质(SOM)对细菌群落分布影响不显著(表1)。

图8 土壤细菌群落分布与环境因子的冗余分析Fig.8 Redundancy analysis of soil bacterial community distribution and environmental factors
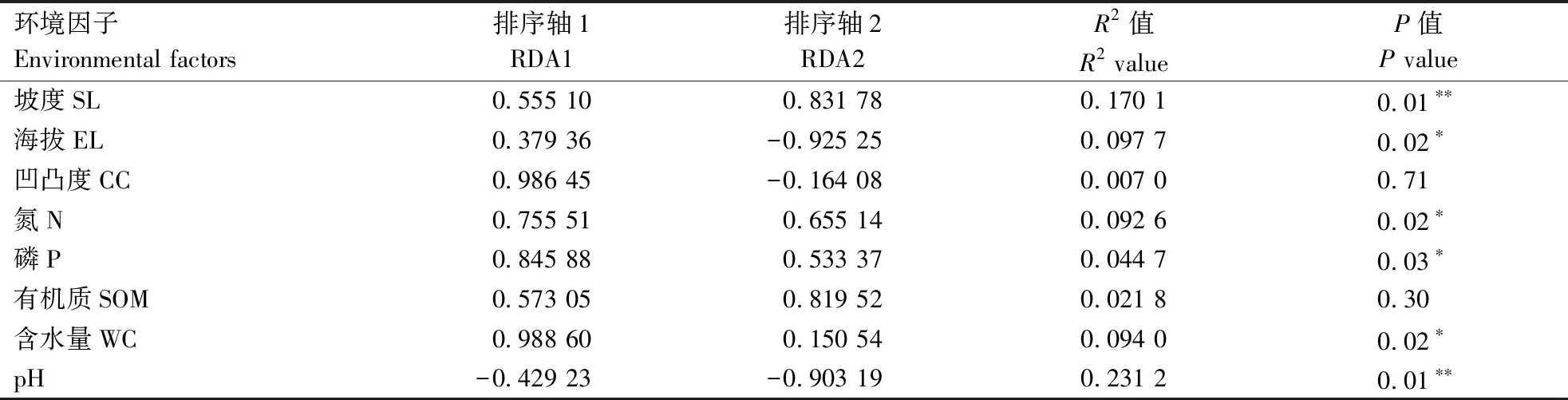
表1 细菌群落分布与环境因子之间的相关性Table 1 Correlation between bacterial community distribution and environmental factors
注:*相关性在0.05 水平上显著;**相关性在0.01 水平上显著。
Note: *means significant correlation at 0.05 level;**means significant correlation at 0.01 level.
3 结论与讨论
土壤细菌通过和下层植物相互作用,促进森林生态系统的物质交换和能量流动[30-31]。稀释曲线结果显示,本研究取样合理。白云山土壤细菌在门和纲水平上的分类名称信息明确,为后续更深入的研究奠定了理论基础。
土壤细菌群落组成在不同土壤样中有一定差异,本研究检测到的细菌类群为51门173纲325目482科707属,其中酸杆菌门所占比例最多,其次为变形菌门,验证了FIERER等[32]的观点,即在温带森林中酸杆菌是土壤中含量最丰富的细菌类群。然而邓娇娇等[33]通过研究温带土壤细菌多样性及群落结构得出变形菌门为丰度最高的门,赵爱花等[28]也发现变形菌门是落叶阔叶林土壤中相对丰度最高的门。已有研究表明,变形菌门的丰度随着有机质的增加而增加[34],本研究中虽然没有证明这一观点,但是变形菌门的丰度仅次于酸杆菌门,是参与有机质分解的主要细菌。酸杆菌门细菌多为嗜酸菌,酸杆菌门的相对丰度能够表明土壤的酸性条件。
土壤pH值在土壤生物地球化学循环过程中起重要作用,是影响细菌分布的重要因子[7]。相关性分析表明土壤pH对细菌群落分布影响显著。邓娇娇等[33]通过研究也表明酸杆菌门细菌相对丰度与pH呈极显著负相关。酸杆菌门是该样地的优势菌群,结果显示土壤pH对细菌分布影响最大。另外,坡度、海拔以及土壤N、P和含水量都显著影响土壤细菌群落,这与刘洋等[2]的研究结果基本一致。土壤有机质是驱动土壤微生物分布的主要原因。然而,在本研究中土壤有机质对土壤细菌群落影响并不显著,可能是由于整个样地土壤中有机质含量差异较小,才导致这样的结果。
