18F-FDG PET/CT及增强CT在硬化性肺泡细胞瘤诊断中的价值
2020-07-08邵明岩骆柘璜徐荣漆婉玲廖凤翔
邵明岩 骆柘璜 徐荣 漆婉玲 廖凤翔
硬化性肺泡细胞瘤 (pulmonary sclerosing pneumocytoma,PSP)是一种少见的肺部良性肿瘤,占肺部良性肿瘤的3%~5%,临床表现无特异性,胸片及CT表现缺乏典型的影像征像,常表现为孤立性肺肿块,不易与其他肺部良、恶性病灶鉴别,因此常被误诊[1-2]。18F-氟脱氧葡萄糖正电子发射体层成像(18F-FDG PET)/CT不仅可以显示PSP的结构,还可以从代谢、血流灌注、功能等方面显示PSP的特征。多数良性肿瘤18F-FDG摄取轻度增高或不摄取,恶性肿瘤18F-FDG摄取明显增高,但有文献[3-4]报道PSP也可表现为18F-FDG高摄取,这就增加了PSP的诊断难度,即使采用18F-FDG PET/CT检查,也容易造成误诊。增强CT成像不仅能显示PSP的影像特征,还可通过肿瘤的强化方式及强化程度等反映PSP内部组织结构[5],与18F-FDG PET/CT成像结合能够更好地诊断PSP。本文回顾性分析17例PSP病人的临床及PET/CT、增强CT影像资料,探讨PSP的影像特征,旨在提高术前联合应用2种检查方法对PSP的诊断价值。
1 资料与方法
1.1 一般资料 回顾性收集2015年1月—2019年6月江西省人民医院经手术病理证实为PSP的病人17例,其中男6例,女11例;年龄34~75岁,平均(50.4±11.6)岁。 临床表现为胸闷 1例,咳嗽、咳痰并咯血1例,胸痛2例,其余病例无明显呼吸系统症状。PSP病人中既往有肾移植、胃底贲门癌(未治疗)、糖尿病、不明原因肋骨骨折病史的各1例。纳入标准:①术前均行18F-FDG PET/CT、CT平扫及增强检查;②临床、影像、病理资料完整。排除标准:①空腹血糖>10 mmol/L者;②影像质量差,影响影像分析者。
1.2 设备与方法 采用美国GE Discovery STE设备进行18F-FDG PET/CT检查。CT扫描参数:管电压120 kV,自动管电流,螺距1.75,旋转时间0.8 s/r,层厚3.75 mm,层间距5 mm。3D PET/CT扫描参数:2.5 min/床位,6~8 床位,层厚 3.25 mm,层间距 5 mm;采用FORE-Iterative重建,FOV 50 cm×50 cm,发射扫描采集25 min,轴向间距4.25 mm,层厚3.75 mm,矩阵128×128。经衰减校正、迭代重建后的图像传至AW 6.3工作站进行融合。18F-FDG由美国GE TRACERLab FX-FN合成器自产,放化纯度>95%,给药剂量0.12 mCi/kg体质量,经肘前浅静脉注射,注射流率2 mL/s。病人检查前禁食6 h以上,血糖控制在10 mmol/L以下,注药后休息40~60 min,期间饮水800~1 000 mL,检查前排空尿液。病人仰卧位,扫描范围从头顶至股骨上1/3段。采用美国GE BrightSpeed 16层CT设备行增强扫描,扫描参数:管电压120 kV,管电流200 mA,层厚1.25 mm,层间距5mm。扫描结束自动重建出层厚及层间距为1~1.5mm的薄层影像,重建算法为Lung算法。FOV 500 mm×500 mm,矩阵512×512。采用高压注射器经肘静脉团注碘普罗胺(含碘300 mg/mL,Bayer AG生产),注射剂量1.5~2.0 mL/kg体质量,注射流率2.5 mL/s。
1.3 影像分析 由1名PET/CT主任医师和1名主治医师同时双盲阅片,意见不一致时由科室医师集体商定。由1名医师在病灶放射性摄取最浓聚部位勾画兴趣区(ROI),测量PSP病灶、肺本底(指病灶以外正常肺组织)的最大标准化摄取值(maximum standardized uptake values,SUVmax)。分析CT影像表现,包括病灶的分布(形态、部位、数量、病灶最长径)、伴随征象(浅分叶征、砂粒状钙化、囊变、尾征、空气潴留征)及肿瘤强化方式及强化程度。由1名医师在PSP病灶处勾画ROI,测量病灶的CT值、绝对强化CT值(强化CT值-平扫CT值)和最长径。
1.4 病理类型分析 由病理科1名主任医师及1名主治医师讨论确定PSP病灶的病理及免疫组化结果。观察并记录病灶在光镜下的4种组织学结构:实性区、乳头状区、硬化区、血管瘤样区(出血区)[6]。
1.5 统计学处理 采用SPSS 17.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差(x±s)表示,2组间比较采用两样本 t检验。对 SUVmax值与病灶最长径、CT值、绝对强化CT值进行线性回归分析,将存在线性关系的变量建立线性回归模型,并评价不同回归模型的拟合效果。P<0.05为差异有统计学意义。
2 结果
2.118F-FDG PET/CT表现 17例PSP病人的病灶肺本底平均 SUVmax值为 1.0±0.8,病灶 SUVmax为2.4±2.3。 其中,8 例(47.1%)的病灶 SUVmax值(0.8±0.2)低于或等于肺本底,9 例(52.9%)的病灶 SUVmax值(3.7±2.4)高于肺本底,5 例(29.4%)的病灶 SUVmax>2.5。所有高于肺本底摄取的PSP均呈结节状摄取增高,摄取较均匀。
2.2 CT影像表现
2.2.1 形态、部位、数量、病灶最长径 17例病人均为PSP单发病灶。其中,15个(88.2%)病灶表现为圆形或类圆形,2个(11.8%)为不规则形;位于左肺上叶 5个(29.4%),左肺下叶 3个(17.6%),右肺上叶 4个(23.5%),右肺下叶 5个(29.4%),对应的病灶最长径分别为 8.9~10.6 mm、10.8~20.1 mm、9.8~21.2 mm、10.2~29.5 mm。17个PSP病灶平均最长径为(16.1±5.8)mm。
2.2.2 伴随征象 6个病灶呈浅分叶征 (35.3%),7个边缘或内部有砂粒状钙化(41.2%);出现囊变、小斑片状稍低密度影5个(29.4%),尾征3个(17.6%),局限性空气潴留征5个(29.4%),空气新月征(空气潴留征的典型表现)1个(5.9%)。全部病灶均未见毛刺及空洞。详见图1-3。
2.2.3 CT值及强化特征 17个病灶平均CT值为(40.2±13.7)HU,平均绝对强化 CT 值为(89.3±22.9)HU。 7个(41.2%)呈均匀强化,10个(58.8%)不均匀强化。增强CT显示轻度强化7个(41.2%)、中度强化5个(29.4%)、明显强化5个(29.4%)。
2.3 线性回归分析 SUVmax与病灶最长径(R=0.073,R2=0.005,F=3.83,P=0.780)和 CT 值(R=0.212,R2=0.045,F=5.79,P=0.840)无线性关系;但与绝对强化CT值呈线性相关,随着绝对强化CT值的增加,SUVmax值增高。以绝对强化CT值为自变量,SUVmax为因变量建立回归模型,线性与二次曲线拟合方程分别为 y=8.547+0.298x、y=12.114+0.801x+0.014x2(分别 F=22.428,P<0.001;F=13.181,P=0.001),二次曲线的拟合效果优于直线(分别R=0.808,R2=0.599;R=0.774,R2=0.653)(图 4)。
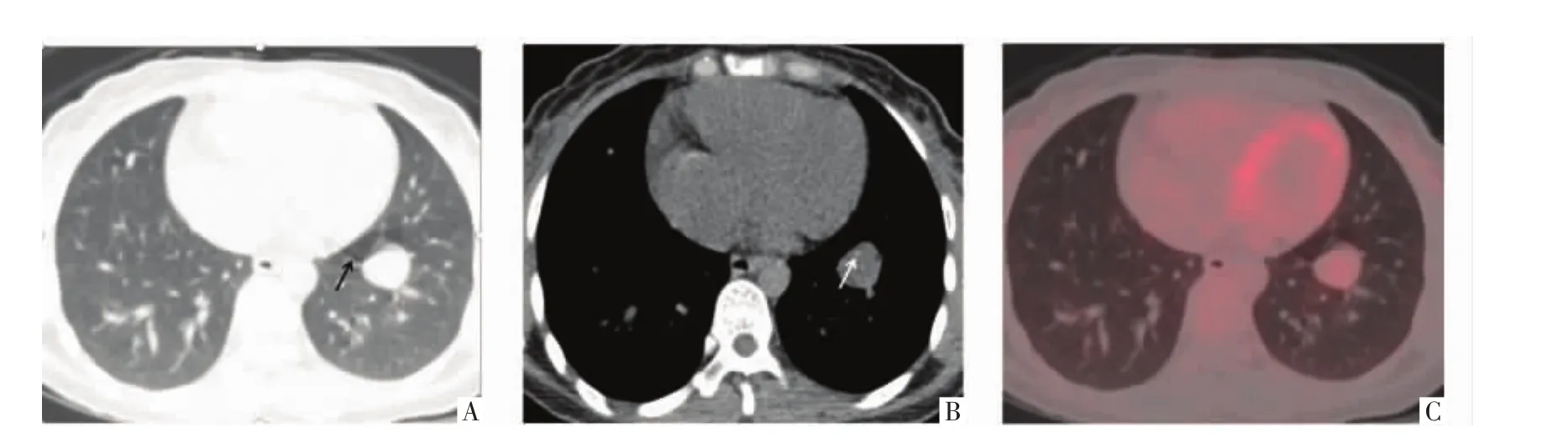
图1 病人女,35岁,PSP。A图为CT横断面肺窗,B图为CT横断面纵隔窗,C图为PET横断面影像。示左下肺类圆形结节,直径约 23 mm,周围空气潴留(A,黑箭),边缘砂粒样钙化(B,白箭),FDG摄取增高(C),SUVmax为 2.0。

图2 病人女,34岁,PSP。A图为CT横断面肺窗,B图为CT横断面纵隔窗,C图为PET横断面影像。示左肺上叶卵圆形结节,29 mm×20 mm,浅分叶、尾征(A,细箭)及空气新月征(A,粗箭头),边缘见砂粒样钙化(B,白箭),FDG 摄取增高(C),SUVmax为 2.1。
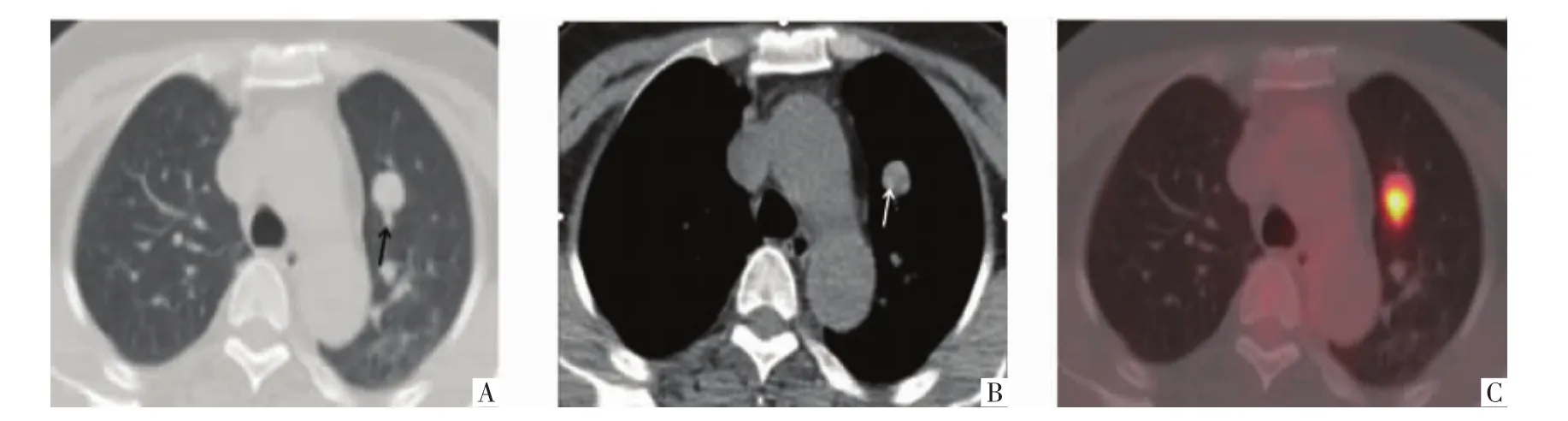
图3 病人女,55岁,PSP。A图为CT横断面肺窗,B图为CT横断面纵隔窗,C图为PET横断面影像。示左上肺类圆形结节,直径 15 mm,尾征(A,黑箭),周围砂粒样钙化(B,白箭),FDG 摄取明显增高(C),SUVmax为 9.3。

图4 SUVmax与绝对强化CT值的线性回归分析拟合曲线
2.4 不同病理类型病灶的SUVmax值比较 在17个PSP中,组织学结构以乳头状区和实性区为主型11例(64.7%),SUVmax=3.0±2.5;以硬化区和血管瘤样区为主型 6例(35.3%),SUVmax=1.2±0.9。前者的 SUVmax值高于后者(t=2.133,P=0.047)。
3 讨论
3.1 临床表现 PSP是临床上一种少见的良性肿瘤,2015年WHO肺和胸膜肿瘤病理学分类[2]将PSP归入肺腺瘤,为一种肺泡细胞起源的肿瘤。免疫组织化学和免疫电镜研究显示[6]PSP由类似Ⅱ型肺泡上皮及圆形细胞构成,组织学上可见实性、乳头状、硬化及出血(血管瘤样区)不同复合区域。有文献[6-8]报道,PSP临床表现无特异性,多为偶然发现,仅少数病人有咳嗽、咳痰、痰中带血或咯血、胸背痛等症状;好发年龄15~76岁,平均年龄50岁左右。女性发病多见,是由于肿瘤内类固醇性激素受体的表达特别是黄体激素受体的表达。本组大多数病例为偶然发现,有呼吸系统症状的4例,包括胸闷、胸痛、咳嗽、咳痰及咯血。本组女性病例多见,平均年龄50.4岁,与文献[8]报道结果基本一致,但男女比例约1∶2,高于文献[8]报道的结果,可能与PET/CT不如CT使用广泛有关,也可能与本研究受检者的性别构成比有关。
3.2 CT影像特征 CT平扫是发现PSP的主要方法,其主要表现为圆形或类圆形、边缘光整、清晰的结节或肿块,多单发,个别可多发(约占4%)[9-11]。本研究发现PSP的CT伴随征象主要包括:①浅分叶征,可能是由于肿瘤内部不同的组织成分不均匀生长所致。李等[1]报道的25例PSP中11例(44%)有浅分叶,本组17例中有6例(35.3%)表现为浅分叶,与该文报道的结果近似。②砂粒状钙化,肿瘤内部密度一般较均匀,部分可伴囊变或坏死,钙化常见,可占PSP的40%以上[6]。本组有7例(41.2%)存在钙化,肿瘤的边缘或内部可见钙化,均为点样或砂粒状,与文献[6]报道结果一致。③囊变或小斑片状影,本组中5例(29.4%)显示病灶内有小斑片样的稍低密度区,史等[6]通过病理对照研究发现低密度区为瘤体内充满黄色液体的囊变区,可能和肿瘤血供丰富、易出血有关。PSP囊变的发生率≥20%[12]。④尾征,PSP病灶靠近肺门一侧可见尾状突起,本组有3例(17.6%)出现尾征,推测可能与部分PSP血供丰富、肺门血管趋向性生长有关。⑤空气潴留征,肿瘤周围可发现局限性空气潴留,部分层面上可表现为典型的空气新月征,本组5例(29.4%)表现空气潴留征,1例(5.8%)为典型空气新月征,推测局限性空气潴留有多种发生机制[13],CT影像上多近似局限性肺气肿的表现,邻近支气管压迫阻塞形成活瓣样结构可能为其主要的发生机制。空气潴留征有一定的特征性,而周围型肺癌、真菌感染等病灶周围亦见有空气潴留,也可表现典型空气新月征[13],因此该征象能否作为鉴别诊断特征,尚需更多病例进一步研究。
3.3 PSP的18F-FDG PET/CT、增强CT及病理特征 有研究[3-4]报道,18F-FDG PET/CT上PSP均表现为18F-FDG高摄取。本研究中9例18F-FDG摄取增高,8例低或无摄取,其SUVmax值分别为3.7±2.4和0.8±0.2,既往有文献[5]报道以SUVmax=2.5作为评估肿瘤良恶性的标准,这有可能造成严重的误诊。本研究发现 5 例(29.4%)的 SUVmax>2.5,Jiang 等[14]报道的 12 例 PSP 中有 6 例(50%)SUVmax>2.5,王等[4]报道5 例 PSP 中的 4 例(80%)SUVmax>2.5,这均表明 PSP中有相当一部分病灶会出现18F-FDG高摄取,因此增加了PSP与恶性病灶鉴别的难度。董等[5]研究表明增强CT可以提高PSP的诊断准确率,有文献[5,13]报道增强CT上PSP多呈明显均匀强化,强化程度多为轻度及中度,本研究中41.2%的PSP呈均匀强化,58.8%的PSP呈不均匀强化,与上述文献的结果不符,原因可能与肿瘤的病理类型、组织结构及分布有关。本研究中70.6%的PSP呈轻度及中度强化,29.4%的PSP表现为明显强化,与上述文献报道相符。本研究通过线性回归分析发现,PSP病灶SUVmax与绝对强化CT值呈线性关系,随着绝对强化CT值的增加,SUVmax值随之增高,二次曲线的拟合效果优于直线,表明绝对强化CT值可能反映肿瘤内部的代谢活性。本研究还发现PSP有无FDG摄取与组织病理学的构成有关,PSP含有实性区、乳头状区、硬化区及血管瘤样区(出血区)4种组织结构,多为2种或多种组织学结构混合而成,最多见为乳头状区和实性区为主型、硬化区和血管瘤样区为主型[6]。故本研究对这2种PSP病理分型进行分析,结果5个PSP的SUVmax>2.5,经手术证实病理类型均以乳头状区和实性区为主型,通过影像与病理对比分析显示,以乳头状区和实性区为主型的SUVmax值高于以硬化区和血管瘤样区为主型的SUVmax值,表明SUVmax与肿瘤的病理类型有关,通过SUVmax代谢活性可大致推测肿瘤的病理类型。本研究由于样本量较少且PET/CT显像剂单一,尚存在一定的局限性。今后将通过加大样本或者多中心合作研究,获得更多的PSP代谢信息,以提高其诊断准确率。
3.4 小结 综上所述,PSP是好发于女性的一种肺内少见的良性肿瘤,多为边缘清晰的孤立性肿块,可伴有浅分叶征、砂粒状钙化、囊变、尾征、空气潴留征等征象,增强CT多表现为轻中度强化,少部分可表现为明显强化。PSP的PET/CT成像表现多样,可呈结节状FDG摄取增高、低或无FDG摄取。PSP的代谢信息可反映PSP的病理类型,绝对强化CT值亦能反映肿瘤内部的组织结构,随着绝对强化CT值的增加,PSP的SUVmax值也随之增高。因此,结合PSP的PET/CT上的代谢表现及CT影像特征可进一步明确诊断。
