三碘甲腺原氨酸对根尖牙乳头干细胞成牙/骨向分化的影响及其机制的初步探究
2020-07-08夏翊博于金华
夏翊博,于金华
根尖牙乳头干细胞(stem cell from apical papilla, SCAPs)是存在于牙根未发育完全牙齿根尖乳头的一种间充质干细胞[1],其具有较强的分化能力,研究认为其是一种有潜力用于组织再生修复的种子细胞[2-4]。
甲状腺激素(thyroid hormones,TH)是一种重要的激素,其参与调控发育、代谢等重要过程。甲状腺功能亢进(以下简称甲亢)是在临床上十分常见的内分泌疾病,有着较大的患者群体[5-6]。血清中游离TH水平过高会产生一系列不利影响。临床、实验室及流行病学研究表明,甲亢可导致各种硬组织发育、代谢异常,如:颅缝早闭、牙齿发育异常等[7-8]。这提示我们,血清中游离TH水平过高可能会影响干细胞成牙/骨向分化。然而,高浓度的TH对 SCAPs的成牙/骨向分化能力是否有影响罕见文献报道。本实验将验证TH的主要生物活性形式——3,5,3′-三碘甲腺原氨酸(3,5,3′-triiodothyronine, T3)[9]对SCAPs成牙/骨向分化的影响,并对其机制进行初步的探究。
1 材料和方法
1.1 主要试剂
3,5,3′-三碘甲腺原氨酸(Sigma,美国),Ⅰ型胶原酶(Gbico,美国),胰酶(Gbico,美国),α-MEM(Hyclone,美国),胎牛血清(Gbico,美国),青-链霉素双抗(Gbico,美国),CCK-8试剂盒(Dojindo,日本),碱性磷酸酶活性检测试剂盒(建成,中国),BCA试剂盒(建成,中国),BCIP/NBT显色试剂盒(碧云天,中国),RIPA裂解液(碧云天,中国),SDS- PAGE 凝胶试剂盒(凯基,中国),SYBR Premix Ex Taq 试剂盒(大连宝生物工程有限公司),Super-Signal West Pico化学发光底物(Thermo,美国),茜素红染色液(Sigma,美国),油红染色液(Solarbio,中国),阿新蓝染色液(Solarbio,中国),成骨诱导液(cyagen,美国),成脂诱导液(cyagen,美国),成骨诱导液(cyagen,美国)。
1.2 实验方法
1.2.1 SCAPs原代培养 于南京医科大学附属口腔医院颌面外科门诊收集拔除的根尖未发育完全的健康牙齿(经患者知情同意),使用含1%双抗的PBS清洗离体牙2次,眼科剪分离牙乳头并置于α-MEM培养基中剪碎,加入Ⅰ型胶原酶和胰酶,转移至37 ℃细胞培养箱中孵育,每5 min 轻震1次,20 min后加入FBS终止消化,1 000 r/min离心5 min,弃上清,加入含2%双抗完全培养基,吹打均匀后转入中皿,37 ℃、5% CO2培养箱培养,3 d后初次换液,以后每2 d换液,待细胞融合至80%传代,取状态良好的3~5代细胞进行实验。
1.2.2 细胞干性鉴定 细胞接种于6孔板,加入矿化诱导液培养14 d,弃培养液,PBS漂洗两遍,4%多聚甲醛固定15 min,ddH2O漂洗2遍,茜素红染液(pH=4.2)染色;加入成脂诱导液培养25 d,弃培养液,PBS漂洗2遍,4%多聚甲醛固定15 min,油红O染液染色;加入成软骨诱导培养液培养30 d,4%多聚甲醛固定后,包埋剂包埋,切片,制片,阿新蓝染色。镜下观察并拍照。
1.2.3 T3条件培养基配制 将T3粉末溶解于1 mol/L NaOH溶液配制成浓度为1×10-3mol/L的T3母液,-80 ℃保存。使用前配制成为含所需浓度T3的条件培养基。
1.2.4 最佳刺激浓度的筛选 将SCAPs接种于6孔板。配制T3浓度为1×10-11、1×10-10、1×10-9、1×10-8mol/L的条件培养基分别加入,每2 d换液,5 d后弃原培养液,PBS洗两遍,吸干PBS后加入含1%苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)的RIPA裂解液处理10 min,刮下细胞转移至EP管,超声裂解,12 000 r/min、4 ℃离心,按说明书程序测各组ALP活性,BCA法测蛋白浓度。剩余上清调平浓度后4∶1加入上样缓冲液,100 ℃水浴5 min,-80 ℃保存。按产品说明书配制SDS-PAGE,每泳道上样10 μL,60 V恒压电泳至条带分离至胶底部,300 mA转膜,PVDF膜转移至5%脱脂奶粉中室温封闭1 h,一抗封闭4 ℃过夜;次日摇床复温度1 h,PBST漂洗10 min 3次,二抗室温封闭1 h,含吐温的Tris缓冲液(tris buffered saline Tween,TBST)漂洗10 min 3次,加入化学发光液,化学发光凝胶成像系统曝光。获取图像后使用image J软件进行灰度分析。选取ALP表达最高的T3浓度作为实验浓度进行后续实验。
1.2.5 CCK-8法检测增殖能力 将SCAPs接种于96孔板,细胞贴壁后无血清培养基同步化处理24 h。以完全培养基处理组作为对照组,T3条件培养基处理组作为实验组,每2 d换液,培养0、1、3、5、7、9 d后吸去原培养基,每孔加入100 μL 10% CCK-8液,37 ℃ 孵育2 h后将液体转移至新的96孔板,酶标仪测波长450 nm处OD值,并绘制增殖曲线。
1.2.6 实时定量RT-PCR检测成骨相关基因表达 将SCAPs接种于中皿中,T3条件培养基处理0、3、7 d后,按照说明书提取总RNA并进行逆转录。DSPP、RUNX2、DMP1、OSX等目的基因和内参基因GAPDH由上海生工合成(表1)。使用定量PCR酶混合物试剂盒和实时荧光定量PCR仪进行检测,条件如下:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40 个循环。利用2-ΔΔCt法计算各指标的相对量。
1.2.7 Western Blot检测成牙/骨相关蛋白表达 将SCAPs接种于中皿,T3条件培养基处理0、3、7 d后,按实验1.2.4步骤提取总蛋白并检测成牙/骨向分化相关蛋白的表达并进行灰度分析。
1.2.8 碱性磷酸酶(ALP)染色 将SCAPs接种于12孔板,细胞贴壁后更换无血清培养基同步化24 h,分别加入完全培养基、T3条件培养基,隔日换液,培养5 d,弃培养液,PBS漂洗2遍,4%多聚甲醛固定15 min后吸去固定液,ddH2O漂洗两遍,NBT/BCIP染液按说明书比例配制后加入,避光染色30 min。

表1 RT-PCR引物序列Tab.1 Primers used in RT-PCR
1.2.9 Western Blot检测MAPK通路相关蛋白 将SCAPs接种于中皿中,T3条件培养基处理后,按实验1.2.4提取总蛋白并检测MAPK通路关蛋白表达并进行灰度分析。
1.2.10 U0126处理后检测牙/骨向分化相关蛋白表达 将SCAPs接种于中皿中,T3、T3+U0126、U0126条件培养基处理后,按实验1.2.4提取总蛋白检测成牙/骨向分化相关蛋白表达量并进行灰度分析。
1.3 统计学方法
统计分析使用SPSS 17.0进行。两组间数据的比较使用student’st检验,多组数据比较使用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 细胞培养及干性鉴定
倒置显微镜下观察,培养3 d后,可见梭形细胞聚集在组织块周围(图1)。所分离培养细胞可以诱导成骨、成软骨和成脂分化(图2),即该细胞为有多向分化能力的干细胞。
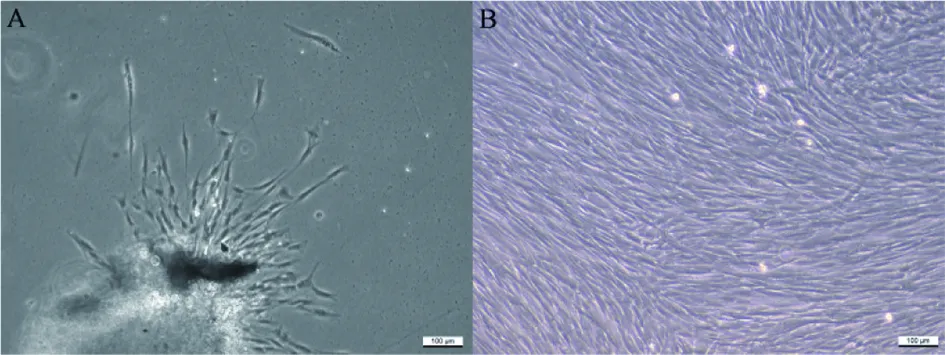
A:原代培养的SCAPs;B:第二代SCAPs
图1 SCAPs的显微镜下图片( ×200)
Fig.1 SCAPs under microscope( ×200)
2.2 T3对SCAPs ALP表达的影响
用1×10-11、1×10-10、1×10-9、1×10-8mol/L的条件培养基刺激SCAPs 5 d后, 测定ALP表达及活性并绘制柱状图。结果显示1×10-9mol/L T3条件培

A:茜素红染色;B:油红染色;C:阿新蓝染色
图2 诱导SCAPs多向分化( ×200)
Fig.2 Multi-directional differentiation of SCAPs( ×200)
养基显著提高ALP表达及活性,且高于其他各组(P<0.001)(图3)。

**:P<0.01;***:P<0.001;Con:对照组
A:Western Blot检测碱性磷酸酶表达;B:A的定量分析;C:碱性磷酸酶活性
图3 不同浓度T3处理SCAPs 5 d后的ALP表达量和活性
Fig.3 The ALP expression and activity of SCAPs after treated with different concentrations of T3 for 5 d
2.3 T3 对SCAPs细胞增殖的影响
CCK-8结果表明对照组与T3组SCAPs增殖能力没有显著差异(P>0.05)(图4)。
2.4 T3对SCAPs成牙/骨向分化的影响
T3条件培养基培养5 d后,碱性磷酸酶染色表明其ALP表达高于对照组(图5)。实时定量RT-PCR与Western Blot结果表明,细胞在T3条件培养基中培养3、7 d后,成牙/骨相关基因/蛋白:DSPP/DSPP、RUNX2/RUNX2、DMP1/DMP1、OSX/OSX表达显著提高(P<0.05)(图6、7)。

图4 T3对SCAPs增殖能力的影响Fig.4 Effect of T3 on the proliferation of SCAPs

图5 T3处理5 d后碱性磷酸酶染色Fig.5 Images of alkaline phosphatase staining after treated with T3 for 5 d

*:P<0.05;**:P<0.01
图6 成牙/骨相关基因表达
Fig.6 Experessions of the related odonto/ostegenic gene
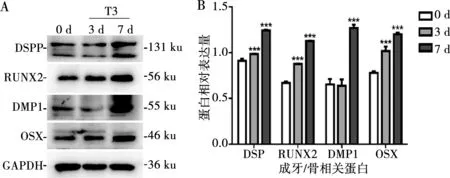
***:P<0.001
A:Western Blot检测成牙/骨向分化相关蛋白;B:A的定量分析
图7 T3对SCAPs成牙/骨向分化相关蛋白的影响
Fig.7 Effect of T3 on the odonto/ostegenic related proteins of SCAPs
2.5 T3 对MAPK 通路的影响
T3条件培养基处理0、15、30、60 min后,检测MAPK通路相关蛋白表达的变化,并进行灰度分析。结果显示T3处理后,ERK的磷酸化水平提高(P<0.001)(图8)。
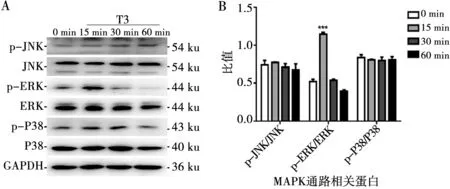
***:P<0.001
A:Western Blot检测MAPK信号通路相关蛋白;B:A的定量分析
图8 T3对MAPK信号通路的影响
Fig.8 Effect of T3 on the MAPK signal pathway
2.6 U0126对成牙成骨向分化相关蛋白表达的影响
在使用ERK抑制剂U0126处理后,原本由T3所引起的成牙/骨向分化相关蛋白DSPP、RUNX2、DMP1、OSX的升高被抑制(P<0.001)(图9)。

***:P<0.001
A:Western Blot检测成牙/骨向分化相关蛋白;B:A的定量分析
图9 U0126对SCAPs成牙/骨向分化相关蛋白的影响
Fig.9 Effect of U0126 on the odonto/ostegenic related proteins of SCAPs
3 讨 论
组织再生技术是一种极富潜力治疗硬组织缺损的方式,然而其广泛应用于临床尚有很多问题需要解决。临床上所面对的患者常常不处于理想的生理状态,而某些异常生理状态对干细胞的影响尚不明确。内分泌疾病在临床上十分常见,研究表明:糖尿病会造成牙髓干细胞(dental pulp stem cells,DPSCs)增殖分化能力变弱[10];雌激素的缺乏会抑制DPSCs的成骨分化[11];高浓度的甲状旁腺素会促进SCAPs的成骨[12]。这提示我们各种常见内分泌疾病都有可能对种子细胞的分化产生有利或不利影响。因此,这些干细胞在进行临床应用前,对各种内分泌因素的影响进行研究是十分必要的。
甲状腺素对骨的发育和维持具有重要意义,但是在不同条件下,可能会对细胞产生不同影响。胶原蛋白是骨矿化沉积的骨架,有研究者用高浓度的T3刺激骨细胞,发现其通过上调相关基因的表达促进Ⅰ型胶原的表达和交联[13],而在软骨细胞的实验中也有类似的结果[14]。有学者使用T3处理MC3T3-E1细胞,发现其多项成骨相关指标表达均有所上调[15]。动物实验表明宫内过量的甲状腺素暴露会导致小鼠颅缝早闭,这可能是由于甲状腺素促进颅缝处的成骨细胞过度分化所导致的[7]。同时也有研究认为T3可能不利于骨的生成[16]。张翔等对家兔连续注射左旋甲状腺素8周后,牙槽骨密度发生明显降低[17]。
本实验通过1×10-9mol/L T3对SCAPs进行培养,发现该浓度的T3可以促进SCAPs的成骨向分化。ALP是成骨分化的早期指标[18],我们通过检测发现1×10-9mol/L T3对SCAPs碱性磷酸酶活性及表达的提高幅度最大,因此选择该浓度进行后续实验[19-20]。CCK-8结果表明该浓度T3条件培养基对SCAPs的增殖没有明显影响。Western Blot和RT-PCR结果显示DSPP、RUNX2、DMP1、OSX等成牙成骨相关指标的mRNA和蛋白表达均呈现上升趋势。牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)在牙本质形成过程中起到重要作用[21];runt相关转录因子-2(runt-related transcription factor-2,RUNX2)是一种转录因子,其在牙、骨等硬组织的形成过程中起到关键作用,它通过下游的成骨相关转录因子(osterix,OSX)调节磷灰石的形成[22-23]。骨基质酸性蛋白1(dentin matrixacidic phosphoprotein 1,DMP1)是牙本质织矿化、代谢的基础,实验发现DMP1基因的缺失会导致矿化异常或缺陷[24]。综合以上结果我们认为1×10-9mol/L T3可以促进SCAPs的牙/骨向分化。
信号通路在细胞的各种生物学行为中扮演重要角色,许多研究都证实MAPK信号通路对牙源性干细胞的成牙和(或)成骨向分化有着调控作用[25-26]。ERK是MAPK信号通路的成员之一,研究发现T3通过ERK/MAPK通路调节多种细胞的生物学行为,如细胞的增殖、自噬和分化等[27-28]。MAPK通路通过磷酸化完成信号传递,本实验中,ERK的磷酸化水平在T3刺激后15 min显著提高,提示ERK信号通路被激活。U0126是ERK的抑制剂[29],其通过抑制ERK的上游分子MEK的活性发挥抑制效应,它是被广泛用作ERK研究的药理学工具。当使用U0126处理后,由T3所引起的成牙/骨向分化相关蛋白表达量的升高被抑制。以上结果提示T3促进SCAPs的成牙/骨向分化的作用可能与ERK密切相关。
本实验探讨了T3对SCAPs成骨向分化的影响,发现1×10-9mol/L T3能够增强SCAPs成骨向分化的能力,并初步探讨了这个过程与MAPK通路的联系。这从一定程度上说明SCAPs作为种子细胞运用于甲亢患者的硬组织再生的可行性,为进一步深入探索牙齿、骨骼等硬组织的再生修复提供一定的参考,为后续的研究和临床应用提供实验依据。
