瘦素对乳腺癌MDA-MB-231细胞MMP14调控作用的研究①
2020-07-07周雪清刘倩倩刘文慧杨姝娅骆耐香
周雪清,刘倩倩,张 杰,刘文慧,杨姝娅,骆耐香③
(1.桂林医学院免疫学教研室,广西 桂林 541004;2.川北医学院附属医院检验科,四川 南充 637000;3.桂林医学院第二附属医院检验科,广西 桂林 541199)
流行病学研究表明,乳腺癌已成为威胁全球女性健康和生命主要的因素之一[1],而肥胖与乳腺癌的患病风险和其临床行为密切相关[2]。瘦素(leptin)是由脂肪组织分泌的与肥胖有关的重要激素,能够与瘦素受体结合后通过调节饮食摄入和能量代谢参与体内内环境平衡的维持[3],同时它还参与了机体卵巢癌、胃肠道肿瘤等多种肿瘤的发生和发展[4]。膜型基质金属蛋白酶(membrane-type matrix metalloproteinase-1,MT1-MMP)即MMP14属于基质金属蛋白酶家族,它直接或间接降解细胞外基质中的多种成分,与肿瘤的侵袭与迁移密切相关[5]。已知瘦素与MMP14均可促进乳腺癌的发生与发展[2-5],而两者之间在乳腺癌是否有关联目前尚无相关的研究报道。因此,本课题组以乳腺癌细胞系为研究对象,探讨瘦素是否可以通过影响MMP14的表达促进乳腺癌发生和发展,为开发一种乳腺癌新型治疗靶点提供思路。
1 材料与方法
1.1 细胞株与主要试剂
人乳腺癌细胞株MDA-MB-231购自中国科学院上海细胞库。人重组瘦素购自美国 Peprotech公司,RPMI1640培养基及胰蛋白酶由美国Gibco公司提供,胎牛血清由美国Gemini公司提供,兔抗人MMP14抗体由Abcam公司提供,鼠抗人β-actin抗体及相关二抗由北京中山金桥生物有限公司提供,MTT试剂盒由北京索莱宝科技有限公司提供,ERK1/2、JNK、P38的信号通路抑制剂FR180204、SP600125、SB203580均由上海蓝木化工有限公司提供。
1.2 细胞培养
人乳腺癌细胞株MDA-MB-231用含有10% 胎牛血清的RPMI1640完全培养基于37 ℃、5% CO2的细胞培养箱中温育。
1.3 western blot法检测细胞MMP14的蛋白表达水平
将处于对数生长期乳腺癌细胞接种于6孔板中,分对照组(不加瘦素)、不同浓度瘦素组(25,50,100,200,400 ng/ml)及瘦素+不同信号通路抑制剂组,作用24 h后提取各组细胞总蛋白,用western blot法检测各组细胞MMP14的蛋白表达。实验独立重复3次。
1.4 MTT法检测细胞增殖率
将处于对数生长期乳腺癌细胞经胰酶消化,制成单细胞悬液后,接种于96 孔板中,分二甲基亚砜(DMSO)组(溶剂组)、瘦素+DMSO组(对照组)及瘦素+不同通路抑制剂组,检测作用0,1,2,3,4 d的吸光度值。每组设6个复孔,计算平均值。实验独立重复3次。
1.5 划痕实验检测细胞迁移能力
取对数生长期乳腺癌细胞接种于12孔板中,分DMSO组、瘦素+DMSO组及瘦素+不同通路抑制剂组。瘦素作用前,用200 μl移液器枪头在12孔板内垂直划痕,PBS清洗2遍,然后换成含1%胎牛血清的培养基并做相应的组别处理。各组分别加入DMSO、瘦素+DMSO、瘦素+不同通路抑制剂(瘦素浓度100 ng/ml,各通路抑制剂浓度均为500 ng/ml),在镜下观察,根据乳腺癌细胞的生长周期选择每12 h为1个观察时间点观察细胞迁移变化并拍照直至划痕完全愈合,计算平均划痕愈合率。实验独立重复3次。
1.6 统计学分析
2 结果
2.1 不同浓度瘦素处理后乳腺癌细胞MMP14的蛋白表达水平
western blot结果显示,与对照组相比,25,50 ng/ml瘦素组MMP14表达水平没有差异, 100,200,400 ng/ml瘦素组MMP14表达水平明显高于对照组(P<0.05或P<0.01),且随着瘦素浓度的增加而升高。详见图1。
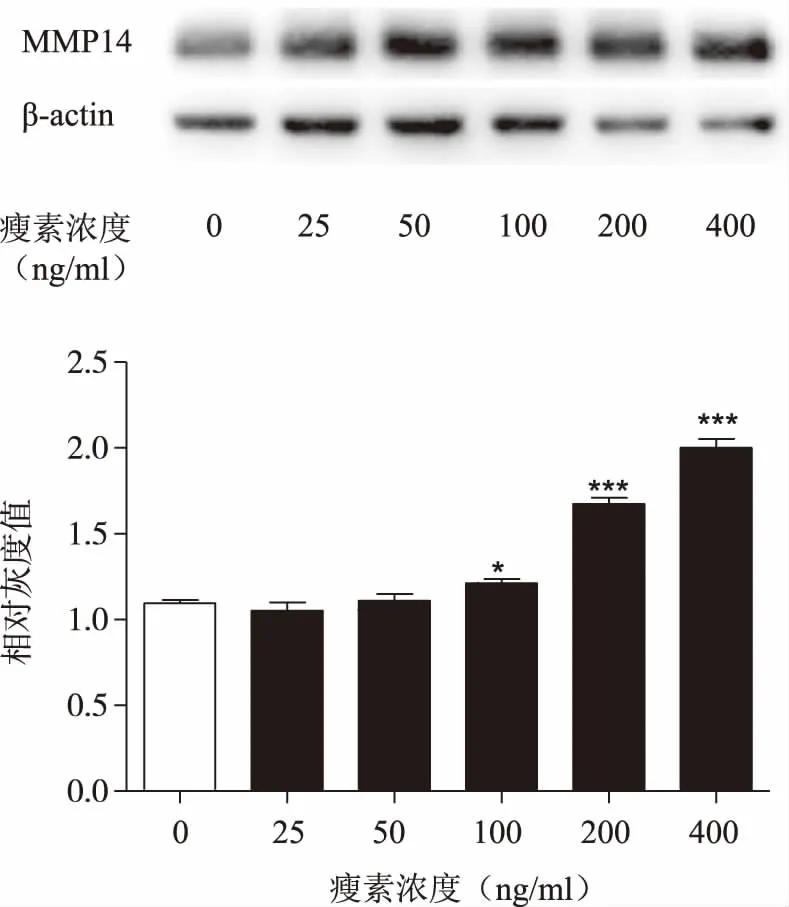
图1 不同浓度瘦素处理乳腺癌细胞24 h后MMP14的蛋白表达(*P<0.05,P<0.01,*P<0.001)
2.2 瘦素联合DMSO及不同通路抑制剂处理后乳腺癌细胞MMP14的蛋白表达水平
western blot结果显示,与DMSO组相比,瘦素+DMSO组MMP14蛋白表达明显升高(P<0.001)。与瘦素+DMSO组相比,瘦素+JNK 通路抑制剂组MMP14的蛋白表达量明显降低(P<0.001),而瘦素+ERK组及瘦素+P38组MMP14蛋白的表达均明显升高(P<0.01)。详见图2。
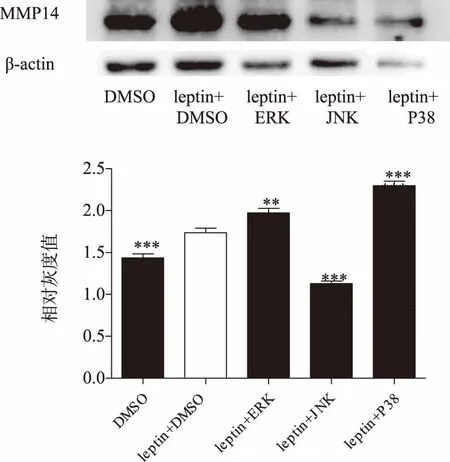
图2 瘦素联合DMSO及不同通路抑制剂处理乳腺癌细胞后MMP14的蛋白表达水平(P<0.01,*P<0.001)
2.3 瘦素联合不同通路抑制剂处理后乳腺癌细胞增殖能力的变化
MTT结果显示,随着培养时间的延长,瘦素+DMSO组的乳腺癌细胞增殖率均高于DMSO组(P<0.05或P<0.01)。瘦素+不同通路抑制剂组的细胞增殖率在第1~2天与瘦素+DMSO组无明显差异,在第3~4天则明显低于瘦素+DMSO组(P<0.05或P<0.01),在第3天瘦素联合JNK通路抑制剂组的细胞增殖率降低最为显著。详见图3。
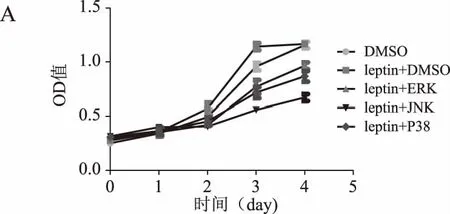
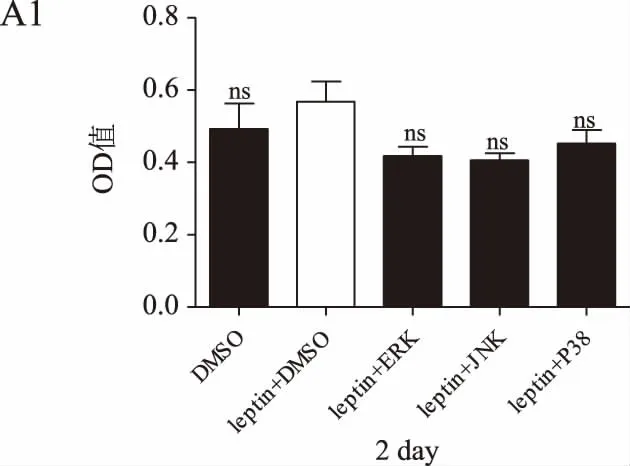
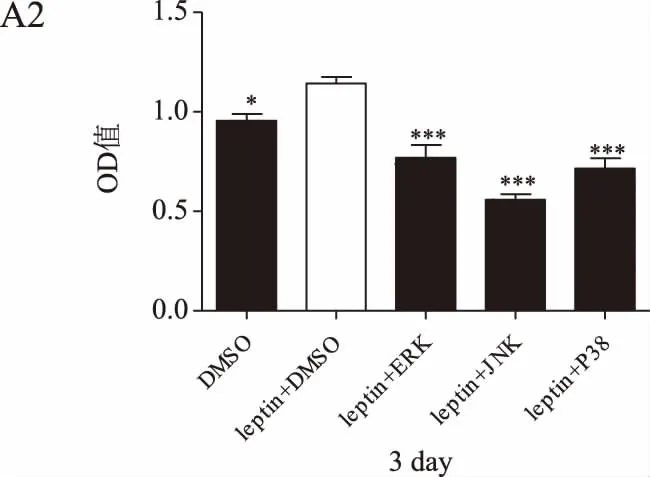
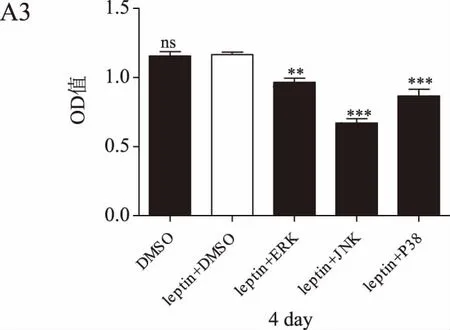
图3 瘦素联合不同通路抑制剂作用后乳腺癌细胞增殖情况(*P<0.05,P<0.01,*P<0.001)
2.4 瘦素联合不同通路抑制剂处理后乳腺癌细胞迁移能力的变化
划痕实验结果显示,瘦素+DMSO组的乳腺癌细胞迁移率在各检测时间点均明显高于DMSO组(P<0.05),瘦素+不同抑制剂组的细胞迁移率较瘦素+DMSO组均显著降低(P<0.01)。详见图4。
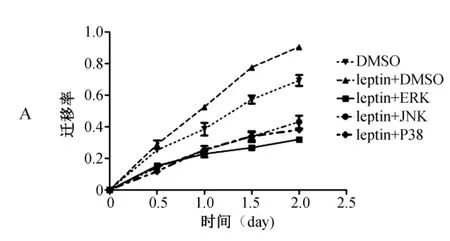
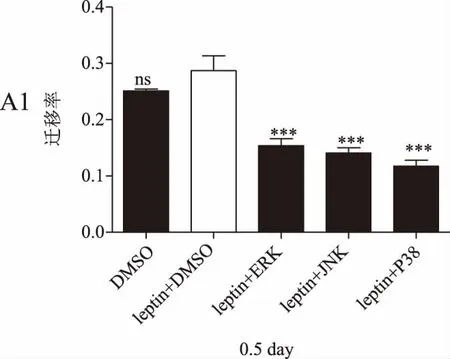
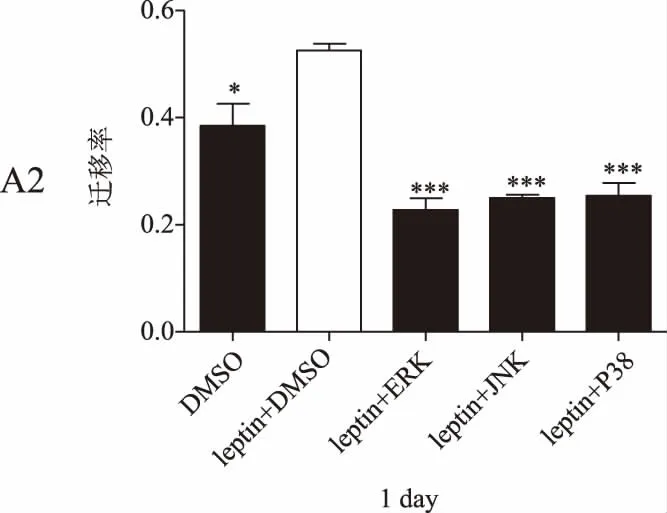
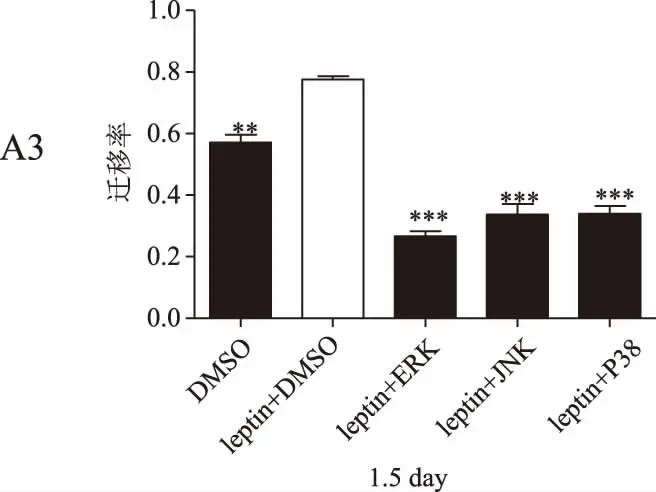
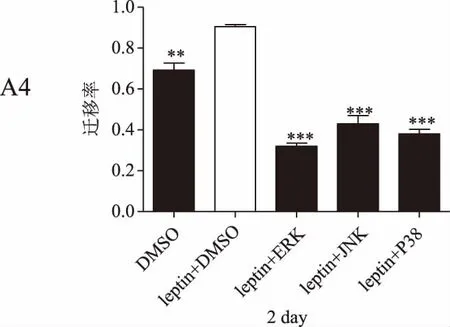
图4 瘦素联合不同通路抑制剂作用后乳腺癌细胞迁移率(*P<0.05,P<0.01,*P<0.001)
3 讨论
有研究表明,脂肪组织不仅在调节全身能量代谢中发挥重要作用,还能分泌包括瘦素和脂联素等因子[6]。瘦素由位于7号染色体的OB基因编码的蛋白质多肽类激素,主要由体内白色脂肪细胞合成分泌,包含167个氨基酸,分子量为16 KD[7]。瘦素通过与相应受体的结合,激活JAK-STAT通路以及丝裂原活化蛋白激酶(MAPK)、胰岛素受体底物(IRS)、磷酸肌醇3激酶/蛋白激酶B(PI3K/Akt)、蛋白激酶C(PKC)和Rho家族GTPase等从而发挥作用[8-10]。体内瘦素的含量肥胖型乳腺癌患者高于非肥胖者,这与乳腺癌高侵袭性及不良预后关系密切[2]。瘦素可通过影响包括上皮间充质转移、细胞与细胞外基质(ECM)的黏附以及ECM组分的蛋白水解等促进肿瘤转移[11-12]。瘦素还可通过富集调节性T细胞,分泌免疫抑制因子,使肿瘤逃脱宿主的免疫监视,加速肿瘤的发生发展[13]。基质金属蛋白酶(MMP)也在肿瘤发生和发展过程中促进肿瘤的侵袭和迁移[5]。已发现人类存在6种不同的膜型MMP(MT-MMPs),包括4种通过跨膜区域锚定在质膜上的Ⅰ型MT-MMP,即MT1-MMP、MT2-MMP、MT3-MMP和MT5-MMP,以及两种糖基磷脂酰肌醇锚定的MT4-MMP和MT6-MMP。其中MT1-MMP(即MMP14)过表达可诱导乳腺癌的形成,促进乳腺癌的发生发展,其他小鼠上皮癌模型也发现MMP14的表达,特别是在TME的肿瘤相关细胞中,且均已证实其参与了肿瘤的进展[14]。MMP14缺失的乳腺癌小鼠模型显示转移减少,其作用机制是基质成纤维细胞降解Ⅰ型胶原减少[15]。
既然瘦素和MMP14均有促进乳腺癌的作用,本课题组选用MDA-MB-231乳腺癌细胞系,检测瘦素对其MMP14表达的影响,探讨其相关机制,进一步了解两者在乳腺癌发生发展过程中的关系。研究结果显示,低浓度瘦素对乳腺癌细胞MMP14表达无明显影响,100 ng/ml及以上浓度均能显著促进MMP14蛋白表达(P<0.05),且具有浓度依赖性。瘦素处理后,乳腺癌细胞的增殖和迁移能力均明显升高,用ERK1/2、P38及JNK通路抑制剂分别和瘦素联合作用细胞后,细胞的增殖和迁移能力均明显降低(P<0.05)。用ERK1/2、P38通路抑制剂分别和瘦素联合作用细胞后,均可显著增加MMP14的表达水平(P<0.01),而JNK通路抑制剂和瘦素联合作用细胞后则显著降低MMP14的表达水平(P<0.001)。以上结果表明,瘦素可以促进乳腺癌细胞的增殖和迁移,可能通过ERK1/2、JNK及P38通路影响乳腺癌细胞MMP14的表达,其中JNK通路在失活状态下可下调乳腺癌细胞MMP14的表达,而ERK1/2、P38通路在失活状态下则上调MMP14的表达,促进乳腺癌细胞的增殖和迁移。有研究报道,瘦素还通过调节细胞周期蛋白D1、IGF-I、E-cadherin、血管内皮生长因子及其受体2、P53、Survivin以及多种组织因子的表达,调节乳腺癌增殖、黏附、侵袭、迁移、炎症和血管生成等多种重要分子的作用[3]。本研究尚有不足,例如,细胞系单一、未涉及瘦素受体的相关实验以及基因水平,有待于进一步研究。
本研究表明,瘦素可通过对MMP14蛋白表达的调控促进乳腺癌细胞的增殖和迁移。瘦素调控MMP14的作用可通过对ERK1/2、JNK及P38这3条信号通路的关键信号分子调控来实现。本研究创新性地提出了瘦素与MMP14的相关性,为开发新型乳腺癌诊断与治疗靶点提供实验依据。
