昆虫病原微生物及其在蝗灾治理中的应用
2020-07-07张鹏飞袁善奎
张鹏飞,袁善奎,张 龙
(1. 中国农业大学,北京 100094;2. 邢台学院,河北邢台 054000;3. 农业农村部农药检定所,北京 100125)
蝗灾在全球常年发生面积达4 680万km2,世界约有十分之一的人口遭受了蝗虫灾害的扰袭(张龙,2011)。随着环保和可持续性发展的需要,生物防控手段未来是蝗虫治理的主要方向和趋势,因此,昆虫病原微生物的研发在蝗虫防治中越来越显示出重要的潜力。
目前已知蝗虫的病原微生物主要有病毒、细菌、原生动物、真菌、线虫等。蝗虫痘病毒是唯一在蝗虫体内检测到的DNA病毒,目前用蝗虫痘病毒防治蝗虫的成本过高,无法用于实际生产中(Wang, 1994)。粘质沙雷氏菌Serratiamarcescens和绿脓假单胞菌PseudomonasaeruginosaMigula是研究较早的蝗虫细菌病原,二者由于流行水平低,并且对非靶标生物不安全,因而不具备进一步开发潜力。目前发现产碱假单胞菌Pseudomonaspseudoalcaligenes对蝗虫有致病性,并具有一定的开发潜力(Zelaznyetal., 1997)。对蝗虫有致病力的原生动物有微孢子虫、阿米巴和簇虫等(Johnson, 1997)。目前已发现9种对蝗虫有致病力的微孢子虫,它们分别是蝗虫微孢子虫NosemalocustaeCanning、锥头蝗微粒子虫Nosemapyrgomorphae、食蝗微粒子虫NosemaacridophagusHenry、疣蝗微粒子虫NosematrilorphidiaeWen et Li、楔孢微粒子虫NosemacuneatumHenry、蒙达拿微粒子虫NosemamontanaeWang和亚蝗微粒子虫NosemansiaticusWen、双色蝗皮雷虫PereziadichroplusaeLange和蝗虫亨利氏虫JohentealocustaeLange(Henry, 1967; Henry, 1971; Wangetal., 1991)。蝗虫微孢子虫N.locustae已实现商品化生产。不同种微孢子虫的寄主专化性不同,引起的病理症状和毒力也不同。阿米巴Malamebalocustae可导致蝗虫生殖力下降,是实验室饲养蝗虫的一个常见病原,磺胺类药物是防治蝗虫阿米巴的常用药物。簇虫Gregarines在自然界和管理较差的实验室蝗虫种群中都有发生,该病原是蝗虫的一个共生病原,对寄主的致病力弱。关于蝗虫的真菌病原研究较多,主要有绿僵菌、白僵菌、蝗噬虫霉等,其中绿僵菌、白僵菌已被开发为防蝗制剂。线虫由于侵染蝗虫时对自由水的要求较高,且有明显的寄主专化性,有一定开发潜力。旋尾线虫Spirurids和棘头线虫Acanthocephalans是对蝗虫致病力较强的两种线虫,但由于其主要以蝗虫作为中间寄主寄生鸟类和哺乳动物而失去了应用价值。小杆线虫Rhabditids也是蝗虫的一种寄生线虫,其虽然在自然界中发生较少,但由于发明了规模化生产技术,使应用潜力大大增加。索科线虫Mermithids可在蝗虫种群中流行,具有很好的应用前景(Baker, 1997)。以下对几种主要蝗虫病原微生物进行详细介绍,以期为蝗虫生物防治技术的研发和应用提供参考。
1 蝗虫痘病毒
蝗虫痘病毒隶属于只感染鳞翅目和直翅目昆虫的B属昆虫痘病毒,也是唯一在蝗虫体内检测到的DNA病毒(Wang, 1994)。限制性核酸内切酶分析和形态学特征,包括病毒包膜、侧体及核心是痘病毒分类鉴定的主要依据,目前已鉴定出15种蝗虫痘病毒(Purrinietal., 1988)。蝗虫M.sanguinipes痘病毒(MsEPV)是目前唯一可用从该蝗虫卵中分离出的细胞系进行体外培养的蝗虫痘病毒(Munderloh & Kurtti, 1989),体外培养的MsEPV的直径比体内培养的小,但对M.sanguinipes的致病力和毒力影响较小(Lange & Streett, 1993)。对人类、动物及非靶标昆虫,包括蜜蜂的致病力实验结果表明,蝗虫痘病毒是安全的(Goerzenetal., 1990; Vandenbergetal., 1990)。
与其他痘病毒的侵染过程类似,蝗虫痘病毒经取食进入肠道接触到目标细胞后,被细胞吞饮到吞饮泡内,吞饮泡内的水解酶系将其外壳水解掉,之后病毒中的DNA等核心物质被释放到寄主细胞质内,释放出的病毒DNA利用寄主细胞内的酶系统以及其他成分进行复制,然后重新组装成一个新的病毒,新病毒数量达到一定程度后,细胞发生崩解,将大量病毒释放出来(Erlandson, 1991; Erlandson & Streett, 1997)。蝗虫痘病毒主要攻击蝗虫的中肠和脂肪体,喂食蝗虫AmEPV病毒2 h后,在中肠内腔中检测到病毒粒子,喂食7 d以及14 d后,分别利用DNA探针和光学显微镜在脂肪体组织中检测到了病毒颗粒(Sakaletal., 1989)。细胞中大量积累新病毒而发生崩解,导致脂肪体组织出现过度增大的现象。在染病蝗虫的血淋巴中也检测到了痘病毒,但这些病毒是由被感染的脂肪体细胞崩解后释放出,还是由血淋巴细胞自身受到攻击而崩解释放出的尚不清楚(Miranpurietal., 1992; Woodsetal., 1992)。Johnson等人研究发现,蝗虫感染痘病毒5 d后取食量减少了25%,感染25 d后取食量减少了50%,同时体重也会下降,与对照相比,染病蝗虫的取食量与体重的比值增高,这与感染蝗虫微孢子虫的结果相反(Johnson & Pavlikova, 1986)。Olfert等人用蝗虫痘病毒接种蝗虫2~10 d,部分试虫死亡,接种11~14 d后死亡率下降,之后死亡率又开始上升。令人费解的是,在接种2~10 d内死亡的试虫体内检测不到病毒,用其尸体喂食健康蝗虫也不能使健康试虫染病,与之相反,从后期死亡的试虫体内检测到了病毒,尸体也能使健康蝗虫染病。前期死亡试虫的比例与喂食试虫的病毒剂量呈正相关,也即,喂食剂量越高,前期死亡的试虫越多,能够产生的病毒量越少。该现象的机制尚不清楚,但对病毒的活体规模化生产具有重要指导意义(Olfert & Erlandson, 1991)。
关于蝗虫痘病毒流行病的研究很少,可能与其发生较少有关。Streett等人在蝗虫发生地预先投放了携带痘病毒的蝗虫,之后多次进行流行病调查,都未观察到病毒流行的现象(Streettetal., 1997)。用蝗虫痘病毒淀粉颗粒剂进行的田间药效试验结果表明,在实验田施用高剂量和低剂量的痘病毒13 d后,流行率分别达到23%和14%,而对照为9.2%(McGuireetal., 1991)。另一个田间试验是在一块未检测到痘病毒流行的试验田开展的。试验期间,喷药试验田中的部分蝗虫扩散到了未施药的对照区域,最终的流行水平调查结果显示,在喷施高剂量病毒试验田,施药第7天至第14天期间,痘病毒流行率从30%降至7.5%。同样条件下,喷施低剂量病毒的试验田的流行水平从4.4%降至3.6%,对照则从11%降至4.4%。随后又连续调查了从第14天至第28天中3块试验田蝗虫痘病毒病的流行情况,结果表明,流行水平一直处于一个稳定的状态。由于调查过程中未统计由痘病毒致死的试虫,因此,实际值应高于上述的统计值(Streettetal., 1990)。与昆虫杆状病毒不同,被蝗虫痘病毒感染致死的蝗虫的体壁不发生破裂,因此,死亡尸体也不会将痘病毒释放出来。蝗虫取食同伴尸体的习性是蝗虫痘病毒传播流行最有可能的途径。Neill等人的研究结果显示,在试验田地面上投放一头死亡蝗虫后,半小时内,92%的尸体即被同伴吃掉(Neilletal., 1994),在种群密度较大的蝗虫发生地,甚至出现多头蝗虫竞争一头死亡蝗虫的现象(Neilletal., 1993)。还有研究表明,蝗虫对携带病毒和未携带病毒的尸体在取食偏好性上没有显著性差异(Streettetal., 1997)。蝗虫痘病毒在蝗虫种群中垂直传播的可能性也很小,因为被痘病毒感染致死的蝗虫多数都丧失了产卵能力(Bransonetal., 2006),若发生垂直传播,可能也是通过下一代蝗虫取食上一代携带痘病毒死亡蝗虫的方式实现。在气候条件适宜的地区,蝗虫在一年内可以发生两代,为下一代蝗虫取食上一代带病毒死亡蝗虫进行垂直传播创造了条件。然而,若一年只发生一代,那么第一代的尸体以及尸体内的病毒在第二年会发生什么变化,是否能够有效地传给第二代不得而知,相关研究领域也是一片空白(Streettetal., 1997)。蝗虫迁飞扩散的行为不利于痘病毒的垂直传播。蝗灾一般易在较小面积的地区爆发。Pfaldt等人对一个发生蝗灾的三角形地带进行调查发现,蝗灾发生后第二年,发生区的蝗虫大部分都迁移到附近另外一个区域,极大程度降低了下一代接触上一代尸体的可能性(Pfaldt, 1982)。蝗虫迁飞扩散的习性以及痘病毒有效传播途径匮乏是导致蝗虫痘病毒流行病发生少的主要原因(Streettetal., 1997)。
目前可通过痘病毒注射和喂食两种方式用活体蝗虫进行蝗虫痘病毒的规模化生产。注射生产的最大产量为2×108OBs/头,注射剂量为1×105OBs/头,喂食生产一般用拌有痘病毒的麦麸喂食蝗虫,最大产量为7.7×107OBs/头,所用麦麸为5 g,痘病毒为5×106OBs/头(Oma & Streett, 1993)。用喂食生产,每小时可喂2 000~3 000头试虫,而采用注射生产的方式,每小时只能注射100~125头试虫。从效率的角度考虑,前者效率更高,然而从成本的角度考虑,前者需要大量蝗虫,综合成本远高于后者(Streettetal., 1997)。Streett等人还就用蝗虫痘病毒与蝗虫微孢子虫防治蝗虫的成本进行了比较。蝗虫微孢子虫的最大产量为1×1012个孢子,生产所用蝗虫约250头,用痘病毒防蝗的每公顷需求量约1.2×1010OBs,注射生产时对应的蝗虫需求量约66头,而用微孢子虫防蝗的每公顷需求量约2.5×109个孢子,生产时所用蝗虫约0.62头,微孢子虫的防治成本约每公顷2.47美元,而痘病毒的防治成本达每公顷247美元(Henry, 1985; Streettetal., 1997)。可见,在现有的生产条件下,用蝗虫痘病毒进行蝗虫的防治成本过高,无法用于实际生产中。
2 蝗虫微孢子虫Nosema locustae
微孢子虫Microsporidia是一种单细胞原核生物,具有独特的结构和生活史,其典型阶段是休眠期孢子。休眠孢子大小不等,呈椭圆形,一端有凹陷,另一端为圆弧形,孢子表面有花样刻痕,孢子内部中央有两个细胞核,还有一条螺旋状的极丝和极质。微孢子虫多寄生于无脊椎动物,尤其是昆虫,寄主昆虫多达400种。微孢子虫目中的Nosema属主要寄主是直翅目和鳞翅目昆虫,Nosema属中的蝗虫微孢子虫是直翅目昆虫的专性寄生原生动物,可寄生90多种蝗虫(张龙和严毓骅,2008)。感染蝗虫微孢子虫初期的蝗虫无明显症状,后期虫体呈米黄色、节间膜伸长,腹部变软,飞翔能力、活动能力均下降,发育期延长,生殖能力减弱,取食量减少,直至死亡(Erlandsonetal., 1985)。孢子进入蝗虫消化道后,孢子壁的通透性发生变化,孢子内压升高,使极丝解螺旋后从孢子中弹出,然后刺入寄主肠道,进入靶组织后进行无性裂殖繁殖(Langeetal., 1992)。孢子壁内新发现的AlocSWP2蛋白可能与蝗虫微孢子虫进入靶组织后的无性繁殖有关(Chenetal., 2017)。脂肪体是其主要的靶组织,在有些蝗虫寄主的后肠、生殖腺、神经组织、围心细胞、胃盲囊上皮细胞、唾腺组织中也检测到了病原物(Erlandsonetal., 1986)。
蝗虫微孢子虫由英国科学家Canning于1953年首次命名。之后美国昆虫病理学家Henry等人系统研究了该病原对兔子、老鼠、豚鼠、兰鳃翻车鱼、红鳟鱼、蜜蜂等动物的安全性,结果表明,其对脊椎动物及其他有益生物是安全的(Canning, 1953; Henry, 1971),最终于20世纪80年代初成为第一个登记注册的原生动物生物防治农药,并在美国大规模商品化生产用于蝗虫的防治(Bidochka & Khachatourians, 1991)。1986年中国农业大学害虫生防实验室从美国引进了蝗虫微孢子虫浓缩液,并成功筛选出东亚飞蝗作为繁殖体进行大规模生产,在20世纪90年代,每头蝗虫平均产孢量已达到美国商品化产孢量的2~3倍。课题组还通过开展田间试验,研制出了适合我国高原典型草原、干旱及半干旱草原等不同草原蝗区和沿海蝗区、滨湖蝗区、河泛蝗区、稀树草原蝗区等不同农区蝗区中蝗虫微孢子虫的应用技术体系,并取得了良好的效果(张龙和严毓骅,2008)。
蝗虫微孢子虫虽然寄主多、分布广,但其在自然界中的流行水平并不高。20世纪80年代对美国西部地区蝗虫微孢子虫流行病的调查结果显示,蝗虫的感染率不到1%,但在植被保护较好的蝗区存在流行病区(Henryetal., 1985)。在蝗虫发生区喷施蝗虫微孢子虫后,感染率在一年当中一般出现2次高峰,且第一次感染率峰值往往小于第二次。该结果表明,喷施的病原可以在寄主种群中自然流行而成为蝗虫种群密度的调控因素(张龙,1994)。蝗虫微孢子虫疾病主要有两种传播方式,一是经卵垂直传播,二是通过取食感染了孢子的粪便或残食染病同伴进行的水平传播。张龙等人在内蒙、新疆等地用蝗虫微孢子虫防治草原蝗虫的药效试验结果显示,喷施一个月后,蝗虫校正死亡率可达50%,存活的个体中也有30%~40%被感染,且6~8年后,在施药区调查发现,微孢子虫病仍在流行(张龙,1999)。阿根廷昆虫病理学家也证实了能在施用微孢子虫11年后蝗虫发生区的蝗虫体内检测到大量孢子(Lange & Azzaro, 2008)。一旦疾病流行形成规模就可在多年内将蝗虫种群密度压低在防治阈值之内,无需频繁防治。
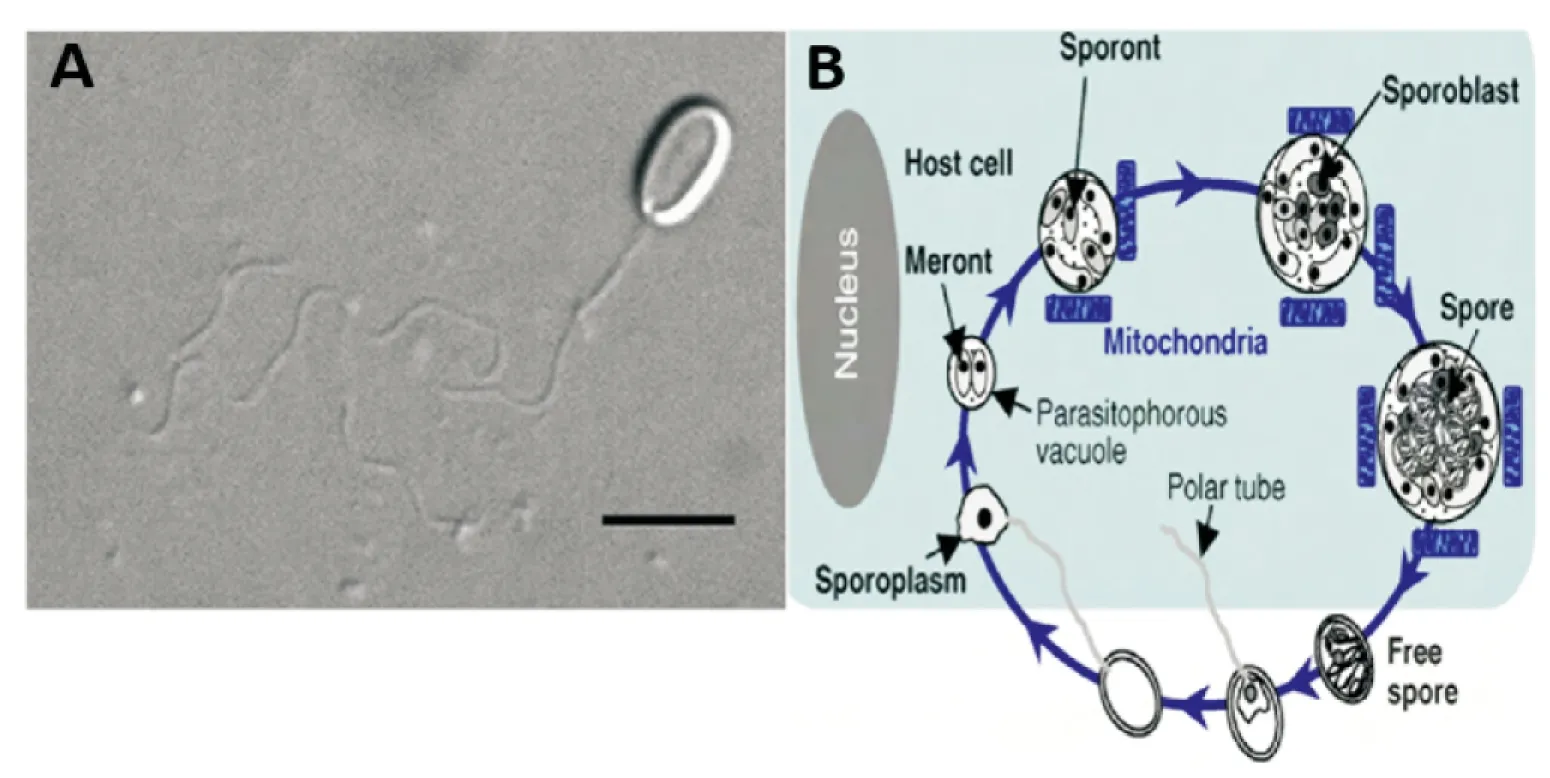
图1 微孢子虫孢子萌发及生活史(Corradi & Keeling, 2009; Texier et al., 2010)Fig.1 Germinating and life history of Nosema locustae注:A,蝗虫微孢子虫孢子及其萌发的极管;B,微孢子虫的生活史。Note: A, spore of N. locustae and its germinating tube; B, life history of N. locustae.
3 蝗噬虫霉Entomophaga grylli
蝗噬虫霉隶属接合菌纲,虫霉目,虫霉科,虫霉属,在非洲、亚洲、南美洲、北美洲及澳大利亚的蝗区均存在蝗噬虫霉流行病(Black, 1895; Milner, 1968; Roffey, 1968)。蝗噬虫霉的主要孢子类型的形成或缺失、孢子内细胞核的大小和数量、同工酶的特征、寄主及其分布范围等特征都是对其分类、鉴定的指标(Wang, 1994)。已知所有的蝗噬虫霉都是蝗虫的专性致病菌,对其他昆虫的致病性未曾报道过。感染后期的蝗虫有用两只前足抱握植物茎的习性,并且死后一直呈抱握状态。蝗噬虫霉在抑制蝗虫种群数量方面起着非常重要的作用,例如,蝗噬虫霉病的流行曾为北美、亚洲、澳大利亚以及非洲蝗区的农民挽回数百万美元的经济损失(Nelsonetal., 1982; Erlandsonetal., 1988)。对蝗噬虫霉在新疆阿勒泰地区蝗虫种群内的流行规律进行了连续两年的调查发现,意大利蝗Calliptamusitalicus、西伯利亚蝗Gomphocerussibiricus、肿脉蝗Stauroderusscalaris以及一种雏蝗属蝗虫均受到蝗噬虫霉感染,其中肿脉蝗以及雏蝗属蝗虫感染蝗噬虫霉尚属首次报道。蝗噬虫霉是该区域蝗虫种群密度的一个重要控制因子(Zhangetal., 2018)。
蝗噬虫霉的生命周期可分为寄生阶段和脱离寄主后的自由生存阶段。在气温较低的冬季,蝗噬虫霉以休眠孢子的形式生存于土壤中,气候变暖后,部分孢子开始萌发而长出生殖孢子(Carruthersetal., 1997),生殖孢子可从土壤中弹射出来而粘附到寄主体表上,环境条件适宜时即可长出芽管,然后借助酶的催化作用以及机械作用穿透寄主昆虫体壁,进入寄主体内后,细胞壁逐渐消失的孢子又变为原生质体,之后开始快速繁殖(Funketal., 1993),到了后期,原生质体又开始形成细胞壁而变为菌丝体,菌丝体又生出分生孢子或者休眠孢子(Funketal., 1990)。在感染初期,寄主并无明显的病症,而在死亡前的1~2 d,病症开始显现出来,具体表现为行动迟缓、拒食以及出现一些反常的行为或姿态,例如抱握在植物茎上(Shangetal., 2015)。在植物茎上呈抱握状态的蝗虫尸体在长时间的风蚀作用下破裂,体内的分生孢子和休眠孢子又扩散到环境中。
致病型I和致病型II是目前研究最多的两类蝗噬虫霉。感染致病型I蝗噬虫霉的蝗虫,1周后即会死亡,致病型II的致死时间稍长一些(Carruthersetal., 1988; Ramoskaetal., 1988; Carruthersetal., 1992)。致病型II蝗噬虫霉侵入虫体后只产生休眠孢子,待蝗虫尸体破裂后释放出落入土壤中,环境条件适宜时开始新的侵染循环(Sawyeretal., 1997)。致病型I蝗噬虫霉侵入虫体后既产生休眠孢子,又产生气生孢子,其中休眠孢子生命循环与致病型II相似,而气生孢子释放出来可直接侵染其他寄主而引起疾病流行(Nelsonetal., 1982)。致病型I产生休眠孢子与气生孢子的比例与寄主龄期和温度有关,温度越高,龄期越大,产生休眠孢子的比例就越大。在被感染蝗虫体内同时检测出休眠孢子和气生孢子的现象很普遍,尤其在染病的5龄蝗蝻或者刚羽化的成虫体内(Carruthersetal., 1988)。如果外界环境条件适宜,虫体中的气生孢子在寄主死亡后数小时内即可在寄主节间膜等薄弱部位形成菌幕层,并又产生大量气生分生孢子,最终扩散到环境中,粘附到寄主体壁上的气生孢子产生牙管,开始新的侵染循环。而落在其他底物上的气生孢子,萌发后产生第二代或第三代气生孢子,待接触到寄主后再次侵染。1头死亡寄主所产生的气生孢子与其自身生物量以及环境条件有关,一般可产生数百万个孢子。若外界环境条件不适宜,气生孢子可通过自身脱水以提高抵御不良环境的能力,待环境条件好转后,脱过水的孢子在数小时内即可萌发。Carruthers等人的研究结果表明,从死亡蝗虫Camnulapellucida扩散出的致病型I蝗噬虫霉的气生孢子在不良环境下最长生存天数为26 d,平均生存天数为6 d,再萌发开始新的侵染的次数最多达13次,平均次数为3.5次(Chapman & Page, 1979; Carruthersetal., 1997)。蝗噬虫霉完成一个生命周期后,若环境条件适宜,并且寄主仍在发生,即可继续流行,且种群密度越高,流行程度越高。可见,蝗噬虫霉病的流行与环境条件以及寄主的发生情况密切相关。由于致病型II蝗噬虫霉在寄主体内只产生休眠孢子,因此该病原在一年当中多数只有一个生命周期,对蝗虫的控制作用较弱,而致病型I循环次数多,对蝗虫控制作用明显,在蝗噬虫霉病流行区检测到的多数也为致病型I蝗噬虫霉(Carruthers & Onsager, 1993)。

图2 感染蝗噬虫霉的蝗虫及虫体内蝗噬虫霉的孢子(Zhang et al., 2018)Fig.2 Species of grasshoppers infected by Entomophaga grylli and spores of E. grylli in infected grasshoppers注:A-D,由蝗噬虫霉感染致死的意大利蝗,肿脉蝗,一种雏蝗属蝗虫和西伯利亚蝗抱握在植物茎上;E,感染蝗噬虫霉致死的蝗虫经保湿培养后菌丝从体壁长出;F,2个休眠孢子及细胞壁;G,孢子萌发长出芽管;H,梨形的分生孢子。图F、G、H中的比例尺代表长度分别为50 μm、20 μm、15 μm。Note: A-D, E. grylli-infected Calliptamus italicus, Stauroderus scalaris, Chorthippus sp. and Gomphocerus sibiricus; E, E. grylli-infected grasshopper after water-saturation incubation; F, Two resting spores with thick cell wall; G, a conidium seated on top of conidiophore; H, pear-shaped conidium; scale bar of F = 50 μm; scale bars of G = 20 μm; scale bar of H = 15 μm.
一种病原在寄主发生区的流行程度主要与病原的特性、寄主的特性以及环境条件有关。病原的特性主要包括病原的毒力、致病力、扩散能力、抗性等。蝗噬虫霉致病力强于绿僵菌、白僵菌、痘病毒等,并且生活周期短(Carruthersetal., 1997)。孢子扩散主要包括在寄主外自身扩散和在寄主体内随寄主扩散,后者主要与寄主的生物学特性有关,比如染病飞蝗可将病原扩散到更远的地方(Carruthersetal., 1997)。蝗噬虫霉孢子自身扩散能力较弱。孢子陷阱实验结果显示,在致病型I蝗噬虫霉流行区的周边地区能捕获到的孢子数量很少,甚至捕获不到,这可能与孢子的体积和密度有关,因为同样的实验,却能捕获到更多直径较小,密度较大的其他虫霉科孢子(Carruthersetal., 1997)。土壤中蝗噬虫霉的休眠孢子扩散能力更弱,只能借助寄主及其他动物被动扩散,该领域的研究至今仍是空白。蝗噬虫霉气生分生孢子的抗逆性很弱。虽然孢子可通过自身脱水抵御不良环境,但平均抵御时间只有6 d,而未脱水的孢子在正常日光下只能存活几个小时,在避光环境下存活时间也不长,高温、低湿及强太阳辐射能很快将其杀死。此外,孢子的萌发以及对寄主的侵染对环境条件要求也很高(Bidochkaetal., 1995)。Firstencel等人的研究结果显示,当感染致病型I蝗噬虫霉的蝗虫死亡时间发生在中午时,将会增加次生感染的潜力,因为新生孢子的产生将发生在晚上,避开了不良环境条件而增加了其致病力(Firstenceletal., 1990)。该实验表明致病型I蝗噬虫霉孢子的抗逆性弱。
与疾病流行有关的寄主特性主要包括对病原的敏感性、行为特征、种群密度及空间分布等。同种蝗虫对不同虫霉的敏感性不同,而同种蝗噬虫霉对不同蝗虫的致病性也不一样。蝗虫的行为特征对疾病流行有重要影响,例如,蝗虫通过增加栖息在太阳光下的时间使体温升高而抑制蝗噬虫霉孢子的萌发(Lomeretal., 2001)。飞蝗通过迁飞而逃离疾病流行地区而免受侵染,迁飞也能将孢子带到其他地区而扩大疾病流行范围(Tillotson & Margolies, 1990)。蝗虫还有飞离取食区另寻产卵区的习性,大量蝗虫聚集在一起产卵加快了疾病的流行。蝗虫的种群密度对蝗噬虫霉病的流行影响较大,种群密度越高,流行程度就越高,随之蝗虫的发生受到控制后,种群密度又开始下降,可见,二者处于一个动态的平衡中(Carruthersetal., 1997)。对蝗噬虫霉在新疆阿勒泰地区蝗虫种群内的流行规律调查的试验结果也证实了此现象(Zhangetal., 2018)。
对于某些虫霉孢子,将其注射到蝗虫血淋巴后,蝗虫可染病,而通过体表接种,却不能致病。是否与虫霉菌对寄主的识别有关,还是与对昆虫体壁的穿透能力有关尚不清楚(Valovageetal., 1984)。由于蝗噬虫霉转化性很强,至今还没有研制出离体人工大量培养的方法。利用蝗噬虫霉进行蝗虫防治较为可行办法是从蝗虫发生区捕捉蝗虫,注射蝗噬虫霉孢子后再将其释放到发生区。在墨西哥的一项研究显示,向蝗虫发生区释放了400头注射有蝗噬虫霉孢子的蝗虫两年后流行水平达到40%,蝗虫种群密度明显下降(Ramoskaetal., 1988; Lockwood, 1993)。
4 绿僵菌Metarhizium
与其他半知菌一样,绿僵菌的生活周期也比较简单,是否存在有性阶段也是未知的,分生孢子是其唯一能够产生的孢子类型。绿僵菌侵染蝗虫时,其分生孢子粘附到蝗虫体表后首先生成一个附着胞,由附着胞再产生一个侵入钉,之后侵入钉通过机械作用及相关酶的催化作用侵入到蝗虫体内,侵入到虫体的菌丝继续生长,并产生类似酵母细胞的芽生孢子,而芽生孢子一般游离漂浮在血淋巴中,部分芽生孢子还能产生毒素。如果外界环境湿度适宜,虫体内的菌丝从其较薄弱的部位长出体外而产生气生分生孢子,而如果湿度条件不适宜,气生生长阶段直接在逐渐被侵蚀变空的虫体内完成,待虫体破裂后,分生孢子扩散出来,开始下一个侵染循坏,该机制有利于保护绿僵菌分生孢子免受紫外线、高温等外界不利环境条件的影响(Lomeretal., 2001)。
土壤中生活着多种绿僵菌,但高毒力菌株并不多。分离自死虫体内的菌株致病力一般较土壤中的高,且对于某种寄主害虫,分离自其同种害虫体内的菌株的致病力最高,例如,M.flavovirideIMI 330189是分离自蝗虫,且已商品化生产用于蝗虫防治的一个菌株,该菌株对蝗虫的致病力很强,而对白蚁、金龟子幼虫、蚂蚁、象鼻虫、欧洲蜜蜂等昆虫的致病力却非常弱。此外,M.flavovirideIMI 330189对不同种类蝗虫的致病力也是不同的,Bateman等人的生测结果显示,该菌株对蝗虫H.daganensis的致病力没有对蝗虫Z.variegatus的高(Batemanetal., 1996)。
关于绿僵菌的致病机理,包括分子机制已有细致深入的研究。绿僵菌生长代谢产生的毒素在蝗虫感染致死的过程中起着重要的作用。绿僵菌素(dtxs)就是其中一类毒素。dtxs可以抑制昆虫的细胞和体液免疫反应,从而促进绿僵菌在昆虫体内繁殖。Wang等人报道了绿僵菌dtxs的生物合成机制:首先由非核糖体肽合成酶DtxS1合成dtx B及其类似物,然后细胞色素P450酶DtxS2通过一系列反应将dtx B转化为其他dtxs,在此过程中,醛酮还原酶DtxS3和天冬氨酸脱羧酶DtxS4分别负责转换和提供dtx装配线的第一个和最后一个底物。绿僵菌产毒的能力取决于dtxS1基因的存在,对dtxS基因的改造有望开发出高毒力的菌株(Wangetal., 2012)。非核糖体肽合成酶、细胞色素P450酶等在昆虫感染致死过程中发挥着重要作用。Wang等人通过比较分析广谱性绿僵菌Metarhiziumanisopliae和蝗虫特异性绿僵菌Metarhiziumacridum的基因组序列发现,广谱性绿僵菌进化出了更加广泛的基因家族,包括蛋白酶基因、细胞色素P450s基因、聚酮肽合成酶基因和非核糖体肽合成酶基因等用于毒素合成的基因,这可能有助于其适应异质多样的环境(Wang & Wang, 2012)。
除dtxs外,Tong等人发现绿僵菌在侵染过程中所产生的色氨酸也是一种致死物质。在通过基因工程技术除去dtxs后,蝗虫特异性真菌Metarhiziumacridum(MAC)杀死蝗虫的速度依然快于普通真菌Metarhiziumrobertsii(MAA)。通过比较转录组和代谢物分析蝗虫对MAA和MAC感染的反应差异性发现,与MAA感染相比,MAC感染后的蝗虫体内解毒和色氨酸分解代谢途径出现明显的富集现象,显示高浓度的色氨酸导致蝗虫死亡。进一步研究发现,单胺氧化酶基因MrMao-1参与了色氨酸的分解代谢,沉默MrMao-1可以增强MAA对蝗虫的毒力(Tongetal., 2020)。病原真菌抑制宿主免疫反应是导致宿主死亡的一个典型机制,宿主血细胞可以识别并攻击入侵的绿僵菌孢子。有趣的是,Wang等人发现,在菌丝体生长过程中宿主细胞丧失了对孢子的识别能力。进一步研究发现,这一过程取决于基因Mcl1,如果将Mcl1沉默,病原体很快受到血淋巴的攻击。Mcl1在病原与血淋巴接触后的20 min内即可表达。Mcl1所表达的MCL1蛋白作为一个抗黏着保护层覆盖住孢子表面抗原而使宿主血细胞抗体无法识别。这些研究为通过删除一个基因而不是引入任何外源基因来改良真菌杀虫剂提供了一种较为可行的方法(Wang & St Leger, 2006)。
虽然绿僵菌被广泛用于蝗虫的生物防治,但其在蝗虫发生地的自然流行水平并不高,Shah等人在非洲贝宁北部冲击平原地区连续监测了6年后,发现绿僵菌的流行水平只有2%~6%(Shahetal., 1994),这可能与蝗虫多生活在不利于绿僵菌发生流行的干燥环境中有关。为了适应干燥的环境,绿僵菌的孢子能一直在死亡虫体内存活,待气候条件变得适宜后继续流行。理论上认为,在蝗虫种群中流行水平不高的致病菌往往致病力却很高,绿僵菌正符合这一特征(Hochberg, 1989)。一般认为,高种群密度可诱导预防性免疫以降低感染的风险,然而对于种群密度非常高的群居型蝗虫却是例外。Wang等人研究发现,散居型蝗虫在抵抗绿僵菌M.anisopliae感染方面的基因数量至少是群居型的2倍,显示高种群密度的群居型蝗虫感染绿僵菌的风险更高(Wangetal., 2013)。感染绿僵菌死亡蝗虫尸体多见于产卵地附近,Lomer等人在非洲贝宁调查绿僵菌的流行情况时,在蝗虫产卵地发现了大量的死虫,密度达20头/m2,这个数字可能比实际情况高,因为观察期间正值蝗虫到产卵地产卵,当然,也有可能染病蝗虫已经死亡未能迁移到产卵地,或者产卵地活着的蝗虫在产卵后可能也会死亡等情况导致数据偏低(Lomeretal., 1997)。与蝗噬虫霉流行病相比,绿僵菌流行病在蝗虫发生区较弱,这可能与二者病原传播方式不同有关。因为,感染蝗噬虫霉的蝗虫在即将死亡时有抱握植物茎的习性,并且死亡后一直呈抱握状态,之后虫体因风蚀作用破裂,孢子扩散出传播给周围其他蝗虫(Carruthersetal., 1997; Sawyeretal., 1997),而感染绿僵菌的蝗虫死亡后一般落到地面上,孢子的传播能力可能没有处于相对位置较高的蝗噬虫霉强(Chapman & Page, 1979)。
绿僵菌农药主要有油剂、水剂和饵剂3种剂型,其中油剂是主要剂型。一是因为油剂有利于孢子粘附到寄主体表上,二是因为蝗虫多发生在比较干旱的地区,有的甚至在沙漠,水资源比较缺乏,不适宜使用水剂和饵剂,而油剂对湿度要求相对较低,成本较高是油剂的不足之处,因为该剂型所用溶剂是价格较高的矿物油或植物油(Lomeretal., 2001)。成本较低的水剂适合防治东亚飞蝗等发生在湿润凉爽环境中的蝗虫。饵剂在产卵区等蝗虫发生比较密集的地区使用效果比较理想(Moore & Caudwell, 1997)。此外有报道称,绿僵菌孢子的粘附作用及随后的孢子萌发与蝗虫体表的脂肪酸含量有密切关系,但试图改变剂型中脂肪酸含量的实验并未获得成功(Barnes & Moore, 1997)。与剂型相配套的是农药的喷施技术,喷施技术对一种农药的大规模推广应用也具有决定性的作用。超低容量喷雾是目前较为先进的农药喷施技术,该技术要求孢子粒径大小统一,且尽可能少掺杂培养基颗粒,因为有粘性的培养基颗粒易将孢子粘附到一起而堵塞喷头。超低容量喷雾技术的最大弱点是在喷施时需要风来促使孢子向靶标区域飘散(Bateman, 1997)。
储存时间短是阻碍真菌杀虫剂商品化生产的另一限制因素。孢子的含水量直接影响到产品的储存时间(Hedgecocketal., 1995)。孢子含水量主要与干燥技术和收孢技术有关,干燥过度会降低孢子萌发率,而干燥不足孢子易提前萌发。收孢时须尽可能除去培养基颗粒,因为培养基颗粒吸收水分会影响孢子的含水量。借鉴植物种子的储藏技术,目前绿僵菌的储存时间可达4年之久,采用该技术,在绿僵菌农药包装上安装有环境指示灯,可实时监测温湿度,并能预测温湿度变化与储藏时间的关系,对严格控制储藏环境条件提供了有效的指导(Hongetal., 1999)。田间环境中的紫外线也是影响绿僵菌杀虫剂杀虫效果的主要障碍之一,该问题至今还未得到有效地解决(Shahetal., 1998)。
自然环境条件对真菌杀虫剂侵染体的影响很大,因此,在自然环境条件下开展药效试验来对杀虫效果进行评估具有重要作用,然而,蝗虫,尤其是飞蝗的栖息地不固定,加大了田间药效实验数据统计工作的难度,就此,有关专家尝试用各种办法来克服这一难题。常用方法有(Meinzingen, 2004):(1)每隔5~10 m设置面积约1 m2干净区域作实验区,在实验区放置食物、检测设备等,喷药前释放被钉住翅膀的蝗虫,喷完后将蝗虫捉回放在田间的笼中饲养、观察;(2)在实验区放置大型笼子罩住一定数量的试虫进行试验;(3)在干旱季节对实验区玉米田充分灌溉,使其生长情况明显优于周边玉米,之后将接种过绿僵菌的试虫释放到实验区玉米田中,该方法的不足之处是试虫经常被天敌吃掉而造成一定的误差;(4)在绿僵菌药剂中掺入荧光物质来区分对逃出或迁入实验区的蝗虫,同时在实验区边界处喷施驱避剂印楝油以减少蝗虫的进出,该实验方法能够保证完全在自然环境条件下开展,但成本较高。

图3 感染白僵菌和绿僵菌的蝗虫(Butt et al., 2001)Fig.3 Locust infected with Metarhizium spp. and Beauveria spp.注:A,蝗虫被白僵菌感染致死后,从体表长出白色菌丝;B,感染绿僵菌的蝗虫在死亡前体色变为深红色;C,蝗虫被绿僵菌感染致死后,从体表长出绿色菌丝。Note: A, dead locust infected with Beauveria spp. showing white hyphal growth; B, locust infected with Metarhizium spp. changed into deep red before death; C, dead locust infected with Metarhizium spp. showing green hyphal growth.
5 白僵菌Beauveria
白僵菌是蝗虫最普遍的病原(Carruthersetal., 1997)。早在20世纪30年代,Jaronski等人观察到白僵菌在南非蝗虫种群中大面积流行,并预测白僵菌具有防治蝗虫的潜力。1995年,美国Mycotech公司登记注册了第一个防治蝗虫的白僵菌产品(Mycocide GHA)(Jaronski & Goettel, 1997)。白僵菌对蝗蝻和成虫都具有致病力,实验室条件下,5~20 d内可将试虫感染致死,并且生测实验室隔壁房间内的部分蝗虫也因感染污染的白僵菌孢子而死亡(Delgadoetal., 1997)。虽然湿度是昆虫致病真菌侵染寄主的关键条件,但白僵菌侵染某些昆虫,包括蝗虫时,对湿度的要求并不高(Marcandier & Khachatourians, 1987)。白僵菌侵染蝗虫的过程与绿僵菌大致相同,侵入寄主体内后也产生芽生孢子和营养菌丝。寄主死亡后,体内的菌丝在高湿度的环境下长出体外,产生分生孢子,整个虫体像覆盖了一层白色粉末。白僵菌在寄主上生长时产生的次生代谢产物能够抑制其他腐生菌的生长,从而更好地完成自身的侵染循环(Jaronski & Goettel, 1997)。白僵菌具有非常广泛的寄主谱,但不同基因型菌株对不同昆虫的致病性却大不相同,例如Mycotech公司白僵菌产品GHA对蝗虫M.sanguinipes具有很高的致病力,但对其他很多昆虫却没有致病力或者致病力很弱(Goettel & Jaronski, 1997)。
油剂、水剂和粉剂是白僵菌的3种主要剂型,其中油剂对蝗虫致病力最高,这可能与油剂中的白僵菌孢子与蝗虫体壁的粘附力更高有关。自然环境条件对白僵菌药效的稳定性有显著影响(Mason & Erlandson, 1994),Schaefer等人在蝗虫发生地用笼子罩住一块实验区进行药效试验的结果表明,白僵菌的药效很明显,但当在一个发生蝗灾的山谷里进行药效试验时却没有观察到染病的试虫(Jaronski & Goettel, 1997)。Lobo-Lima的田间药效试验显示白僵菌对蝗虫的杀虫效果并不明显,施药后收集到笼中饲养的试虫的死亡率仅为30%,且田间种群密度未下降,而用同样的白僵菌在实验室进行的生测实验却显示出较高的致病力(Lobo-Limaetal., 1992; Inglisetal., 1997)。Valverde-Garcia等人研究表明,感染白僵菌的蝗虫的繁殖力显著降低,雌性蝗虫的卵荚数以及可育卵数均减少(Valverde-Garciaetal., 2018)。自然环境中的紫外线、高温等不利因素是影响药效稳定性的主要原因。此外,蝗虫可以通过调节体温抵制白僵菌的侵染,例如感染白僵菌的蝗虫M.sanguinipes喜好栖息在太阳光较强的地方,导致体温比外界温度高达18℃,并且连续在太阳光下的时间超过4 h(Kemp, 1986; Sangbaramou, 2018),而对于白僵菌杀虫剂产品GHA,36℃下连续放置4 h即可达到孢子萌发和菌丝生长的上限。
白僵菌油剂与亚致死剂量的灭幼脲复配使用后,无论从死亡率还是从杀虫时间上,都比单使用白僵菌的效果好,这可能与灭幼脲通过抑制昆虫表皮合成而促进孢子穿透表皮有关(Hassan & Charnley, 1989)。Foster等人将白僵菌油剂与10%灭幼脲复配进行田间药效试验的结果显示,复配灭幼脲后的杀虫效果明显得到提高(Fosteretal., 1996)。
白僵菌孢子落到不同植物表面后的存活时间是不同的,该现象表明,叶片表面特性对白僵菌孢子的活性有一定的影响(Daoust & Pereirn, 1986)。此外,落在同种植物叶片的上表面和下表面上的存活时间也是不同的,这可能与自然界中的紫外线有关。白僵菌广泛存在于土壤中,但不清楚这些菌株是腐生菌还是污染的杂菌(Shahetal., 1997)。土壤中的生物及非生物因素对白僵菌的存活有直接的影响,尤其是微生物种群对白僵菌具有不利的影响,能够抑制白僵菌的生长。Lingg等人的实验结果表明,若土壤中的湿度及营养条件合适,白僵菌可在无菌土壤中大量且快速繁殖(Lingg & Donaldson, 1981)。土壤中的各种因素与白僵菌降解之间的关系较难预测,似乎油剂中的白僵菌在土壤中的抗性更强一些。白僵菌在土壤中普遍存在以及蝗虫在土壤中产卵的习性使得可以在蝗虫产卵地的土壤中施药。Inglis等人的研究结果表明,在蝗虫M.sanguinipes的产卵地施白僵菌后,不仅大量成虫染病死亡,而且很多孵化出的蝗蝻也都染病死亡(Inglisetal., 1997)。
6 米曲霉Aspergillus oryzae XJ-1
中国农业大学张龙课题组从采自新疆的一头死亡蝗虫上分离到一株可能对东亚飞蝗具有致病力的真菌,经科赫氏法则验证,证实该真菌是东亚飞蝗的一个病原。分子生物学与形态学的鉴定结果显示,该病原是一株米曲霉,命名为AspergillusoryzaeXJ-1。米曲霉的昆虫致病性从未报道过,所发现的A.oryzaeXJ-1是东亚飞蝗的一个新病原(Zhangetal., 2015)。
A.oryzaeXJ-1对东亚飞蝗的毒力较高。用A.oryzaeXJ-1对东亚飞蝗进行生物测定的结果表明,在接种第10、13和15天时的致死中浓度(LC50)分别为3.31×108、1.72×107和7.24×106个孢子/mL。采用酶联免疫技术对A.oryzaeXJ-1代谢产物中致癌物黄曲霉毒素B1的检测结果表明,A.oryzaeXJ-1不产生黄曲霉毒素B1。米曲霉在食品发酵领域已有2000多年的应用历史,对人类是安全的,据此初步推测A.oryzaeXJ-1对人类可能也是安全的。当然,A.oryzaeXJ-1作为米曲霉的一个菌株,可能存在一定的个体差异,其安全性需进一步评价。用廉价易获取的原料做培养基进行固体发酵实验的结果显示,A.oryzaeXJ-1发酵6 d后,产孢量数量级可达109个孢子/克干培养基,与已商品化了的绿僵菌和白僵菌相当。此外,米曲霉固体发酵数千年的历史也为米曲霉真菌杀虫剂的规模化生产奠定了坚实的基础。A.oryzaeXJ-1的最适生长温度为35℃,在40℃时也能够很好的生长,而白僵菌和绿僵菌的最适生长温度范围为25~30℃,由此可见,米曲霉的耐热性比白僵菌和绿僵菌强。较强的耐热性有利于在田间应用时抵御高温的不良影响。此外,蝗虫体温在一天当中的某几个时段出现升高现象,升高后的体温一般超出了白僵菌和绿僵菌生长温度的上限而使药效降低,而对于耐热性较强的米曲霉可能在这方面具有一定的优势。孢子较强的耐热性还有利于降低高温干燥工艺的难度。干燥工艺是真菌杀虫剂生产中的一个重要且难度较大的技术环节,干燥不足,孢子易提前萌发,使储藏期缩短,而干燥过度会降低孢子萌发率,使药效减弱(Zhang, 2015)。
毒力、安全性、产孢量、耐热性、储藏期以及对田间不良环境的抗性是评价一种昆虫致病真菌是否具有开发为生防制剂潜力的关键指标。该新病原在毒力、对人类的安全性、产孢量、耐热性等方面均符合开发标准,推测其在蝗灾治理中可能具有较大的应用潜力。该新病原的储藏期、对靶标生物的安全性等指标还有待于进一步评价。

图4 Aspergillus sp. XJ-1对东亚飞蝗的致病性(Zhang et al., 2015)Fig.4 Pathogenicity of Aspergillus sp. XJ-1 against Locusta migratoria注:A-B,接种Aspergillus sp. XJ-1后死亡的蝗蝻在湿润无菌培养皿中培养2 d(A)和1周(B)后,长出的菌物从白色变为暗黄色;C,另一头接种Aspergillus sp. XJ-1后死亡的蝗蝻在湿润无菌培养皿中培养4 d后长出了暗黄色菌物;D,一头接种Aspergillus sp. XJ-1后死亡的成虫在湿润无菌培养皿中培养了3 d后,长出的菌物从白色变为黄色。Note: A and B, the same dead nymph placed in moist petri dish for 2 days (A) and 1 week (B) after death showing hyphal growth and sporulation of the fungus and the changes in fungal colors; C, another dead nymph incubated in moist petri dish for 4 days after death showing the sporulation of fungus; D, a dead adult incubated in moist petri dish for 3 days after death showing hyphal growth, sporulation of the fungus and the changes in fungal colors.
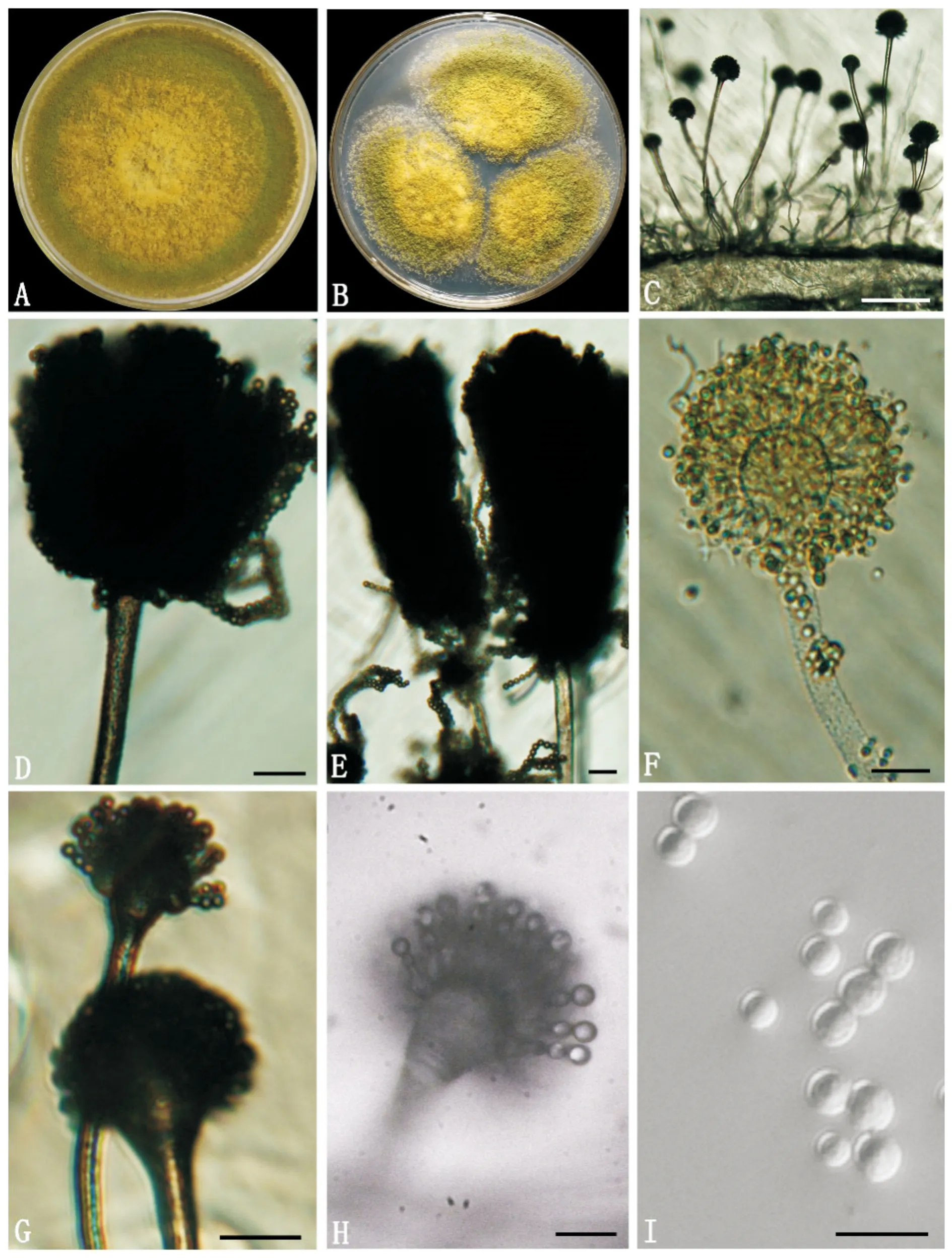
图5 Aspergillus sp. XJ-1的形态学特征(Zhang et al., 2015)Fig.5 Morphology of Aspergillus sp. XJ-1注:A,25℃下,Aspergillus sp. XJ-1菌落在察氏培养基上生长了30 d后呈现出深黄至橄榄绿色;B,25℃下,Aspergillus sp. XJ-1菌落在察氏培养基上生长10 d后呈现出淡黄至橄榄绿色;C,气生菌丝直接从察氏培养基上长出;D-F,不同形状的分生孢子头和烧瓶形的顶囊;G-H,产孢结构中未观察到梗基;I,光滑的分生孢子外壁;C-D和F-G的比例尺代表20 μm;E及H-I的标尺代表10 μm。Note: Aspergillus sp. XJ-1 grown on CA medium at 25°C for 3 days (C and G-H), 10 days (B, D-F and I) and 30 days (A), respectively; A and B, colonies with a dark yellow-green color; C, aerial hyphae directly grew out of CA medium; D-F, different types of conidial heads and flask-shape vesicle; G and H, Aspergillum without metula; I, conidia with a smooth outer wall. Scale bars of C-D and F-G=20 μm; scale bars of E and H-I=10 μm.
7 问题与展望
综上所述,目前已经发现了多种蝗虫病原微生物,而且部分种类已成功应用到蝗灾的治理中。作为一种有生命活力的杀虫活性物质,病原微生物在实际应用中也存在着不少缺陷,如药效缓慢、对田间恶劣环境的适应性差、储存期短等,严重限制了其在蝗灾治理中的应用。蝗虫病原微生物属环境友好型活性物质,并且容易在蝗虫种群中引起稳定的疾病流行而将种群密度长期控制在阈值水平之下,具有不可替代的优势。基因工程改良是解决病原微生物所存在的上述问题的一个非常不错的技术。现已通过改良内源性的蛋白酶Pr1基因及几丁质酶基因使绿僵菌的致病力得到显著提高(St Legeretal., 1996; Fanetal., 2007);通过高表达外源性的蝎子神经毒素肽(AaIT),使绿僵菌对烟草天蛾幼虫Manducasexta和埃及伊蚊Aedesaegypti的毒力分别提高了22倍和9倍(Wang & St Leger, 2007)。基因改良技术在解决病原真菌对环境适应性差的问题上也显示出巨大的潜力(Behleetal., 2009)。现已通过高表达酪氨酸酶或者光裂合酶使白僵菌的抗紫外线能力显著提高(Fang & St Leger, 2012; Shangetal., 2012)。由此可见,基因工程改良技术是今后的一个发展方向。此外,优良株系的广泛筛选、高效低成本的生产工艺、加工制剂的研发、延长储存时间以及与其它防治技术的协调应用等也将是今后利用蝗虫病原微生物治理蝗灾的发展趋势。
