产胞外多糖葡糖杆菌的分离鉴定及系统发育分析
2020-07-07裴芳艺马岩石陈雪
裴芳艺,马岩石,陈雪
(齐齐哈尔医学院 科研处,黑龙江 齐齐哈尔,161000)
微生物胞外多糖(exopolysaccharide,EPS)是细菌、真菌等生长代谢过程中分泌到细胞外的高分子量生物聚合物[1-2],可通过有机溶剂沉淀、超滤、喷雾干燥及冷冻干燥等方法获得[3],具有价格便宜、提取工艺简单和安全性高的优点[4-5]。微生物EPS具有抗肿瘤、增强免疫力、抗氧化、降低胆固醇等作用[6],可应用于医疗、制药、乳品和化妆品等领域,受到人们广泛关注[7]。DI等[8]发现干酪乳杆菌(Lactobacilluscasei)SB27 EPS具有显著的体外抗肿瘤活性,当0.6 g/L EPS作用HT-29人结肠癌细胞72 h时,对结肠癌细胞抑制率为(77.19±3.56)%。马文锦等[9]的研究显示,胶红酵母(Rhodotorulamucilaginosa)CICC 33013 EPS具有抗氧化活性功能,当EPS质量浓度为8 mg/mL时,DPPH自由基清除率、ABTS自由基清除率、还原力分别为49.1%、51.2%、0.352。
葡糖杆菌属(Gluconobactersp.)属于醋酸菌科(Acetobacteraceae)[10],包括白葡糖杆菌(G.albidus)、蜡状葡糖杆菌(G.cerinus)、啤酒葡糖杆菌(G.cerevisiae)、弗氏葡糖杆菌(G.frateurii)、日本葡糖杆菌(G.japonicuss)、北碧葡糖杆菌(G.kanchanaburiensis)、近藤葡糖杆菌(G.kondonii)等[11-12]。Gluconobactersp.广泛存在于环境中,对人和动物安全无致病性[13],主要应用于生化产品开发、酶学性质研究和快速检测3个方面[14]。郭丹钊等[15]研究发现,Gluconobactersp. JS-1所产的EPS由P1(阿拉伯糖、木糖、半乳糖)、P2(鼠李糖、甘露糖)构成,具有显著的抗氧化活性。JAKOB等[16]发现,G.frateuriiTMW 2.767、G.cerinusDSM 9533、清迈新朝井杆菌(Neoasaiachiangmaiensis)NBRC 101099和巴厘岛公崎杆菌(Kozakiabaliensis)DSM 14400的EPS产量较高,当培养基中加入80 g/L蔗糖时,EPS产量为6~12 g/L,经高效液相分析,分离得到的多糖以葡聚糖为主。HERMANN等[17]的研究显示菌株K.baliensisDSM 14 400和N.chiangmaiensisNBRC 101099以小麦、全麦等为基质的面团中发酵48 h,均可产生EPS,且EPS产量与起始蔗糖含量成正相关,最高可产生0.049 kg/kg EPS。
本试验以自然发酵的草莓汁为试验材料,利用MRS-S产糖培养基筛选出高产EPS的菌株,通过显微形态观察、菌落形态观察、生理生化鉴定以及16S rDNA技术对所获得菌种进行鉴定,并利用Neighbor-Joining法和Maximum-Parsimony法建立系统发育树,确定菌株同源性和种属水平。本研究不仅为EPS的生产提供菌种来源,也为今后利用Gluconobactersp.大规模生产EPS提供了理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
草莓:采摘自齐齐哈尔市周边某草莓采摘园。
供试菌株:CGMCC 1.565氧化葡糖杆菌(G.oxydans),购于中国普通微生物菌种保藏管理中心,用于生理生化检定的模式菌株。
1.1.2 实验试剂
葡萄糖、乳糖、半乳糖、麦芽糖、蔗糖、木糖、蜜二糖、纤维二糖、松三糖、核糖、棉子糖、鼠李糖、水杨苷、甘油、肌醇、木糖醇、甘露醇、山梨醇、七叶苷、马尿酸、硝酸盐、亚硝酸盐、赖氨酸脱羧酶、尿素酶,北京陆桥技术股份有限公司;海藻糖、菊糖、L-阿拉伯糖、D-阿拉伯糖、赤藓糖醇、核糖醇、3%过氧化氢酶、淀粉、明胶、乙酰甲基甲醇(V-P)试剂、硫化氢、L-精氨酸,青岛高科技工业园海博生物技术有限公司;牛肉浸粉、酵母提取物、蛋白胨、琼脂粉,北京奥博星生物技术有限责任公司;葡萄糖、蔗糖、CH3COONa、K2HPO4、MnSO4、MgSO4·7H2O、柠檬酸铵、吐温(均为分析纯),天津市江天化工技术有限公司。
细菌基因组DNA提取试剂盒(DP302)、Agarose LE琼脂糖(RT101)、50×TAE Buffer(RT204)、GeneRed核酸染料(RT211)6×DNA电泳Loading(BufferRT201-01)、DL 15 000 DNA Marker(MD110-01)、DL 2 000 DNA Marker(MD114-01)、2×Taq PCR Mastermix(KT201-02),天根生化科技(北京)有限公司。
1.1.3 培养基
MRS培养基(g/L):葡萄糖20,牛肉浸粉10,酵母提取物5,蛋白胨10,CH3COONa 5,K2HPO42,MnSO40.25,MgSO4·7H2O 0.58,柠檬酸铵2,吐温1,121 ℃灭菌15 min,用于菌株培养。
MRS-S产糖培养基:在MRS培养基中加入100 g/L的蔗糖,用于产糖菌株的筛选。
MRS和MRS-S产糖固体培养基:在液体培养基内加入2%(质量分数)的琼脂粉。
1.1.4 仪器与设备
DHP-9162电热恒温培养箱、HZQ-211C落地振荡器,上海一恒科学仪器有限公司;CX31光学显微镜,日本奥林巴斯公司;FE28pH计、AL204电子天平,梅特勒-托利多集团;V-5000可见分光光度计,上海元析仪器有限公司;22331Hamburg高速离心机、5804R台式高速大容量冷冻离心机,德国艾本德公司;C1000-touch PCR仪、ChemiDoc MP全自动荧光和化学发光成像分析系统,美国伯乐公司。
1.2 实验方法
1.2.1 产糖菌株的初步分离筛选
将采摘的草莓捣碎,称量25.0 g放入225 mL无菌水内振荡混匀,30 ℃培养24 h,梯度稀释至10-7,每个梯度分别取0.1 mL涂布于MRS和MRS-S产糖固体培养基上,分别做2个平行样,30 ℃培养48 h,挑取单菌落,反复纯化3次,保存备用。
1.2.2 形态特征观察[18-20]
将菌株接种到MRS液体培养基中,30 ℃ 120 r/min培养24 h,观察该菌种生长情况。将活化后的菌株采用三区划线的方法,分别接种到MRS和MRS-S产糖平板上,30 ℃培养48 h,观察菌落的大小、颜色、表面形态、黏稠度、质地、边缘等特征。
取少量发酵液滴在载玻片上,均匀涂布,经革兰氏染色后显微镜下观察菌株形态。
1.2.3 高产EPS菌株的筛选
通过苯酚-硫酸法测定菌株发酵液中EPS的含量[21],筛选产EPS量较高的菌株。取发酵液1.5 mL,离心,上清用去离子水适当稀释,取1 mL稀释液与1 mL体积分数为6%的苯酚溶液和5 mL浓H2SO4溶液混匀,静置冷却至室温,于波长490 nm处测定吸光度值。根据标准曲线计算菌株发酵产EPS的含量,葡萄糖标准曲线的配制参照李晶晶的方法[22]。
1.2.4 生理生化特征鉴定[18-20]
按照试剂盒说明书要求,制备菌悬液,接种生化试剂管,30 ℃培养24 h后观察。碳源主要包括葡萄糖、乳糖、半乳糖、麦芽糖、蔗糖、木糖、蜜二糖、纤维二糖、松三糖、核糖、棉子糖、鼠李糖、海藻糖、菊糖、L-阿拉伯糖、D-阿拉伯糖、水杨苷、甘油、肌醇、木糖醇、甘露醇、山梨醇、赤藓糖醇、核糖醇、七叶苷、马尿酸、淀粉。氮源主要包括硝酸盐,亚硝酸盐和赖氨酸脱羧酶、L-精氨酸。其他生化试验主要包括3%过氧化氢酶试验、葡萄糖产气试验、明胶液化试验、乙酰甲基甲醇(V-P)试验、硫化氢试验、尿素酶试验。
1.2.5 16S rDNA序列分析及构建系统发育树
细菌基因组DNA提取:取活化的种子液1.5 mL,10 000 r/min离心1 min,收集沉淀。按照细菌基因组DNA提取试剂盒说明书,提取基因组DNA。以27F:5′-AGAGTTTGATCMTGGCTCAG-3′;1 492R:5′-GGTTACCTTGTTACGACTT-3′为引物进行16S rDNA部分序列扩增。PCR扩增体系为25 μL 2×Taq PCR Mastermix;2 μL 模板DNA;1 μL 27F引物;1 μL 1 492 R引物;21 μL ddH2O。PCR扩增条件为95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃再延伸10 min。PCR产物经凝胶验证后,送上海生工生物公司测序。测序结果上传NCBI数据库,获得GeneBank登录号。在NCBI数据库中利用BLAST进行序列比对,选择相似度高的菌株,利用MEGA 5.0中Neighbor-Joining法[23]和Maximum-Parsimony法建立系统发育树,确定菌株同源性和种属水平。
1.3 数据统计分析
系统发育树构建使用MEGA 5.0,绘图使用Excel 2016,统计分析使用SPSS 19.0。
2 结果与分析
2.1 试验菌株的筛选[24]
通过苯酚-硫酸法标准曲线的绘制,得到葡萄糖标准曲线方程为:y=9.855x+0.009,R2=0.999。
通过观察菌株在MRS-S平板上菌落形态,发现11株菌表面呈现黏稠状,利用苯酚-硫酸法测定11株菌的EPS含量,发现其EPS产量分别为(9.13±0.61)g/L(PFY-T2)、(7.31±0.73)g/L(PFY-T3)、(4.53±0.31)g/L(PFY-T6)、(16.71±0.51)g/L(PFY-T8)、(19.41±0.71)g/L(PFY-1)、(17.11±0.82)g/L(PFY-3)、(18.26±0.73)g/L(PFY-4)、(22.93±0.61)g/L(PFY-7)、(23.81±0.51)g/L(PFY-8)、(15.83±0.54)g/L(PFY-P1)、(15.29±0.96)g/L(PFY-P6)。其中菌株PFY-7、PFY-8的产糖能力相对较高,因此,对这2菌株进行下一步鉴定。
2.2 菌株形态观察
菌株PFY-7、PFY-8在MRS和MRS-S产糖固体培养基上形态如图1所示。在MRS平板上菌落较小,大小在3 mm左右,灰白色,隆起,边缘整齐,表面光滑。在MRS-S产糖固体培养基上,菌落较大,有黏稠的液体覆盖其上,挑起具有黏性。革兰氏染色结果如图2所示,菌体呈红色、短杆状排列,为革兰氏阴性菌。
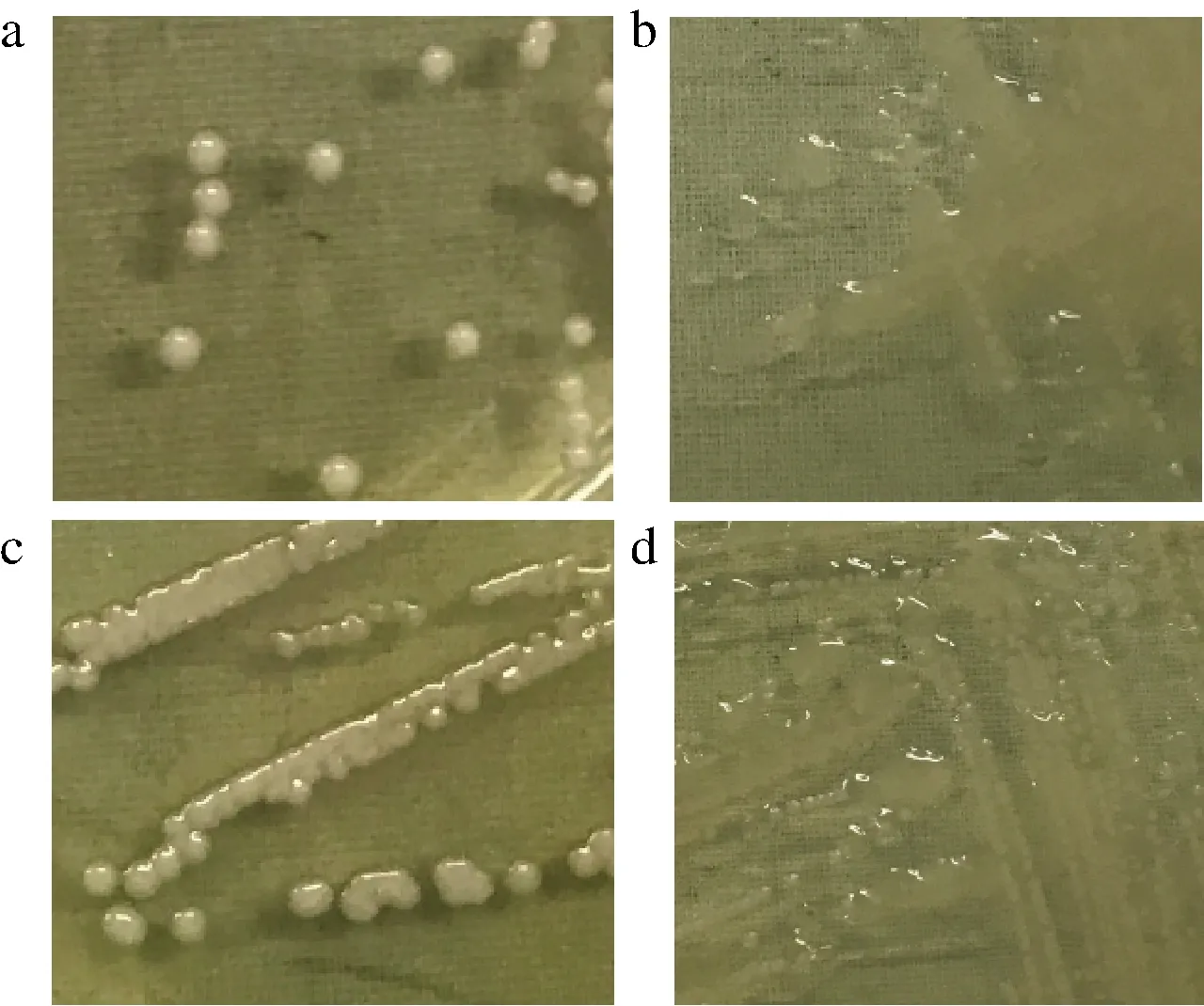
a-菌株PFY-7(MRS平板);b-菌株PFY-7(MRS-S平板); c-菌株PFY-8(MRS平板);d-菌株PFY-8(MRS-S平板)
图1 菌株PFY-7、PFY-8在MRS、MRS-S平板上的菌落形态
Fig.1 Colony morphology of strain PFY-7 and PFY-8 on MRS and MRS-S agar plate
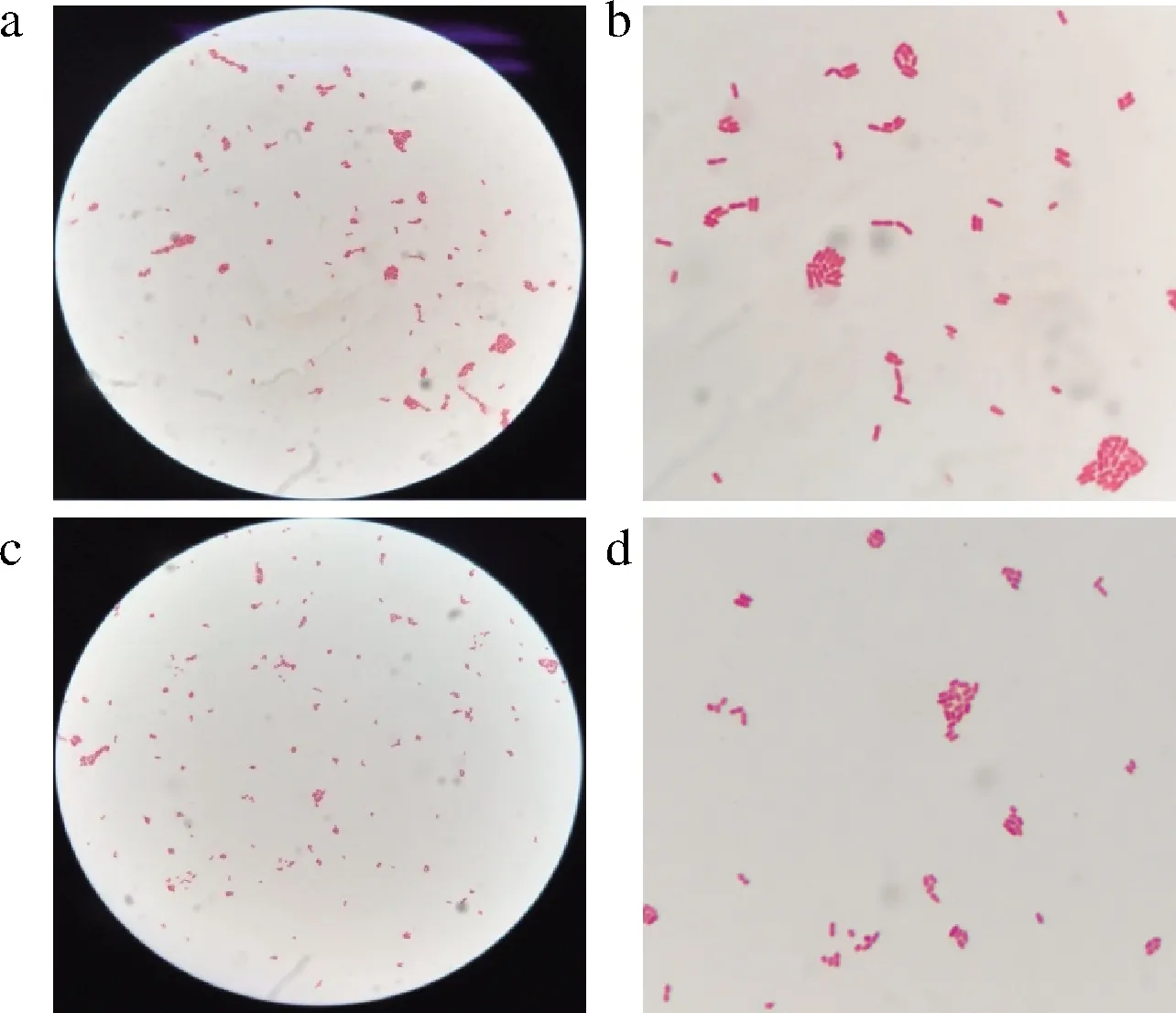
a-菌株PFY-7;b-菌株PFY-7局部;c-菌株PFY-8; d-菌株PFY-8局部
图2 菌株PFY-7、PFY-8显微形态观察(1 600×)
Fig.2 The microscopic morphology of strain PFY-7 and strain PFY-8
2.3 生理生化鉴定
参考《常见细菌系统鉴定手册》[18]、《乳酸菌分类鉴定及实验方法》[19]、《伯杰细菌手册》[20],对菌株PFY-7、PFY-8的部分生理生化特性进行研究,结果如表2所示。菌株PFY-7和PFY-8在肌醇、甘露醇的利用上存在明显差异,2株菌在种上可能存在差异,需要进一步验证。2株菌的过氧化氢酶(接触酶)试验为强阳性,说明可以催化过氧化氢分解成水和氧气。葡萄糖产酸产气试验可以看出菌株为同型发酵。同化碳源试验可以判断菌株对不同碳源的利用情况,结果为阳性的说明对该碳源利用较好,结果为阴性说明不可以利用该碳源做为唯一碳源进行发酵,结果为弱阳性说明利用该碳源为唯一碳源发酵时菌株生长受到抑制。七叶苷水解为阳性,说明菌株可以水解七叶苷,生成七叶亭,与柠檬酸铁作用,生成黑色化合物。明胶液化试验为阴性说明菌株不可以产生明胶蛋白酶。V-P试验阴性说明菌株不能利用葡萄糖生成乙酰甲基甲醇。硫化氢产气试验为阴性,说明菌株不能分解有机硫化物。精氨酸水解试验为阴性,说明菌株不能产生细菌水解酶,不能释放出碱性物质,而是分解葡萄糖产酸。尿素酶试验为阴性,说明菌株不能分解尿素生成氨。PFY-7、PFY-8的生理生化特征与模式菌株Gluconobactersp.的生理生化性质基本一致[18]。因此,初步判断这2株菌属于Gluconobactersp.。
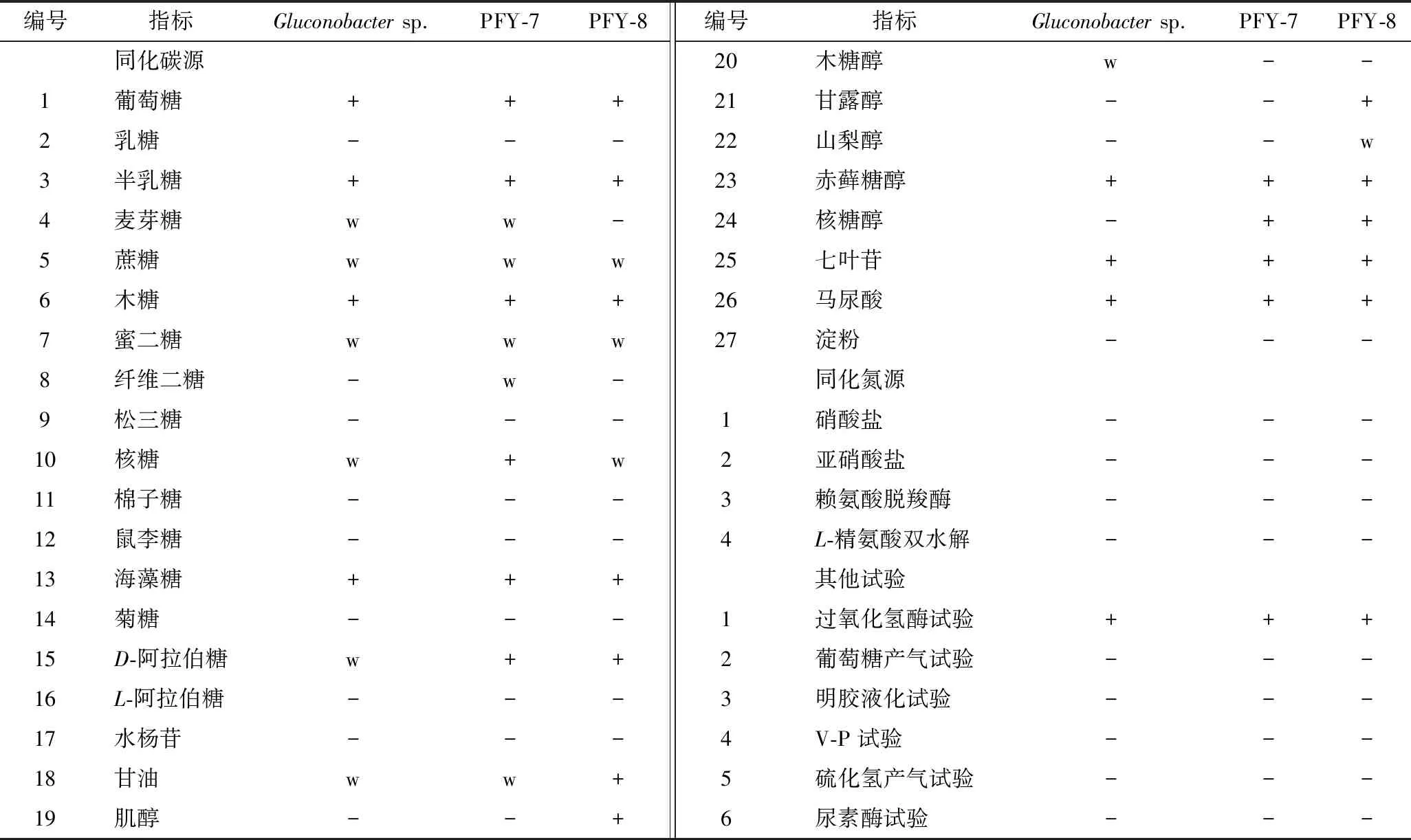
表2 菌株PFY-7和PFY-8的部分生理生化特性Table 2 Physiological and biochemical results of the strain PFY-7 and strain PFY-8
注:“+”代表代谢反应阳性,“-”代表代谢反应阴性,“w”代表代谢反应弱阳性
2.4 16S rDNA序列分析和系统发育树构建
分别提取菌株PFY-7、PFY-8的基因组DNA,PCR反应扩增菌株的16S rDNA序列,扩增产物经琼脂糖凝胶电泳后,在1 500 bp处获得清晰条带,结果如图3所示。PCR产物送上海生工生物工程有限公司进行测序,将测序结果与GenBank公布的数据库进行比对,通过比对发现菌株PFY-7与G.kondoniiHD385(GeneBank登录号:KJ130330)的相似度为99.78%,菌株PFY-8与G.frateuriiSL13-7(GeneBank登录号:AB819118)的相似度为99.78%。结果上传到NCBI数据库,获得GeneBank登录号分别为MN960193和MN960194。
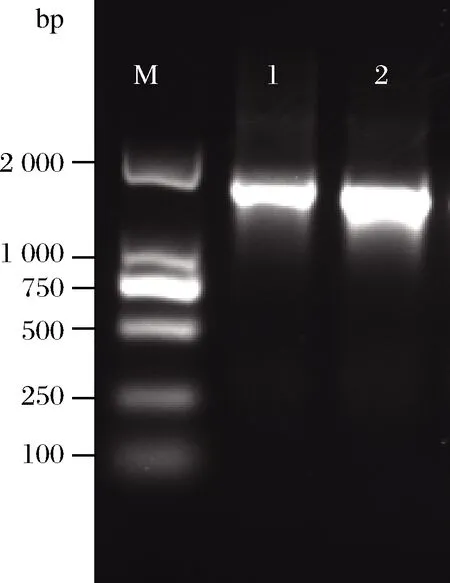
DL 2000 DNA Marker由DNA片段2 000、1 000、750、500、 250以及100 bp组成,共6条带;泳道1为菌株PFY-7 的扩增产物;泳道2为菌株PFY-8的扩增产物
图3 菌株PFY-7和PFY-8的16S rDNA PCR 扩增结果
Fig.3 Electrophoregram of 16S rDNA amplification products of strain PFY-7 and strain PFY-8
由于单一的方法构建系统发育树不足以准确鉴定菌株种属[24],因此本试验分别采用Neighbor- Joining和Maximum-Parsimony法共同构建菌株的16S rDNA系统发育树,参数BootstrapReplications设置为1 000,移除序列中的模糊位点,将菌株PFY-7与20株菌的核酸序列进行比对,按比例绘制系统发育树,如图4所示。可知PFY-7菌株与G.kondoniiHD385的亲缘关系在2种方法构建的系统发育树中分别为63和70,结果比较接近,再结合NCBI基因序列比对结果和生理生化试验结果,可以准确判断PFY-7菌株为G.kondonii,命名为G.kondoniiPFY-7。将菌株PFY-8与13株菌的核酸序列进行比对,按比例绘制系统发育树,如图5所示。菌株在核糖醇中的生长情况可以作为鉴别葡糖杆菌种间鉴定的特征[18],其中能利用核糖醇的菌株可以初步判断为G.frateurii,这与在NCBI上比对的结果相一致,同时,结合16S rDNA系统发育树构建的结果,即菌株PFY-8与菌株G.frateuriiSL13-7的亲缘关系在2种方法构建的系统发育树中均为62,结果一致,可以准确判断PFY-8菌株为G.frateurii,命名为G.frateuriiPFY-8。

a-Neighbor- Joining法;b-Maximum-Parsimony法
图4 Neighbor- Joining和Maximum-Parsimony 法构建菌株PFY-7的16S rDNA系统发育树
Fig.4 Phylogenetic tree of strain PFY-7 16S rDNA base on using Neighbor- Joining method and Maximum-Parsimony method
3 结论
本试验从草莓发酵液中分离得到2株高产EPS的葡糖杆菌,其胞外多糖的含量分别为(22.93±0.61) g/L、(23.81±0.51) g/L。经形态学鉴定、生理生化实验和分子生物学实验鉴定这2株菌为G.kondonii、G.frateurii。分别命出为G.kondoniiPFY-7和G.frateuriiPFY-8。因此,本试验不仅为EPS的生产提供了菌种来源,也为今后利用葡糖杆菌大规模发酵生产EPS提供了理论基础。

a-Neighbor- Joining法;b-Maximum-Parsimony法
图5 Neighbor- Joining和Maximum-Parsimony 法构建菌株PFY-8的16S rDNA系统发育树
Fig.5 Phylogenetic tree of strain PFY-8 16S rDNA base on using Neighbor- Joining method and Maximum-Parsimony method
