不同草酸/钙摩尔比条件下草酸钙晶体的生长及对HK-2细胞的毒性
2020-07-06邹国均孙新园欧阳健明
刘 虹, 邹国均, 孙新园, 欧阳健明
(1. 暨南大学生物矿化与结石病防治研究所, 广州 510632;2. 广州医科大学附属第一医院, 广州 510230)
肾结石在全球的发病率约为10%, 且其复发率高[1]. 肾结石的主要成分为草酸钙(CaOx), 并主要以一水草酸钙(COM)和二水草酸钙(COD)的形式存在. 肾结石的形成涉及CaOx晶体的成核、 生长、 聚集以及滞留等过程[2,3]. 肾上皮细胞(REC)损伤是引起肾结石形成的主要因素之一[4]. REC损伤会导致细胞表面带负电的黏附分子(如透明质酸和骨桥蛋白等)的过量表达[5], 这些变化不仅为尿晶体的成核、 生长提供了有效位点(如通过吸附Ca2+离子)[6], 而且增强了细胞膜与尿晶体的黏附(如黏附表面带正电荷的COM晶体)[7], 从而增加肾结石形成的风险.
前期研究[8]表明, 结石患者尿液中的CaOx晶体多数为尺寸较大的聚集体, 并且带有尖锐的棱角; 而健康对照者尿液中的微晶则为众多的小尺寸圆钝颗粒, 且聚集体较少. 尿液中钙和草酸浓度的变化, 即草酸/钙(Ox/Ca)摩尔比会影响CaOx晶体的生长和聚集. 与正常人相比, 肾结石患者尿液中的草酸盐浓度更高[9].
草酸盐也是造成晶体聚集的最重要因素[10]. Bretherton等[11]研究表明, CaOx成核和生长速率随着草酸浓度的增加而增大, 并导致形成的晶体数目增多, 尺寸变大. Jung等[12]的研究也表明, CaOx过饱和溶液中Ox/Ca摩尔比的改变可显著影响晶体结晶, 过量的钙有利于COD晶体的生成, 过量的草酸有利于COM晶体的生成.
同时, 研究[13,14]证实, 摄入足够的钙可以结合体内更多的草酸盐, 从而减少尿草酸盐的排泄, 限制CaOx结石的生长. 尿液中尿石盐(如CaOx等)的过饱和是诱发结石形成的最初动力. CaOx的相对过饱和度(RS)是影响CaOx晶体结晶的最重要因素. Borghi等[15]研究表明, CaOx的RS降低能够减少CaOx的自发成核, 即降低CaOx的RS能够抑制CaOx结晶. 在RS=30时形成的晶体数量比RS=10时显著增加, 而RS>50时则形成尺寸较大的聚集体[16].
本文在保持CaOx的RS恒定的情况下, 研究了溶液中Ox/Ca摩尔比变化对CaOx结晶的影响以及形成的晶体对肾上皮细胞的毒性差异, 以期为抑制肾结石的形成提供新启示.
1 实验部分
1.1 试剂与仪器
人肾近端小管上皮细胞(HK-2)(中国科学院上海细胞库); DMEM培养基、 胎牛血清和胰酶(美国Gibco公司); 青霉素和链霉素(北京普博生物技术有限公司); 草酸钠(Na2C2O4, 纯度99.7%)、 二水合氯化钙(CaCl2·2H2O, 纯度99.7%)和4%多聚甲醛(纯度99.7%)均购自广州化学试剂厂; 细胞增殖毒性检测试剂盒(CCK-8)、 活性氧(ROS)检测试剂盒、 吖啶橙(AO)、 线粒体膜电位检测试剂盒(JC-1)、 微丝绿色荧光探针(Actin-Tracker Green)、 羊血清、 骨桥蛋白一抗和FITC二抗均购自上海碧云天生物技术有限公司.
D/MAX 2400型X射线粉末衍射仪(日本理学公司); Optima 2000DV型电感耦合等离子体发射光谱仪(美国Perkin Elmer公司); Beckman Coulter型流式细胞仪(美国Gallios公司); LSM510 Meta Duo Scan型激光共聚焦显微镜(德国Zeiss公司); XL-30型环境扫描电子显微镜(SEM, 荷兰Phillps公司); Safire2型酶标仪(瑞士Tecan公司); Leica DMRA2型倒置荧光显微镜(德国Leica公司).
1.2 细胞培养及分组
HK-2细胞培养在37 ℃, 5%CO2且饱和湿度的培养箱中进行, 待细胞达到80%汇合后用胰酶消化, 吹打分散成单细胞悬液. 将细胞悬液(密度为1.0×105cells/mL)接种于相应规格的培养板中, 加入含10%(体积分数)胎牛血清的DMEM培养液孵育24 h, 吸除上层清液, 用PBS缓冲液洗涤2次, 改用无血清DMEM培养液孵育12 h, 使细胞同步化.
将实验模型分为如下4组. (1) 正常对照组: 吸除培养液, 用PBS缓冲液洗涤细胞2次后, 加入无血清的DMEM培养液; (2) 损伤对照组: 参照文献[17]方法用2.8 mmol/L草酸损伤HK-2细胞3.5 h后, 加入无血清的DMEM培养液; (3) 正常晶体组: 在固定CaOx的RS=9.27条件下[18], 改变Ox/Ca摩尔比分别为0.25, 1和4 , 得到3种CaOx过饱和溶液, 在正常HK-2细胞表面诱导晶体生长12 h; (4) 损伤晶体组: 将HK-2细胞用2.8 mmol/L的草酸损伤3.5 h后, 吸除上层清液, 用PBS缓冲液洗涤2次, 然后分别加入上述3种CaOx过饱和溶液, 诱导晶体生长12 h.
1.3 CCK-8法检测细胞活力
细胞分组同1.2节. 将浓度为1.0×105cells/mL的HK-2细胞按100 μL/孔接种于96孔培养板中, 孵育24 h后吸除培养液, 每孔加入100 μL细胞培养液和10 μL CCK-8试剂, 避光孵育1.5 h. 用酶标仪在450 nm处测量吸光度(A), 用下式求得细胞活力(Cell viability, %):
式中:A(treatment group)为实验组的吸光度值;A(control group)为正常对照组的吸光度值.
1.4 细胞内活性氧(ROS)水平检测
细胞种板密度和实验分组与1.2节相同, 达到作用时间后吸除上层清液, 用PBS缓冲液清洗2次, 加入500 μL用无血清培养液稀释的DCFH-DA. 置于37 ℃细胞培养箱内孵育20 min, 再用PBS缓冲液清洗3次, 以充分去除未进入细胞内的DCFH-DA, 用荧光显微镜观察ROS水平, 并通过酶标仪检测其荧光强度.
1.5 溶酶体完整性检测
荧光定性观察: 将浓度为1.0×105cells/mL的HK-2细胞按1 mL/孔接种于12孔培养板中, 孵育24 h后, 加入300 μL用DMEM配制的5 μg/mL的吖啶橙(AO)染色15 min. 实验分组与1.2节相同. 吸除上层清液, 用PBS缓冲液洗涤2次, 通过荧光显微镜观察细胞内红色和绿色荧光强度.
荧光定量检测: 将浓度为1.0×105cells/mL的HK-2细胞按100 μL/孔接种于96孔板中, AO染色及细胞处理步骤同上. 达到作用时间后, 用酶标仪检测红色和绿色荧光强度. 激发波长为485 nm, 反射波长分别为530 nm(绿色, 细胞质中AO)和620 nm(红色, 溶酶体中AO). 溶酶体的完整性=红光强度/绿光强度; 处理组溶酶体的完整性=(红光强度/绿光强度)/对照组溶酶体的完整性.
1.6 细胞表面骨桥蛋白(OPN)表达检测
细胞种板密度和实验分组与1.2节相同. 达到孵育时间后, 吸除上层清液, 用PBS缓冲液洗涤细胞3次, 每次5 min; 加入4%多聚甲醛固定10 min, 再用PBS缓冲液洗涤3次, 每次3 min; 加入羊血清封闭20 min, 加入骨桥蛋白一抗(1∶100), 于4 ℃过夜. 用PBS缓冲液洗涤3次, 避光滴加FITC二抗(1∶100), 于37 ℃孵育30 min后, 用PBS缓冲液洗涤3次, 最后用DAPI染色并封片, 通过激光共聚焦显微镜观察OPN表达情况. 细胞核呈蓝色, 表达的OPN呈绿色.
1.7 共聚焦显微镜观察细胞骨架
细胞种板密度和实验分组与1.2节相同. 达到孵育时间后, 吸除上层清液, 用PBS缓冲液洗涤细胞2次, 加入4%(体积分数)多聚甲醛于室温下固定细胞20 min, 用含0.1%(体积分数) Triton X-100的PBS缓冲液洗涤2次, 每次5 min. 用含0.1%(体积分数) Triton X-100的PBS缓冲液按照体积比1∶100的比例稀释 Actin-Tracker Green. 每孔加入500 μL稀释的Actin-tracker Green, 室温下避光孵育60 min. 孵育后用含0.1%(体积分数) Triton X-100的PBS缓冲液洗涤2次, 每次约5 min. 通过激光共聚焦显微镜观察细胞骨架的变化.
1.8 流式细胞仪检测线粒体膜电位(Δψm)的变化
细胞种板密度和实验分组与1.2节相同. 达到孵育时间后, 吸除上层清液, 用PBS缓冲液洗涤细胞2次, 用0.25%胰酶消化, 吹打细胞, 离心(1000 r/min)5 min, 吸除上层清液, 用PBS缓冲液洗涤, 重新离心, 得到细胞沉淀. 加入500 μL PBS缓冲液重悬, 充分混匀后移入EP管中, 经JC-1染色后用流式细胞仪检测Δψm的变化.
1.9 流式细胞仪检测磷酯酰丝氨酸(PS)外翻量
细胞种板密度和实验分组与1.2节相同. 达到孵育时间后, 用胰酶消化, 吹打细胞使细胞悬浮, 离心(1000 r/min) 5 min, 吸除上层清液, 用PBS缓冲液洗涤, 重新离心, 得到细胞沉淀. 加入Annexin-V-FITC染料, 于4 ℃避光孵育30 min, 通过流式细胞仪检测PS外翻量.
1.10 ICP检测形成的CaOx晶体量
实验分组如下: (A) 正常细胞诱导晶体生长组: 在不经任何处理的正常细胞中加入CaOx过饱和溶液, 诱导晶体生长12 h; (B) 损伤细胞诱导晶体生长组: 用2.8 mmol/L草酸损伤细胞3.5 h后, 吸出培养基, 用PBS缓冲液洗涤2次后加入CaOx过饱和溶液, 诱导晶体生长12 h. 经胰酶消化后, 收集细胞和形成的晶体; 加入4.0 mL浓HNO3和1.0 mL HClO4混合溶液硝化至澄清后, 再加热至冒烟, 蒸发至近干时停止加热, 利用余热将残液蒸干, 冷却, 加入3 mL 2%的HNO3稀释溶解, 利用ICP测定Ca2+离子的浓度, 然后换算成CaOx晶体的质量. 对照组采用如上硝化方法处理, 以用于扣除细胞内本身存在的Ca2+.
1.11 CaOx晶体的XRD分析
种板密度和实验分组与1.10节相同, 待晶体生长12 h后, 吸除培养液, 于60 ℃恒温烘干, 对干燥后样品进行XRD分析.
1.12 细胞和CaOx晶体的SEM表征
种板密度和实验分组与1.10节相同, 待晶体生长12 h后, 吸除培养液, 进行SEM制样. 加入2.5%(体积分数)戊二醛固定24 h, 再用1% OsO4将细胞固定, 经体积分数为30%, 50%, 70%, 90%和100%的乙醇梯度脱水后, 进行CO2临界点干燥, 喷金包被后利用SEM观察.
1.13 统计学分析

2 结 果
2.1 Ox/Ca摩尔比对细胞活力的影响
在固定CaOx的RS=9.27的条件下, 改变Ox/Ca摩尔比分别为4, 1和0.25(表1), 分别在正常

Table 1 Composition and labeling of CaOx supersaturated solution with different Ox/Ca molar ratios
HK-2细胞和2.8 mmol/L草酸损伤的HK-2细胞表面诱导CaOx晶体生长12 h, 细胞活力变化如图1所示. 与正常HK-2细胞的活力(100%)相比, 草酸损伤细胞的活力降低到66.27%. 各组加入CaOx过饱和溶液后, 细胞活力均进一步降低, 其中正常组降低至75.21%~93.77%, 损伤组降低至41.20%~59.99%. 这说明 CaOx 过饱和溶液会对细胞产生损伤, 而且随着过饱和溶液中 Ox/Ca 摩尔比增大, 细胞的活力降低、 损伤加重.

Fig.1 Cell viability of HK-2 cells before and after injury with CaOx supersaturated solutions with various Ox/Ca molar ratiosAction time: 12 h; ** P<0.01, * P<0.05 vs. normal blank group.
2.2 Ox/Ca摩尔比对细胞内ROS水平的影响
如图2(A)所示, 正常组细胞绿色荧光较弱, 表明细胞内ROS水平很低. 加入不同Ox/Ca摩尔比的CaOx过饱和溶液后, 细胞的ROS水平均升高, 在固定RS=9.27的条件下, Ox/Ca 摩尔比为4∶1时 ROS水平升高得最为明显.
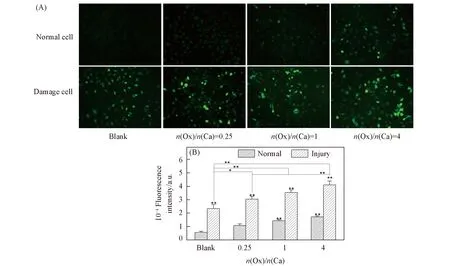
Fig.2 Intracellular ROS level of HK-2 cells before and after injury with CaOx supersaturatedsolutions with various Ox/Ca molar ratios (A) Fluorescence microscopy images of ROS; (B) quantitative fluorescence intensity.Action time: 12 h; ** p<0.01, * p<0.05 vs. normal blank group.
如图2(B)所示, 损伤对照组的绿色荧光比正常组显著增强, 即产生了大量的ROS. 在损伤组中加入不同Ox/Ca摩尔比的CaOx过饱和溶液后, 其ROS水平进一步升高, 且随着Ox/Ca摩尔比的增大逐渐升高.
2.3 Ox/Ca摩尔比对溶酶体完整性的影响
正常细胞溶酶体的结构完整, 红色荧光和绿色荧光叠加呈现橘红色. 而当溶酶体的完整结构遭到破坏时, 红色荧光强度降低. 因此, 可以通过测定红色/绿色荧光的强度比判定溶酶体的损伤程度.
如图3(A)所示, 无论是正常细胞组还是损伤细胞组, 加入CaOx过饱和溶液后均导致橘红色荧光不同程度的降低, 且随着溶液中Ox/Ca摩尔比增大, 橘红色荧光进一步降低, 表明细胞的溶酶完整性进一步遭到破坏[图3(B)], 细胞损伤程度加大.
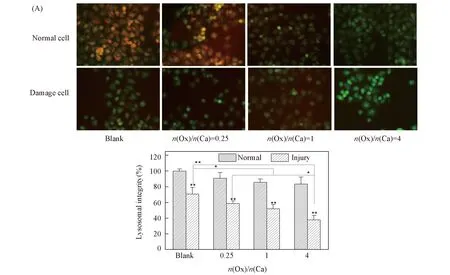
Fig.3 Lysosomal integrity observation of HK-2 cells before and after injury with CaOx supersaturatedsolution with various Ox/Ca molar ratios (A) Fluorescence microscopy images; (B) quantitative fluorescence intensity. Action time: 12 h; ** P<0.01, * P<0.05 vs. normal blank group.
2.4 Ox/Ca摩尔比对细胞表面OPN表达量的影响
细胞表面骨桥蛋白(OPN)是一种带负电的非胶原性骨基质蛋白, 当肾上皮细胞被损伤后, 会引起OPN的明显上调. 正常细胞周围仅存在少量的绿色荧光[图4(A)], 而损伤细胞周围出现显著的绿色荧光, 表明损伤细胞表面的OPN表达量显著增加. 在正常组或损伤组细胞中加入CaOx过饱和溶液后, OPN表达量均随溶液中Ox/Ca摩尔比的增大而进一步增加[图4(B)].
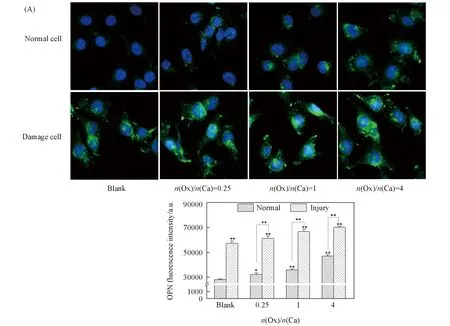
Fig.4 OPN expression of HK-2 cells before and after injury with CaOx supersaturatedsolutions with various Ox/Ca molar ratios (A) Fluorescence microscopy images; (B) quantitative results of OPN expression. Nucleus: blue;OPN: green. Action time: 12 h; ** P<0.01, * P<0.05 vs. normal blank group.
2.5 Ox/Ca摩尔比对细胞骨架的影响
肌动蛋白纤维是构成细胞骨架的重要蛋白纤维. 采用微丝绿色荧光探针对HK-2细胞的肌动蛋白染色, 观察了细胞骨架的变化. 由图5可见, 正常组细胞的骨架完整, 细胞肌动蛋白微丝井然有序, 清晰可见; 而损伤组细胞的骨架有序性降低, 肌动蛋白微丝分布紊乱, 细胞微丝变模糊. 无论是正常组还是损伤组细胞, 加入CaOx过饱和溶液后, 细胞肌动蛋白微丝均变得紊乱, 细胞骨架被破坏, 且随着Ox/Ca摩尔比增加破坏程度加剧. 当Ox/Ca摩尔比为4时, 在正常细胞表面生成了四角双锥形状的COD晶体; 而在损伤细胞表面则生成了六角菱形的COM晶体.

Fig.5 Confocal observation images of cytoskeleton in HK-2 cells before and after injurywith CaOx supersaturated solutions with various Ox/Ca molar ratios Actin: green; nuclei: blue; action time: 12 h.
2.6 Ox/Ca摩尔比对线粒体膜电位(Δψm)的影响
细胞内Δψm的变化反映了细胞内线粒体的损伤程度. Δψm下降的程度越大, 表明细胞的损伤越大. 如图6所示, 形成的CaOx对细胞的损伤导致膜电位下降. 正常组和损伤组细胞的Δψm下降的比例分别为8.50%和26.88%; 加入不同Ox/Ca摩尔比的CaOx过饱和溶液后, 2组细胞的Δψm下降的比例分别增加至13.87%~25.58%和43.53%~76.13%.

Fig.6 Mitochondrial membrane potential detection(Δψm) of HK-2 cells before and after injury withCaOx supersaturated solutions with various Ox/Ca molar ratios(A1—A8) Flow cytometric data of mitochondrial membrane potential(Δψm), green R2 value represents decreasing membrane potential; (A1)—(A4) normal cell; (A5)—(A8): damage cell; (A1), (A5) blank; n(Ox)/n(Ca): (A2), (A6) 0.25; (A3), (A7) 1; (A4), (A8) 4. (B) Quantitative histogram of Δψm. Action time: 12 h; ** P<0.01, * P<0.05 vs. normal blank group.
2.7 Ox/Ca摩尔比对PS外翻量的影响
如图7所示, 正常组和损伤组细胞的PS外翻比例分别为7.92%和36.45%; 加入不同Ox/Ca摩尔比的CaOx过饱和溶液后, PS外翻量比例分别增加至22.91%~27.31%和38.39%~44.16%.
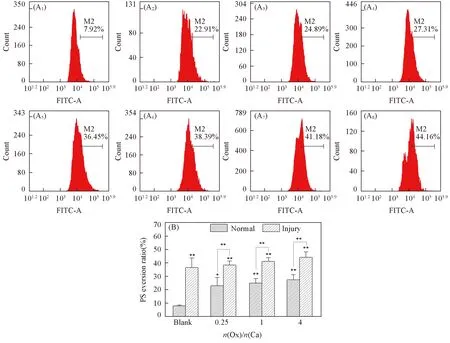
Fig.7 Flow cytometry analysis of PS eversion in HK-2 cells before and after injury withCaOx supersaturated solutions with various Ox/Ca molar ratios(A1—A8) Histogram of the percentage of PS eversion; abscissa: the fluorescence intensity; ordinate: the number of cells; (A1)—(A4) normal cell; (A5)—(A8): damage cell; (A1), (A5) blank; n(Ox)/n(Ca): (A2), (A6) 0.25; (A3), (A7) 1; (A4), (A8) 4. (B) Quantitative histogram. Action time: 12 h; ** P<0.01, * P<0.05 vs. normal blank group.
2.8 Ox/Ca摩尔比对细胞表面形成的CaOx晶体量的影响
采用ICP定量检测了CaOx过饱和溶液中各组细胞表面形成的CaOx晶体量. 由图8可见, 随着溶液中Ox/Ca摩尔比增大细胞诱导生成的CaOx晶体量增多, 且损伤组细胞诱导的晶体量(12.92~20.38 μg/cm2)大于正常组(11.37~18.26 μg/cm2).
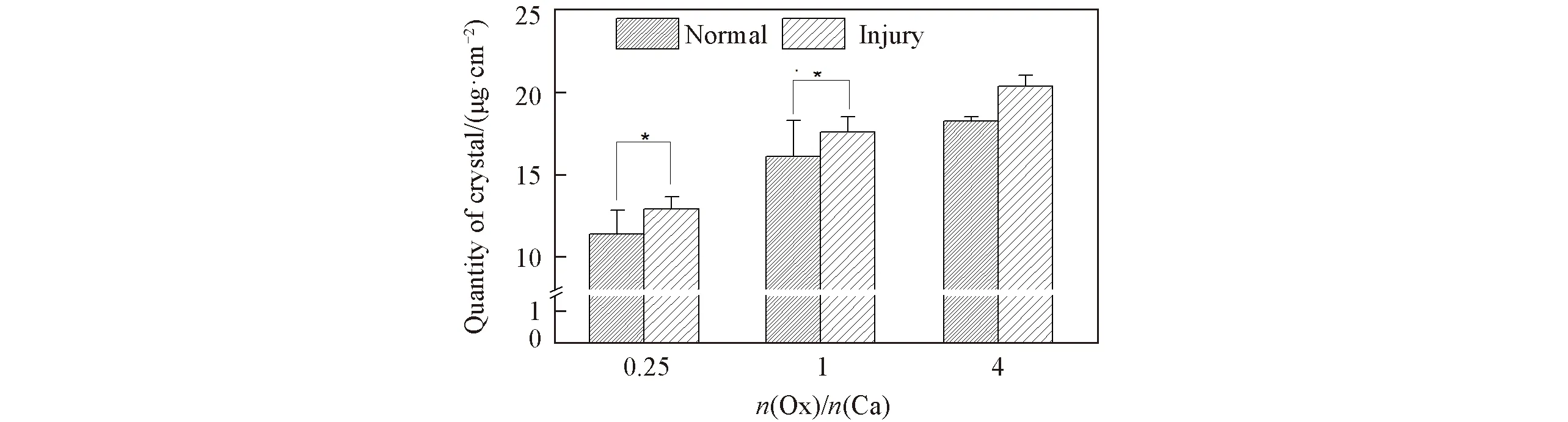
Fig.8 Amount of CaOx crystals on HK-2 cells injury with CaOx supersaturated solutionswith various Ox/Ca molar ratios Action time: 12 h; * p<0.05.
2.9 Ox/Ca摩尔比对细胞表面COM晶体形成和聚集的影响
采用SEM观察了不同Ox/Ca摩尔比过饱和溶液中细胞诱导形成的CaOx晶体. 由图9可见, 在正常HK-2细胞表面主要形成四方锥形二水草酸钙(COD)晶体, 但随着Ox/Ca摩尔比增大, COD晶体数量和尺寸均增加, 并在Ox/Ca摩尔比为4时出现了少量COM晶体. 损伤组细胞主要诱导六角菱形的一水草酸钙(COM)晶体形成, 且随着Ox/Ca摩尔比的增大, COM晶体数量和聚集程度均增加. 与正常组细胞相比, 损伤组细胞诱导的晶体棱角更加尖锐. 尖锐状的晶体对肾上皮细胞的损伤大于圆钝状的晶体.

Fig.9 SEM images of CaOx crystals on HK-2 cells before and after injury with CaOx supersaturatedsolutions with various Ox/Ca molar ratios (A1)—(A3) Normal cells; (A4)—(A6) damage cell; n(Ox)/n(Ca): (A1), (A4) 0.25; (A2), (A5) 1; (A3), (A7) 4. Action time: 12 h.
2.10 细胞诱导形成的CaOx晶体的XRD表征

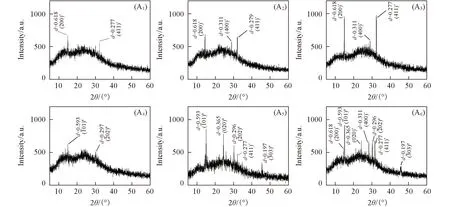
Fig.10 XRD patterns of CaOx crystals on HK-2 cells before and after injury with CaOxsupersaturated solutions with various Ox/Ca molar ratios* COD; # COM. (A1)—(A3) normal cell; (A4)—(A6) damage cell; n(Ox)/n(Ca): (A1), (A4) 0.25; (A2), (A5) 1; (A3), (A6) 4. Action time: 12 h.
3 讨 论
3.1 细胞诱导晶体形成
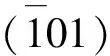
3.2 Ox/Ca摩尔比增大促进晶体形成和聚集
无论是在正常组细胞表面还是在损伤组细胞表面, Ox/Ca摩尔比增大均会促进CaOx晶体的形成, 即诱导的晶体质量增加(图8和图9). Rodgers等[30]研究表明, 草酸盐对CaOx过饱和度的影响是钙的23倍; 尿液中的草酸盐浓度达到正常人的上限时, 大多数个体都会超过CaOx的形成积Ksp, 从而形成结晶尿, 导致CaOx晶体在尿液中自发形成[31], 从而引起CaOx晶体量大幅增加.
在损伤细胞表面, Ox/Ca摩尔比增大后形成的晶体聚集程度显著增加. 损伤细胞表面表达的带负电分子(OPN, HA和PS等)与已经形成的CaOx晶体相作用, 不但促进了晶体在细胞膜上的黏附, 而且细胞表面带负电荷的分子的增多也增加了带正电荷的COM晶体在细胞表面的聚集[32].
3.3 形成的晶体对HK-2细胞的损伤
在过饱和的CaOx溶液中HK-2细胞能诱导CaOx晶体形成, 这些晶体会对细胞产生损伤. 晶体对细胞的损伤程度与晶体中COM的百分含量、 晶体数目、 晶体聚集程度和晶体的棱角尖锐程度4个因素成正相关.
图11示出了改变Ox/Ca摩尔比后在正常和损伤HK-2细胞表面形成的CaOx晶体差异及所形成晶体的细胞毒性差异机理图. CaOx过饱和溶液作用于HK-2细胞后, 正常细胞生成的晶体为较圆钝的COD, 损伤细胞表面生成的晶体为较尖锐的COM; 随着溶液中Ox/Ca摩尔比的增大, 细胞表面生成的晶体增多; 形成的CaOx晶体对细胞造成损伤, 诱导了ROS的过量产生, 引起了溶酶体破裂和线粒体膜通透性改变, 导致线粒体膜电位去极化程度增加[33], 线粒体功能破坏, 膜电位下降. 正常情况下, PS位于肾小管上皮细胞膜的内侧, 但在细胞膜受损后PS会迁移至细胞膜外侧. 细胞表面PS外翻量和OPN表达量的增加使细胞黏附晶体的能力增强.

Fig.11 Mechanism diagram of cytotoxic difference and CaOx crystal difference induced by HK-2 cellsbefore and after injury with CaOx supersaturated solutions with various Ox/Ca molar ratios
早期的研究也证明, COM对HK-2细胞的毒性比COD大[34], 棱角尖锐的COM晶体比圆钝的COM晶体更容易造成细胞的急性损伤[35]. 因此, 诱导COD晶体形成和降低晶体棱角的尖锐程度均可以减少晶体的细胞毒性, 降低肾结石发生的风险.
4 结 论
在RS不变的条件下, 随着Ox/Ca摩尔比的增大, 细胞的损伤程度增加, 导致细胞活力降低, 细胞的溶酶体完整性和线粒体膜电位下降, ROS水平和细胞紊乱程度增加, OPN的表达和PS外翻比例增大. 正常细胞表面主要诱导形成COD晶体, 而损伤的细胞表面主要生成COM晶体. Ox/Ca摩尔比增大后, 细胞诱导生成的CaOx晶体量增加, 晶体中COM比例增大, 晶体聚集程度增大, 对细胞的毒性增大. 本文结果表明, 草酸对肾结石形成的危害远比Ca大, 降低CaOx的过饱和度、 减小Ox/Ca摩尔比和修复受损伤细胞均有利于降低肾结石形成的风险.
