青石斑鱼源嗜水气单胞菌的鉴定及耐药性分析
2020-07-06张丹凤朱秋强胡元庆张晓玲陈晓艳
张丹凤,朱秋强,胡元庆,黄 艳,张晓玲,陈晓艳,范 琳
(闽南师范大学生物科学与技术学院,福建漳州363000)
石斑鱼是我国四大名鱼之一,肉质鲜嫩,高蛋白低脂,经济价值高,以云龙杂交斑和虎龙杂交斑等为代表的新品种出现,使得我国石斑鱼产业发展迅速[1].2017年我国石斑鱼年养殖产量13万吨,2018年己接近16 万吨[2].福建省沿海一带都有养殖石斑鱼,是石斑鱼养殖大省,2017 年位列全国第三.漳州市是福建省的重要养殖基地,集中在漳浦县、云霄县、龙海市、东山县等地,特别是漳州漳浦被称为“中国石斑鱼之都”[3].漳州石斑鱼养殖己进入规模化生产阶段,但是由于水体污染、养殖密度高等原因,细菌性疾病经常发生,造成极大的经济损失[4-5].嗜水气单胞菌是水产养殖上重要的病原菌,目前国内外只有少数关于石斑鱼源嗜水气单胞菌的报道,而且还没有见到关于它的药敏性报道[6].因此,本文对患病青石斑鱼肝脏分离的优势菌株ZPY-1进行鉴定和耐药性分析,为细菌性疾病的精准用药奠定基础.
1 实验材料和方法
1.1 材料
菌株:分离菌株ZPY-1来源于漳浦一养殖场患病的青石斑鱼.
培养基:营养液体培养基(Nutrient broth,NB)和营养琼脂培养基(Nutrient agar,NA)购自于海博生物技术有限公司.水解酪蛋白培养基(Mueller-Hinton,MH)购自于广东环凯微生物有限公司.分别称取NA培养基33 g、NB培养基18 g、MH琼脂38 g和MH肉汤21 g,加入蒸馏水1 L,121 ℃高压灭菌15 min.
抗菌药物:氨苄青霉素、硫酸新霉素、盐酸土霉素、甲砜霉素、氟苯尼考、氧氟沙星、诺氟沙星、强力霉素、阿奇霉素、磺胺甲恶唑、磺胺二甲氧嘧啶、磺胺间甲氧嘧啶、磺胺嘧啶、交沙霉素.
分子生物学试剂和试剂盒:Pfu DNA 聚合酶、DNA Marker F、dNTP mixture 溶液、6 x Glycerol DNA Loading Buffer、细菌16S rRNA 基因扩增引物(27F:5’-AGAGTTTGATCMTGGCTCAG-3’、1492R:5’-GGTTACCTTGTTACGACTT-3’),购于生工生物工程(上海)股份有限公司.SYBR Green I核酸染料购于广州捷倍斯生物科技有限公司.弧菌科细菌生化编码鉴定管购于杭州微生物试剂有限公司.革兰氏染色试剂盒购于广东环凯微生物有限公司.
1.2 实验方法
1.2.1 分离纯化病原菌
采集患病的青石斑鱼,在无菌状态下,从鱼的肝脏处接种到NA 培养基上,37 ℃培养24 h.观察菌落形态特征,取优势菌落再次进行平板划线,37 ℃培养18 h.挑取纯化后的单菌落(命名为ZPY-1)于NB 培养基中,37 ℃,200 rpm的摇床中过夜培养,甘油保种.
1.2.2 革兰氏染色
取ZPY-1单菌落,按照革兰氏染色试剂盒说明书进行染色,油镜下观察细菌形态特征和染色结果.
1.2.3 分析ZPY-1生理生化特征
参照细菌微量生化鉴定管操作说明,记录生化鉴定管的变化,分析ZPY-1生理生化指标.
1.2.3 制作生长曲线
挑取ZPY-1 单菌落于NB 培养基中,37 ℃、180 rpm 培养至OD600 为0. 5~0. 8,用NB 培养基稀释OD600为0.01,取上述稀释好的菌液37 ℃培养,在2、4、6、8、10、12、14、22、24、26、28、30、32、34、36 h不同时间段测定OD600,以时间为横坐标,以OD600为纵坐标,制作生长曲线.
1.2.4 制备DNA模板
采用煮沸裂解法制备DNA 样品,取1 mL 菌液,8 000 rpm 离心5 min,收集沉淀.加入1 mL 灭过菌的ddH2O,吹打重悬,8 000 rpm,离心5 min.重复上述步骤两次.加入700µL ddH2O,沸水浴煮10 min 后,置冰上冰浴10 min.10 000 rpm/min,4 ℃离心10 min,取上清,保存于-20 ℃.
1.2.5 PCR扩增16S rRNA基因
利用细菌通用引物进行16S rRNA 基因PCR 扩增,25µL 扩增体系为:2.5µL 10×PCR buffer、1µL 25µM 27F 引物、1 µL 25 µM 1492R 引物、0.5 µL dNTPs、0.5 µL Pfu DNA 聚合酶、10 µL 模板DNA、9.5 µL ddH2O. PCR 扩增程序:94 ℃变性5 min→[94 ℃预变性30 sec→52 ℃退火1 min→72 ℃延伸2 min]30→72 ℃,10 min→4 ℃保存.经琼脂糖凝胶电泳后,将PCR目的产物送至生工生物工程(上海)股份有限公司测序,并经NCBI Blast进行同源分析.
1.2.6 药敏实验
挑取ZPY-1 单菌落于NB 培养基中,37 ℃培养至OD600 为1.0,用MH 液体培养基对菌液进行稀释,稀释OD600 为0.02;同时用MH 液体培养基二倍稀释14 种抗菌药物在0.1~200 µg/mL 范围内.取100µL上述稀释好的菌液至100µL含有上述不同抗菌药物浓度的MH培养基中,37 ℃培养16 h,将96孔板放置在酶标仪中测定OD600,同时也进行肉眼观察,确定最小抑菌浓度(Minimum Inhibitory Concentration,MIC)值.观察之后,取96孔板中最高抗菌药物浓度至最小抑菌浓度的菌液,涂布于含有相应浓度抗菌药物的MH 固体培养基上,16 h 观察生长情况,以未长菌的最低浓度判定为该抗菌药物的最低杀菌浓度(Minimum bactericidal concentration,MBC)[7].
1.2.7 传代培养
取对数生长期的ZPY-1,在1/2 MIC 抗菌药物(氟苯尼考、诺氟沙星、磺胺甲恶唑)浓度下,在NB 液体培养基中37 ℃振荡培养12 h;取上述菌液5 µL 至1 mL 分别含有这3 种抗菌药物1/2 MIC 的NB 培养基中,继续培养12 h;依此每12 h传代1次,直至连续传代20代,获得相应的第20代菌株,分别为氟苯尼考第20 代菌株(F20)、诺氟沙星第20 代菌株(N20)和磺胺甲恶唑第20 代菌株(H20). 按照1.2.6 的方法测定F20、N20、H20的MIC值、及ZPY-1传代过程中第2、4、6、8、12、14、16、18和20代的MIC.在传代过程中,将ZPY-1在未添加抗菌药物的NB 液体培养基中同步传代20代,第20代菌株命名为ZPY-1-20.根据CLSI标准,如果传代菌株MIC 与原始出发菌株MIC 值的比值大于或等于4,说明传代菌株对该抗菌药物产生了耐药性[7].
2 结果
2.1 细菌形态特征
菌株ZPY-1 在NA 培养基上,菌落呈圆形、表面湿润、边缘光滑、淡黄色、略隆起(见图1).经革兰氏染色呈红色,为短杆状革兰氏阴性细菌.
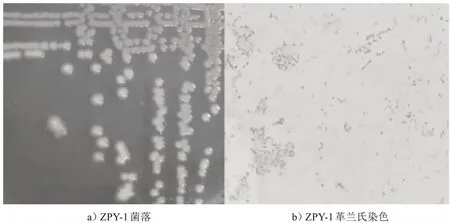
图1 ZPY-1形态特征Fig.1 Morphological characteristics of ZPY-1
2.2 生长曲线
将ZPY-1接入NB 培养基中,从生长曲线(见图2)可以看出,在0~4 h时,OD600相对较低,几乎没有显著的增加,处于延滞期;从4 h起至22 h时,OD600迅速增加,进入指数期;在22~34 h时,OD600逐渐稳定,并达到最高值,处于稳定期;34 h后OD600略有下降,进入衰亡期.
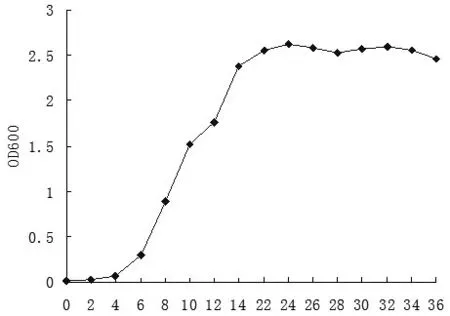
图2 ZPY-1生长曲线Fig.2 Growth curve of ZPY-1
2.3 生理生化鉴定
经生理生化鉴定(见表1),ZPY-1对葡萄糖进行发酵产酸产气,可以利用蔗糖、甘露糖、七叶苷和水杨苷,精氨酸脱羧酶和赖氨酸脱羧酶反应为阳性、鸟氨酸脱羧酶反应为阴性,V-P反应呈红色为阳性.参照弧菌科细菌生化编码手册,ZPY-1为嗜水气单胞菌.

表1 生理生化鉴定结果Tab.1 Identification result of physiological and biochemical index
2.4 16S rRNA鉴定
利用细菌通用引物对ZPY-1 DNA 模板进行扩增,扩增获得与预期大小一样的目的条带,约1.5 kbp(见图3).16S rRNA基因的PCR产物进行测序,通过NCBI Blast检索系统进行同源性分析,与其有高度同源的都是气胞菌属的细菌,其中同源性最高的全部都是嗜水气单胞菌,相似性达100%.综合生理生化指标和16S rRNA鉴定结果,判断ZPY-1为嗜水气单胞菌.
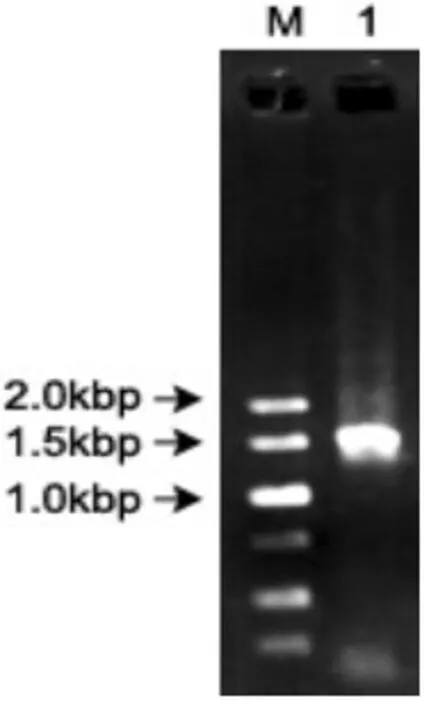
图3 16S rRNA 基因PCR产物电泳结果Fig.3 Electrophoresis result of PCR product of 16S rRNA gene
2.5 药敏性分析
用14 种常用渔药分析嗜水气单胞菌ZPY-1 的药敏性(见表2),嗜水气单胞菌对氨苄青霉素、强力霉素、阿奇霉素、磺胺间甲氧嘧啶和磺胺嘧啶高度耐药,它们的MIC 值全部大于100µg/mL;对氟苯尼考、诺氟沙星、磺胺甲恶唑相对敏感,而且这三种抗菌药物对ZPY-1 的MIC 值和相应的MBC 值都相同,即在MIC 条件下可以起到完全的杀菌作用.磺胺二甲氧嘧啶、磺胺间甲氧嘧啶、磺胺嘧啶、磺胺甲恶唑都属于磺胺类抗菌物质,ZPY-1对磺胺间甲氧嘧啶、磺胺嘧啶高度耐药,对磺胺甲恶唑敏感;甲砜霉素和氟苯尼考同属于酰胺醇类抗菌药物,氧氟沙星和诺氟沙星同属于喹诺酮类抗菌药物,但是ZPY-1 对氟苯尼考和诺氟沙星都敏感;交沙霉素和阿奇霉素都是大环内酯类抗菌药物,盐酸土霉素和强力霉素都是四环素类抗菌药物,但是ZPY-1 却对其中的阿奇霉素和强力霉素高度耐药.这些结果表明,即使是同一类抗菌药物,ZPY-1对它们的药敏性表现不一,提示在生产实践中,养殖户有必要先进行药敏试验,再精准用药.
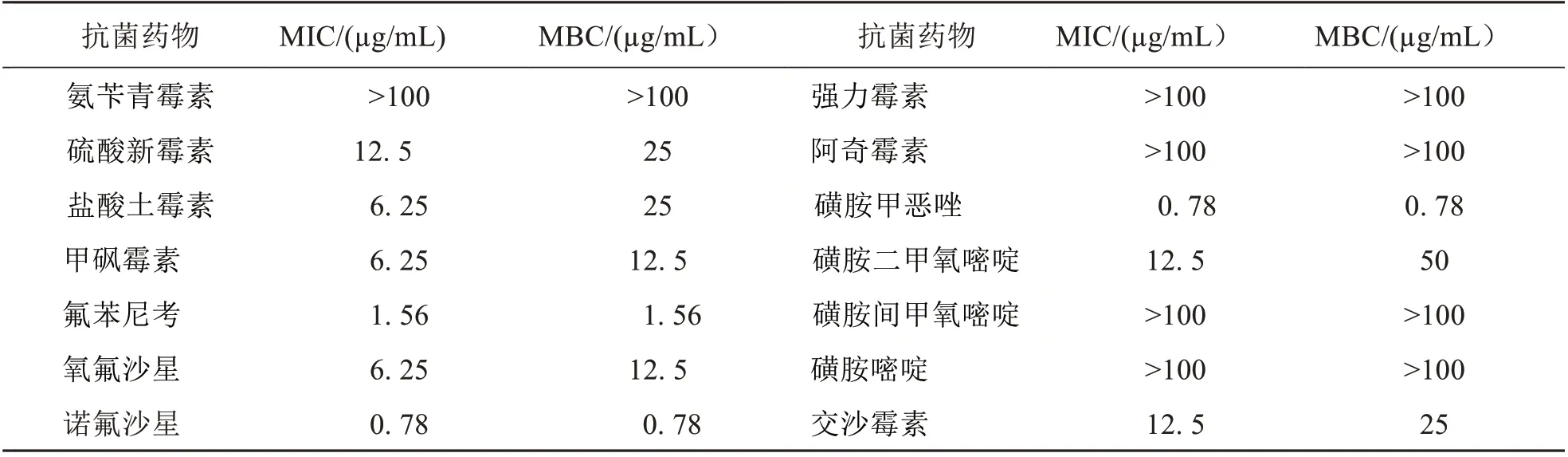
表2 嗜水气单胞菌ZPY-1药敏性Tab.2 Drug susceptibility of Aeromonas hydrophilia ZPY-1
2.6 传代菌株药敏性分析
为了进一步考察氟苯尼考、诺氟沙星、磺胺甲恶唑这3 种药敏性较高的抗菌药物,是否会因为连续使用导致细菌产生耐药性,所以ZPY-1分别在这3种抗菌药物1/2MIC条件下和没有抗菌药物条件下进行传代20代.结果显示氟苯尼考、诺氟沙星、磺胺甲恶唑对ZPY-1-20与原始出发菌株ZPY-1的MIC值一样,没有发生改变,说明连续传代没有引起ZPY-1的MIC值改变;但是分别在这三种抗菌药物1/2 MIC条件下连续传代20 代的菌株F20(25µg/mL)、N20(6.25µg/mL)、H20(12.5µg/mL)的MIC 值与ZPY-1 原始菌株的MIC值相比,分别是它的16倍、8倍和16倍,表明在1/2MIC条件下抗菌药物作用下,都会引起它们的MIC值不同程度的增加,都诱导产生了耐药性.从图4 可以看出,ZPY-1 在1/2 MIC 氟苯尼考的诱导下,在第8代,它的MIC 值就开始增加,至第12代增加到原来的4倍,说明从第12代开始就对氟苯尼考产生耐药性;在1/2 MIC 磺胺甲恶唑传代下,ZPY-1 的第14 代MIC 值由原来的0.78µg/mL 增加到3.13µg/mL,为原来的4倍,即从第14代开始也开始产生了耐药性;在1/2 MIC磺胺甲恶唑作用下,ZPY-1在第4代MIC值增加至原来的2 倍,第14 代开始MIC 值为原来的8 倍,第18 代和第20 代MIC 值均为12.5µg/mL.这些结果说明即使原来非常有效的抗菌药物,如果长期多次低剂量的使用,也会导致细菌耐药性的产生,不能有效地控制细菌性疾病.
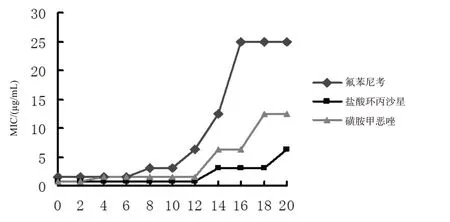
图4 ZPY-1传代过程MIC值的变化Fig.4 The alteration of MIC of ZPY-1 in the generation process
3 讨论
嗜水气单胞菌属于弧菌科气单胞菌属,是一种人-畜-鱼共患病原菌,是我国各地大规模流行性养殖鱼类爆发性疾病的主要病原菌之一.魏选明对发病石斑鱼的胰腺组织进行分离和纯化得到一优势菌株,进行生理生化鉴定、16S rRNA 基因鉴定和人工回归感染试验,判断该菌株是一株可引起石斑鱼发病的嗜水气单胞菌[6].本实验分离到的青石斑鱼源致病菌ZPY-1 也是嗜水气单胞菌,表现为革兰氏阴性,具有典型的单细胞微生物生长曲线.
随着水产养殖业快速发展,使用抗菌药物己成为水产养殖细菌性疾病防控高效、低廉的措施.但是随着抗菌药物的广泛使用,其弊端日益严重,特别是细菌耐药性问题已成为全球公共卫生问题聚焦的热点和难点,也成为水产养殖业快速发展的限制因子[8].嗜水气单胞菌的耐药性具有典型的耐药率高、耐药谱广的特征[9-10].比如,嗜水气单胞菌对一些经典的抗菌药物,包括氨苄青霉素、头孢氨苄、氯霉素等的耐药性己经达到90%以上,对其它抗菌药物如链霉素、四环素、氧氟沙星、头孢曲松等的药敏性也逐渐下降[11].对埃及市场上鲻鱼中嗜水气单胞菌的发生情况以及这些菌株的耐药性表型进行检测,发现鲻鱼感染嗜水气单胞菌检出率为37%(50/135),这些嗜水气单胞菌对头孢西丁耐药率最高(100%),其次是氨苄西林(84%)、头孢他啶(56%)和头孢噻肟(40%)[12].从斑马鱼身上分离到的所有嗜水气单胞菌对阿莫西林、萘啶酮酸和土霉素都表现出了耐药性,87.5%菌株对氨苄青霉素、利福平耐药,75%菌株对头孢噻吩耐药[13].本实验分离到的嗜水气单胞菌ZPY-1 对不同种类抗菌药物的药敏性不同,相比之下,对喹诺酮类和酰胺醇类抗菌药物比较敏感;即使是同一种类抗菌药物,药敏性也有显著差异;在连续传代诱导后,即使是原来敏感的抗菌药物,ZPY-1 也产生了相应的耐药性.因此,在水产养殖过程中,应严格按照2017 年农业部颁布的《全国遏制动物源细菌耐药行动计划》的要求,合理、科学地使用抗菌药物.在使用抗菌药物之前,最好能够先进行药敏试验,选择效果较佳的抗菌药物;选择好抗菌药物后,尽量使用足够剂量的抗菌药物,避免反复多次使用低剂量抗菌药物引起细菌耐药性;并且在同一时期内,尽量不要同一种抗菌药物反复多次使用,而应多种抗菌药物交替使用.
