复方DHA/PS/ASTA的功能及毒理学研究
2020-07-06刘振宇岳喜军
刘振宇,岳喜军
(1.济南市食品药品检验检测中心,山东济南 250000;2.东平县沙河站镇中心卫生院,山东泰安 271508)
目前,人口老龄化现象已成为世界各国共同面对的难题之一。据统计,世界上人口老龄化最严重的3个国家分别是日本、德国和意大利,老年人口的比重都在21%以上。我国人口老龄化的问题亦日趋严重,从2018年数据统计分析来看,我国已有六省市进入深度老龄化,这六个省市老龄化程度由高到低分别是辽宁省、上海市、山东省、四川省、重庆市和江苏省,目前辽宁省65岁以上人口占比为15.17%,为全国最高。因此,关于中老年人的健康保健,任重而道远。
随着年龄的增长,机体免疫力逐渐降低、记忆力减退等症状是存在于中老年人群中的普遍现象,严重影响了机体的正常功能。现代医学药理学研究表明,机体免疫力降低会严重加速机体的衰弱过程,降低其对疾病的抵抗能力,从而使机体易受外界环境的变化而患病;同样,机体的记忆力减退,会致使机体逐渐发展至老年痴呆症等严重症状。
因此,为了改变现状,保护中老年人群的健康,结合现代医学药理学研究理论,现以二十二碳六烯酸(Docosahexaenoic acid,DHA)、磷脂酰丝氨酸(Phosphatidylserine,PS)、虾青素(Astaxanthin,ASTA)为原料制得复方ASTA制剂,其既能改善记忆又能增强免疫力。其中,原料PS、DHA均为国家批准公布的新资源食品[1-2],同被誉为新兴的“智能营养素”[3-6],既能使细胞壁保持柔韧,同时能够促进增强传送大脑信号的神经递质的速率,从而达到促进大脑快速高效运转的效果,激发机体大脑处于活化状态,同时能增强免疫力。原料ASTA为类胡萝卜素的一种,是一种较强的天然抗氧化剂[7],能提高机体的免疫功能,同时能提高脾细胞产生抗体的能力,达到增强机体T细胞功效的作用,刺激免疫球蛋白的产生,同时改善记忆力[8]。三者原料配伍,相辅相成,共同奏效。现对该复方制剂产品功能及安全性等方面进行相关的动物试验研究。
1 材料与方法
1.1 样品
复方DHA/PS/ASTA糖果,0.5 g/粒(组方为:PS 0.10 g、DHA 0.15 g、ASTA 0.04 g,辅料 0.21 g);每日2次,每次2粒。每人每日推荐量为2.0 g。
1.2 试验动物
试验动物由山东大学动物试验中心提供的健康SPF级昆明种雌、雄小鼠、Wistar大鼠,生产许可证号为SCXK(鲁)20130009。试验动物使用许可证号为SYXK(鲁)20100011号。试验动物饲料生产许可证SCXK(京)2014-0008。饲养环境为屏障级。试验环境温度(22±2)℃,相对湿度50%±10%。
1.3 仪器设备
仪器设备、试验装置均参考《保健食品检验与评价技术规范》(2003年版)[9]。
1.4 试验过程
1.4.1 改善记忆力功能动物试验
1.4.1.1 跳台试验
将雄性小鼠40只(体重25~32 g),随机分为空白对照组和 0.17 g/kg.bw、0.33 g/kg.bw、0.66 g/kg.bw三个受试物剂量组,每组10只,受试物剂量分别相当于人体每日推荐量的5倍、10倍、20倍,三个剂量组每天灌胃给予受试物,连续给样30 d后,进行跳台训练试验。将各组小鼠抚摸几下后放入小鼠跳台测试箱中,让其适应30 min。调节电压为32 V,开始试验,对小鼠进行电刺激,在训练期间通电小鼠跳下平台在箱底不断被电击,这个过程中小鼠获得记忆。24 h后检测其记忆力,重复前操作,此时测试仪记录小鼠第一下跳下平台的时间即潜伏期和5 min内跳下平台的次数即测试期的错误次数,作为记忆保持成绩。
1.4.1.2 水迷宫测试试验
动物选择、试验分组以及受试物剂量、途径、时间均同跳台试验一样。给受试物30 d后开始进行水迷宫试验,训练期间继续给予受试物,每天训练1次,连续5 d,第1 d训练前将小鼠放在梯子附近,使其自动爬上3次,以后每次训练前将小鼠放在梯子附近,使其自动爬上1次。第1 d训练时,用挡板在A处挡住,进行训练。第2 d从B处开始,此路程训练3次,80%的动物到期达终点。第5 d从起点S开始训练,最后以5 d的总学习成绩进行评价(即各组2 min内到达终点的动物数、每组5 d平均错误次数和到达终点的时间)。
1.4.2 动物免疫试验
将体重25~32 g的小鼠80只,雌雄各半,分为2个免疫大组,每大组40只,每免疫大组小鼠分为正常对照组、0.17 g/kg.bw、0.33 g/kg.bw、0.66 g/kg.bw 三个受试物低、中、高剂量组,剂量分别相当于人体每日推荐量的5倍、10倍、20倍。免疫一组(雌)用于迟发型变态反应(DTH)试验、血清溶血素的测定、抗体生成细胞数的测定;免疫二组(雄)用于小鼠淋巴细胞转化试验。具体试验操作参考《保健食品检验与评价技术规范》(2003年版)[9]。
1.4.3 毒理学试验
1.4.3.1 小鼠急性毒性试验
采用最大耐受剂量法试验,选用体重为25~32 g的小鼠20只,雌雄各半。小鼠灌胃前16 h禁食,自由饮水,于第2 d 以 15.0 g/kg灌胃后,连续观察14 d,记录动物中毒症状及死亡情况。
1.4.3.2 遗传毒性试验
(1)污染物致突变性检测(Ames试验):采用鼠伤寒沙门氏菌组氨酸缺陷型TA97、TA98、TA100、TA102四种标准突变型试验菌株。大鼠肝匀浆S-9采用多氯联苯诱导Wistar大鼠,按Ames常规方法自行制备。剂量组分设5 000μg/皿、1 000μg/皿、200μg/皿、40μg/皿和8 μg/皿5个剂量组,设自发回变、溶剂对照和阳性对照组,每种菌株每个测试浓度设3个平皿,在加和不加S-9条件下进行试验。37 ℃培养 48 h,记录回复突变菌落数。
(2)小鼠骨髓嗜多染红细胞(PCE)微核试验:50只小鼠(雌雄各半,体重25~32 g)随机分成5组,设 2.5 g/kg.bw、5.0 g/kg.bw 和 10.0 g/kg.bw 三个不同剂量组,1个环磷酰胺阳性对照组(40 mg/kg.bw)和1个纯化水阴性对照组。小鼠按0.02 mL/kg体重灌胃容量,间隔24 h灌胃2次,于末次灌胃后6 h处死动物,制取胸骨髓液,涂片,甲醇固定,染色。镜检PCE,每鼠计数1 000个嗜多染红细胞,计算微核千分率,以%表示;同时计数PCE和正染红细胞的比值(PCE/NCE)。
(3)小鼠精子畸形试验:50只雄性小鼠(体重25~32 g)随机分成 5 组,每组 10 只。设 2.5 g/kg.bw、5.0 g/kg.bw和10.0 g/kg.bw三个不同剂量组,另设植物油阴性对照组和环磷酰胺阳性对照组,受试物按0.02 mL/g体重灌胃容量以灌胃方式给予,连续5 d,继之饲养1月,自由摄食、饮水,于35 d颈椎脱臼处死,常规制片,记录畸形精子数,计算精子畸形率。
1.5 试验数据统计
对试验数据进行方差齐性检验,对方差齐者采用t检验;如数据方差不齐,则采用非参数检验。应用软件为 SPSSI 1.5 及 SPSSI 6.0 for Windows。
2 结果与分析
2.1 改善记忆力动物试验
2.1.1 跳台试验结果
由表1可知,跳台试验中,经口给予小鼠不同受试物剂量的受试物30 d,记忆获得(训练)过程中,与正常对照组相比,受试物中、高剂量组的平均错误次数均显著减少(P<0.05);重复测验过程中,与正常对照组相比,受试物高剂量组跳下平台的潜伏期延长,平均错误次数减少,错误反应率显著降低(P<0.05)。
2.1.2 水迷宫试验结果
由表2可知,水迷宫试验中,给予小鼠不同剂量的受试物30 d,与正常对照组比较,各受试物剂量组动物到达终点所需的时间显著缩短(P<0.05);平均错误次数显著减少(P<0.05);到达终点的动物数显著多(P<0.05)。
2.2 免疫试验
2.2.1 对小鼠体重和脏器体重比值的影响
正常对照组和3个剂量组共4个组初始体重的方差分析结果显示,在各组间小鼠的初始体重较为均衡,各组均数间差异均无显著性(P>0.05)。给予小鼠不同剂量的受试物制剂30 d,正常对照组和3个剂量组共4个组体重增长值的方差分析结果显示,各组均数间差异无显著性(P>0.05),即该受试物对小鼠体重无影响;脾脏体重比值和胸腺体重比值的方差分析结果显示,各组均数间差异无显著性(P>0.05),即受试物对小鼠脾脏体重比值和胸腺体重比值均无影响。
2.2.2 受试物对小鼠细胞免疫功能的影响
由表3正常对照组和3个剂量组共4个组的小鼠足跖肿胀度的方差分析结果显示,与正常对照组相比,中、高剂量受试物组间有显著性差异(P<0.05),由此可知该受试物有提高小鼠迟发型变态反应的能力;淋巴细胞增殖能力的方差分析结果显示,各组均数间无显著性差异(P>0.05),表明该受试物细胞免疫试验结果为阳性。

表1 跳台试验结果

表2 水迷宫试验结果
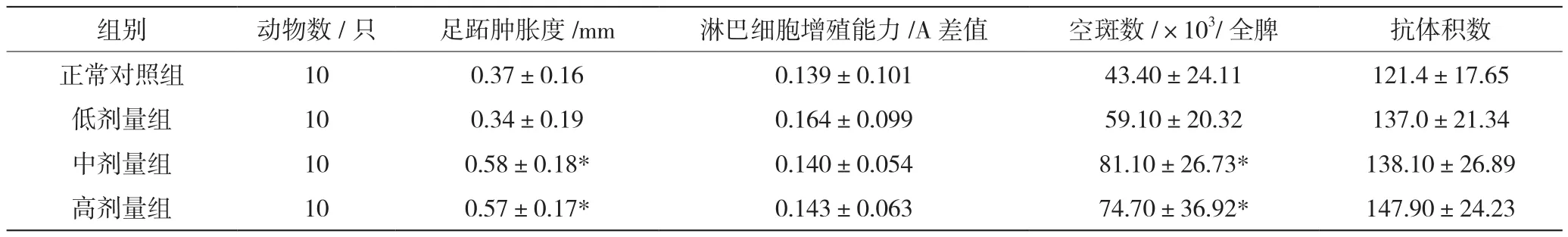
表3 受试物对小鼠免疫功能的影响
与正常对照组相比,受试物组有显著提高小鼠抗体细胞生成数的能力(P<0.05);抗体积数的方差分析结果显示,各组均数间比较无显著性差异(P>0.05),尚不能认为受试物有提高小鼠血清溶血素水平的能力。由此显示,体液免疫试验结果为阳性。
2.3 毒理学试验结果
2.3.1 急性毒性试验
急性毒性试验中,14 d试验期内未见动物明显中毒症状和死亡情况。最大耐受量(MTD)法试验结果显示,该受试物对两种性别小鼠的MTD均>15.0 g/kg.bw。因此,根据急性毒性分级标准,该受试物属实际无毒级。
2.3.2 遗传毒性试验
2.3.2.1 Ames试验结果
受试物各剂量组对鼠伤寒沙门氏菌TA97、TA98、TA100和TA102四株试验菌株,在加与不加S-9时,回变菌落数均未超过溶剂对照组回变菌落数的2倍。因此,Ames试验结果为阴性。
2.3.2.2 小鼠骨髓嗜多染红细胞微核试验结果
阳性对照组微核率与阴性对照组比较,差异具有统计学意义(P<0.05);各剂量组微核率与阴性对照组相比,差异无统计学意义(P>0.05)。因此,小鼠骨髓PCE微核试验结果阴性。
2.3.2.3 小鼠精子畸形试验结果
阳性对照组小鼠精子畸形率为6.23%,与阴性对照组比较,差异有统计学意义(P<0.01);各剂量组精子畸形率与阴性对照组比较,差异无统计学意义(P>0.05)。因此,小鼠精子畸形试验结果阴性。
3 结论
在改善记忆力动物试验中,跳台试验和水迷宫试验的试验组动物记忆获得的错误反应潜伏期延长,错误次数、错误反应率降低,与对照组比较,差异具显著性;水迷宫试验组动物到达终点的时间缩短,到达终点的动物数增加,错误次数减少,与对照组比较,差异亦具显著性,且训练及重复测验结果一致。由此表明复方DHA/PS/ASTA糖果制剂具有改善记忆的作用。
增强免疫动物试验中,经口给予小鼠不同剂量的受试物30 d,对小鼠体重增长无不良影响,对小鼠脾脏体重比值和胸腺体重比值无影响,小鼠的体液免疫功能、细胞免疫功能测定结果均为阳性。结果表明,复方DHA/PS/ASTA糖果制剂具有增强免疫力的作用。
毒理学试验中,经口急性毒性试验、遗传毒性试验两阶段毒理试验结果,可知本品属无毒级,无遗传毒性作用,对动物生长发育无不良影响,其最大未观察到有害作用剂量大于人体可能摄入量的100倍,由此证明具有安全性,且同时证明DHA、PS、ASTA三者原料配伍具有安全性。
