增强CT和超声造影在肝硬化伴肝小结节样病灶鉴别诊断中的应用
2020-07-06安徽省亳州市中医院超声科安徽亳州236800
安徽省亳州市中医院超声科(安徽 亳州 236800)
夏俊来 王 岗 陈涛亳
我国多数肝癌由肝硬化结节逐步发展而来,而从肝硬化发展至合并肝癌的病理过程具有多阶段性、复杂性特点,多数患者在确诊时已达肝癌晚期、往往错过了最佳的手术时机,因此如何检出早期肝癌、或提示肝硬化结节恶变具有重要临床意义[1]。通常采用彩色多普勒超声对其进行早期诊断,但受限于仪器灵敏度、肝硬化背景结构及回声异常、良恶性结节病灶声像图常不典型等因素,诊断准确率下降;穿刺活检虽被视为诊断金标准,但因其有创而应用受限,且其对于位置较深的小病灶假阴性率高;而常规增强CT(contrast enhanced helical computed tomography,CECT)可经静脉快速注射对比剂,增加病变组织同正常肝实质之间的密度差异而提高对肝脏占位病变、特别是小于3cm实性病灶的检出率,在临床广泛应用,但其存在电离辐射、一定程度上限制了其作为肝脏病变筛查的首选[2]。超声造影(contrastenhanced ultrasoun,CEUS)可较好显示肿瘤微血供,从而反映肿瘤微循环变化,有潜力提高超声诊断肝癌的敏感度、特异度[3]。本文主要分析CECT与CEUS对肝硬化伴肝小结节病灶的鉴别诊断价值,报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2018年5月至2019年2月我院收治入院的80例肝硬化患者临床及影像学资料。纳入标准:(1)经术后病理、穿刺活检证实为肝癌或肝硬化再生结节;(2)签署同意书后进行CECT检查、CEUS检查、超声引导下穿刺活检;(3)无造影剂过敏史,且CECT与CEUS检查间隔2周以内进行。排除标准:(1)转移性肝癌或有超声造影检查禁忌症的患者;(2)病灶直径超过30mm或合并其他恶性肿瘤者;(3)合并其他肝脏疾病或肝炎病毒感染、妊娠与哺乳期妇女。其中男60例,女20例;年龄20~72岁,平均(45.79±4.68)岁;病灶直径10~29mm,平均(26.75±2.81)岁。
1.2 方法
1.2.1 CECT检查:应用GE Bright Speed 16排螺旋CT机进行扫描,患者先取平卧位,依据常规行全肝CT平扫,后经肘静脉以高压注射器注入对比剂(优维显370,1.2mL/s,速率5mL/s)行增强扫描。扫描参数:扫描层厚5mm,薄层重建层厚1.25mm,扫描速度1层/s,管电压120kV,选择自动跟踪模式进行扫描。静注后25~30s开始动脉期全肝扫描,60~70s行门脉期扫描,120~180s延迟期扫描,记录肝内病变各时相参数。
1.2.2 CEUS检查:应用德国Philips IU22型彩色多普勒超声诊断仪,探头频率2~5MHz。常规二维超声全面检查肝脏,发现结节后观察其大小、位置,记录其形态、边界、内部回声与病灶血供等。选择病灶显示最清晰的切面进入超声造影双幅灰阶模式,经外周浅静脉快速注射由5mL溶解的2.4mL超声造影剂Sono Vue,震荡,微泡平均直径为2.5μm,以生理盐水溶解冻干粉、震荡混匀,后启动内置计时器,不间断实时观察可疑病灶动脉期、门脉期、延迟期灌注剂回声强度变化,记录动态图像并储存,观察5~8min,同CECT各期增强特点进行对照。
1.3 观察指标 (1)分析CECT及CEUS的影像学特点,CEUS检查结节恶性评估标准:以弱回声为主,病灶内CDFI血流特点以点状为主,指数范围在0.6~0.7,恶性病灶CECT特点:病灶为圆形或类圆形,CT平扫呈低密度改变,边界清晰或模糊,多期动态增强扫描主要为病灶CT值在动脉期密度上升,门静脉期密度下降,延迟期密度下降。无论是CECT还是CEUS,以病灶“快进快出”特征为肝癌诊断标准,即动脉期强化明显,门脉期与延迟期强化迅速减弱,并小于等于肝实质[4];(2)将DICOM动态造影数据导入Qontrast4.00软件进行脱机分析,选择病灶内部感兴趣区(ROI),将病灶完全纳入取样框中,依据ROI内造影剂随时间灌注情况绘制时间-强度(TIC)曲线,由软件自动计算出相关参数:开始增强时间、达峰时间、通过时间、灌注指数、造影峰强度、曲线尖度、曲线下面积(AUC);(3)评估CECT、CEUS对肝硬化小结节恶性的诊断价值。
1.4 统计学方法 采用SPSS 19.0软件处理数据,计数资料以%表示,采取χ2检验,计量资料以()表示,行t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 CECT、CEUS下各期强化程度比较 病理证实恶性结节40个,良性结节50个;恶性结节在动脉期呈高强化,门脉期等或低强化,平衡期低强化,且与CECT比较差异有统计学意义(P<0.05);良性结节在CEUS与CECT各期强化程度比较差异无统计学意义(P>0.05)。见表1。

表1 CECT、CEUS下各期强化程度比较
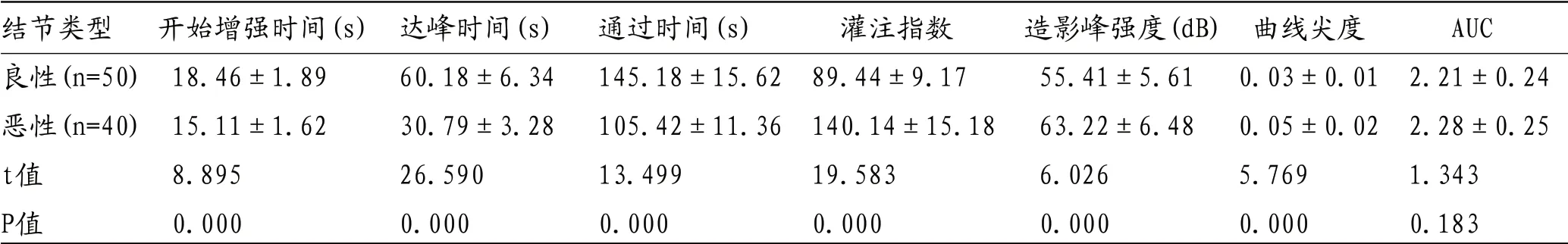
表2 CEUS参数比较
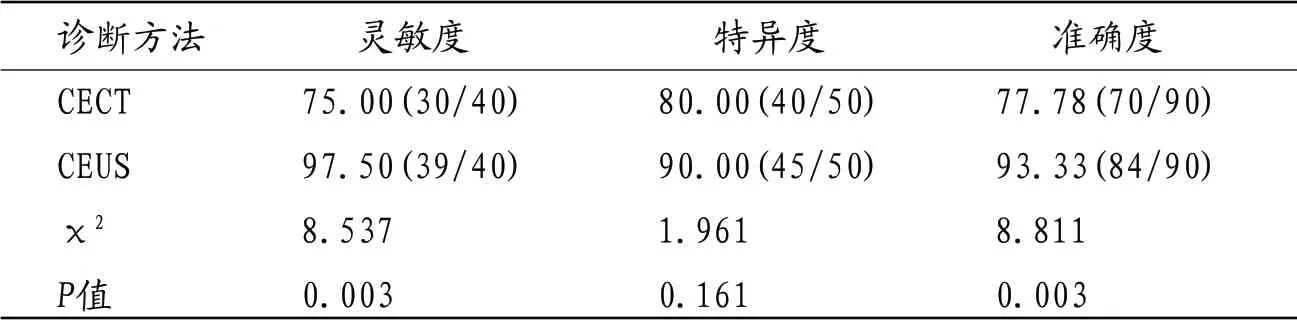
表3 CECT与CEUS的诊断价值比较
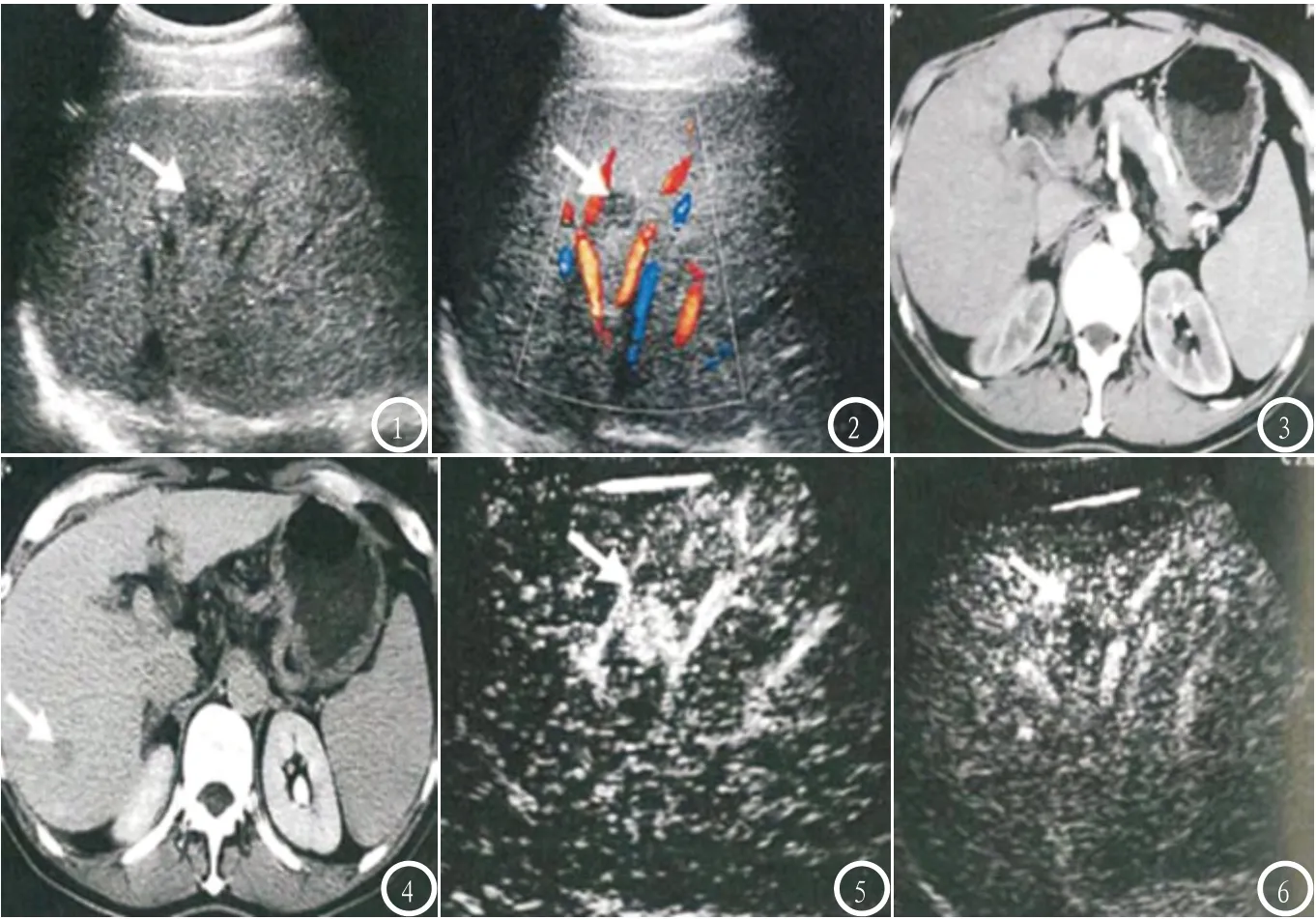
图1-2 常规灰阶显示肝硬化伴肝右叶低回声结节,大小约为14mm×13mm(图1),彩超未见病灶血流信号(图2);图3-4 增强CT显示动脉期病灶呈稍高密度(图3),而门脉期病灶强化减退(图4),符合小肝癌表现;图5-6 CEUS显示低回声结节动脉相呈高增强(图5),病灶轮廓清呈低增强,符合肝癌声像(图6)。
2.2 CEUS参数比较 CEUS下,良性结节开始增强时间、达峰时间、通过时间较恶性结节延长,而灌注指数、造影峰强度、曲线尖度小于恶性结节(P<0.05),两者AUC比较差异无统计学意义(P>0.05)。见表2。
2.3 常规CECT与CEUS的诊断价值比较 常规CECT共检出恶性结节40个,良性结节50个,CEUS共检出恶性结节44个,良性结节46个。CEUS诊断肝硬化伴肝小结节恶性的灵敏度、准确度高于CECT(P<0.05),两者特异度比较差异无统计学意义(P>0.05)。见表3。
2.4 典型病例 见图1-6。
3 讨 论
目前采用的灰阶超声对肝硬化背景下肝癌进行筛查灵敏度不及CT或MRI,常规超声常无法正确辨认肝硬化背景下结节良恶性[5]。研究[6]发现结节在由良性向恶性演变过程中首先表现为血供变化,恶性程度高,结节内门静脉供血下降明显,肿瘤新生动脉逐渐增多,结节内动脉供血可出现减少并再增加的变化,而CEUS正是利用超声对比剂与机体组织间较大的声特性阻抗差异,而人为增加含对比剂的血液与相邻组织间声阻抗差,继而清晰显示含对比剂的细小血流信号和微血管灌注,使超声对于结节良恶性的鉴别能力有所提高[7]。
本研究显示,恶性结节在动脉期呈高强化,门脉期等或低强化,平衡期低强化,且与CECT比较差异有统计学意义,良性结节在CEUS与CECT各期强化程度比较差异无统计学意义,这与既往研究[8-9]结果显示,提示肝硬化伴恶性肝小结节者在CECT与CEUS下的强化方式、血流灌注与良性结节有明显差异。在肝癌的病理过程中,通常由门静脉、肝动脉血供基础的不典型结节不断转化演变发展为以肝动脉为主的肝癌。肝硬化癌变一般需经历再生结节、低度增生不良结节、高度增生不良结节、早期肝癌与典型肝癌节段,在这一演变过程中,结节的血供可随之发生变化,肝窦毛细血管与新的血管生成会使原来因肝门脉供血为主的结节演变为以肝动脉供血为主,因而典型的增强表现为动脉期强化明显,门脉期与平衡期迅速消退,因此恶性结节多表现为快进慢出、快进同出增强模式[10]。而良性结节则表现多样,可能是因其增生结节的血管随时间改变而演变,但增生结节多因门脉供血,也可由门脉与动脉双重血供,因此其强化形式较多样[11]。但也有非典型病例,无特征性影像学表现,有较大重叠性,强化方式也较相似,因而CECT不能准确进行鉴别,而CEUS则能动态观察不同性质的肝占位性病变在延迟期、动脉期与静脉期所产生的特征性改变,从而达到鉴别结节良恶性的目的。
CEUS下良性结节开始增强时间、达峰时间、通过时间较恶性结节延长,而灌注指数、造影峰强度、曲线尖度小于恶性结节,两者AUC比较差异无统计学意义,这与李洁等[12]的报道结果一致。提示恶性结节以肝动脉供血为主,其微血管密度较大,血流灌注量大、流速快,单位时间内造影剂进入瘤体中明显增多,病灶强化程度明显,即在TIC曲线上呈始增、达峰时间短、曲线尖度大、灌注峰值高等特点,可据此特点将其与良性结节进行鉴别[13]。
CEUS诊断肝硬化伴肝小结节的灵敏度、准确度高于CECT,两者特异度比较差异无统计学意义,这与张宏春等[14]的报道结果相近,肯定了CEUS在肝硬化肝小结节上的诊断价值,但其在显示邻近脏器侵犯、门脉及腔静脉内癌栓、远处转移等方面具有一定局限性。
综上所述,CEUS与常规CECT在肝硬化伴小结节病灶的良恶性判断上有一定提示意义,二者各具优势。
