桂郁金SSR-PCR反应体系的建立及优化
2020-07-06靳雅惠
靳雅惠
(西安外事学院,陕西 西安 710077)
桂郁金是姜科植物广西莪术CurcumakwangsiensisS. G. Lee et C. F. Liang 的干燥块根,是《中国药典》规定的郁金的来源之一,具有活血止痛,行气解郁等功效[1],常用于胸胁刺痛,胸痹心痛等症的治疗。随着临床上药材需求的不断增加,桂郁金作为郁金的主要来源,产量占比60%[2]。然而,桂郁金种质资源丰富,且存在着较大的差异性,种质资源没有一套完善的评价标准。所以,迫切需要从分子水平着手,揭示不同种质内在的差异性,从基因角度筛选出优良种质,为桂郁金的临床用药等方面提供帮助。
简单重复序列(simple sequence repeat,SSR),是一种重复单元,通过1~6个核苷酸串联重复序列组成[3]。它以PCR反应为基础,目前已经广泛应用到功能基因研究[4],遗传多样性分析[5],遗传图谱构建[6]等方面的研究。SSR-PCR体系重复性高,稳定性好,却极易受到引物,模板,以及2×Taq PCR MasterMix(Tap DNA 聚合酶,dNTPs,缓冲液等)因素的影响。目前,尚未见对桂郁金SSR-PCR反应体系建立与优化的报道,因此,笔者研究可以为桂郁金遗传多样性等相关研究提供参考。
1 材料
实验所用不同种质的桂郁金材料均采自邕宁桂郁金种植基地,经广西中医药大学王建教授鉴定均为桂郁金,即广西莪术CurcumakwangsiensisS. G. Lee et C. F. Liang 的干燥块根。PCR使用的Mix PCR MIX(包括Tap DNA 聚合酶,dNTPs,缓冲液等)是2x浓缩的PCR扩增预混合溶液,从博瑞克公司购入。要进行PCR,只用在体系中加入模板及引物,不但去掉了复杂的操作过程,还大大节约了时间。实验所使用的引物为国外已经公布的姜黄属通用引物。序列为5’→3’(AACGAAGTCGGTGGCGGGAGGTCAAGAACGGTAGG)。通过上海生工合成。
2 方法
2.1 DNA提取
取桂郁金嫩叶0.5~1.0 g,采用杨妮[7]等改良CTAB法进行DNA提取,紫外分光光度计被用以检测DNA的质量及浓度。
2.2 SSR-PCR反应体系的正交设计
运用L9(33)正交设计,对DNA模板,引物以及2×Taq PCR MasterMix的含量进行考察。如表1所示。每次试验均加入适量的ddH2O,使反应体系的总量为15μL。
2.3 SSR-PCR反应程序的正交设计
SSR-PCR反应程序采用L16(44)正交设计,对退火时间、变性时间、循环次数、延伸时间进行考察,以期获得最佳的反应程序。如表2所示。
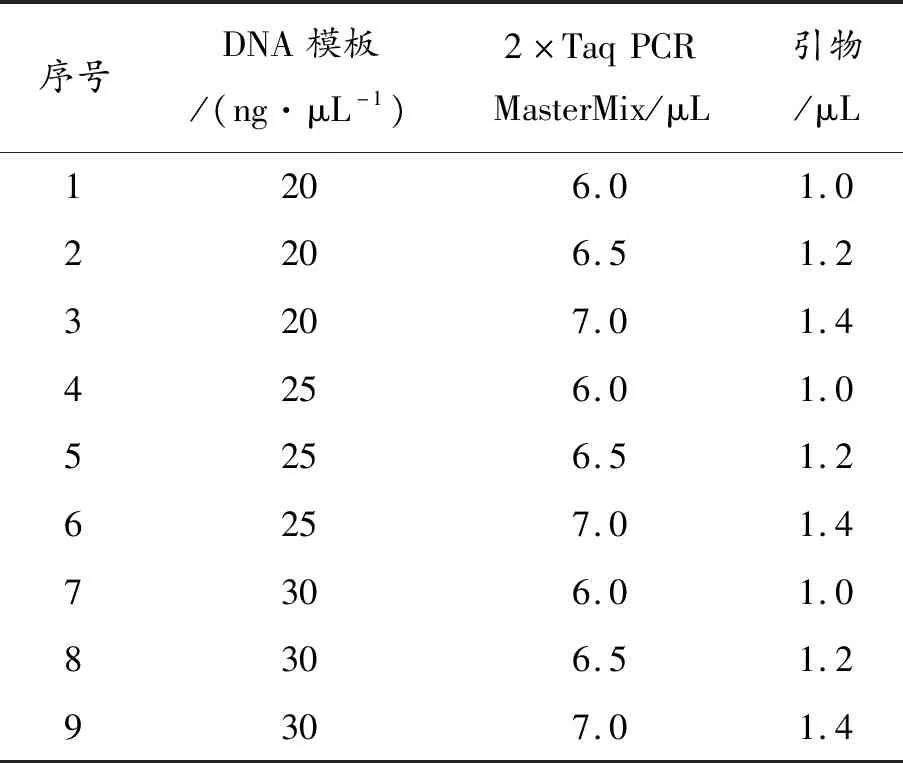
表1 SSR-PCR反应体系正交设计
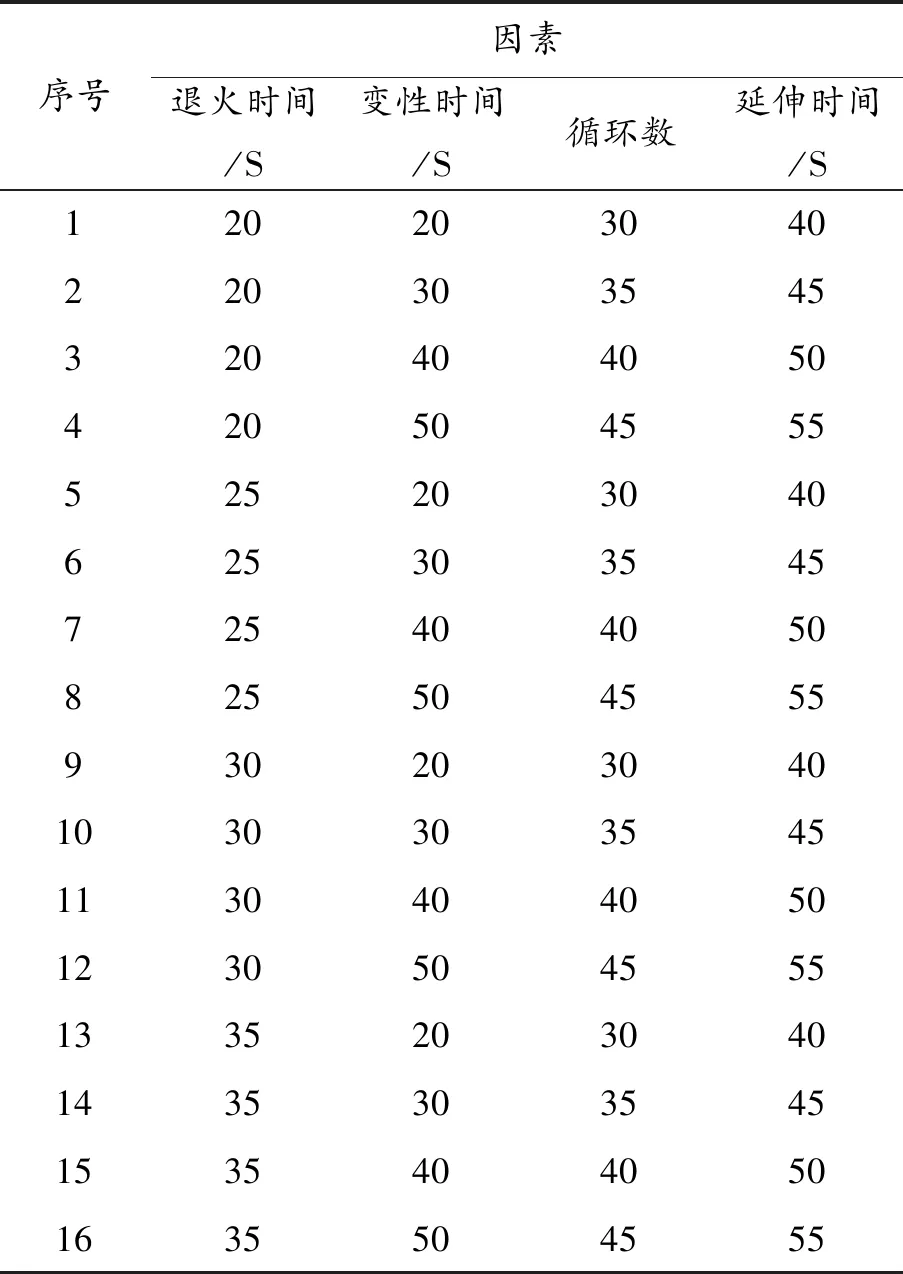
表2 SSR-PCR反应程序的正交设计
2.4 退火温度的选择
在上述SSR-PCR反应体系建立的基础上,设定温度梯度:54.0℃、54.5℃、55.0℃、55.5℃、56.0℃、56.5℃,筛选出最佳的退火温度。
2.5 非变性聚丙烯酰胺凝胶电泳
PCR反应产物用聚丙烯酰胺凝胶电泳(8%)检测,以此来确定最优的反应体系、反应程序、退火温度以及体系的稳定性和适用性等内容。
3 结果分析
3.1 DNA质量与浓度检测
采用紫外分光光度计对提取得到的桂郁金DNA的质量和浓度进行检测,OD260/OD280值为1.8~2.0,浓度50μg·mL-1,此结果表明,该DNA可用于后续实验。
3.2 SSR-PCR反应体系的优化
对实验建立的9个不同组合进行分析与优化,由于模板,引物以及MIX含量的不同,结果差异明显。如图1所示。9个组合均能扩增出条带,5,7,8,9反应体系扩增得到的条带弱,特异性差,2,3,4,6反应体系扩增得到的条带较清晰,其中反应体系4条带多,特异性最好。即在15μL体系中,DNA模板2.5μL,引物1.0μmol·L-1,2×Taq PCR MasterMix为6μL,其中Tap DNA聚合酶0.05 U·μL-1,Mg2+3.0 mmol·L-1,dNTPs0.3 mmol·L-1,加ddH2O至15μL。
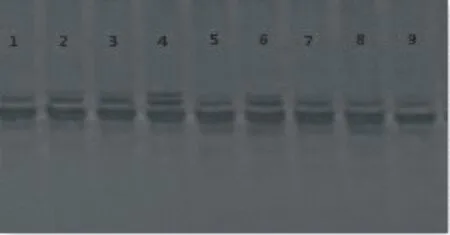
图1 桂郁金SSR-PCR反应体系 L9(33)正交设计试验扩增效果
3.3 SSR-PCR反应程序的优化
对实验所建立的16组SSR-PCR反应程序的不同组合进行分析与优化,结果如图2所示。组合条件的不同导致了扩增条带的差异。表现为条带的颜色深浅不同,效果存在着较大区别。组合2,13,14条带较浅,稳定性也较差,反应体系不理想,综合实验结果,反应程序10条带清晰,稳定性较好,因此将反应程序10(变性30 s,退火30 s,延伸45 s,循环35次)作为最优方案。
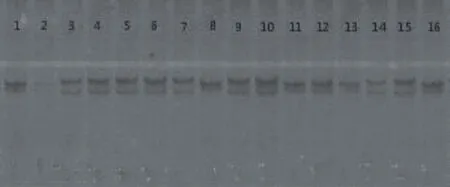
图2 桂郁金SSR-PCR反应程序L16(44)正交设计试验扩增效果
3.4 退火温度的确定
退火温度的确定是利用以上确定的最佳反应体系及反应程序进行的,本梯度试验的范围是54.0~56.5℃。结果如图3所示。当温度低于54.5℃时,主带不清晰,且有许多较浅的杂带,当温度超过55.5℃时,条带的稳定性以及多态性下降。在退火温度为55℃时,条带的清晰度,稳定性等均较好,由此确定55.0℃为最佳的退火温度。
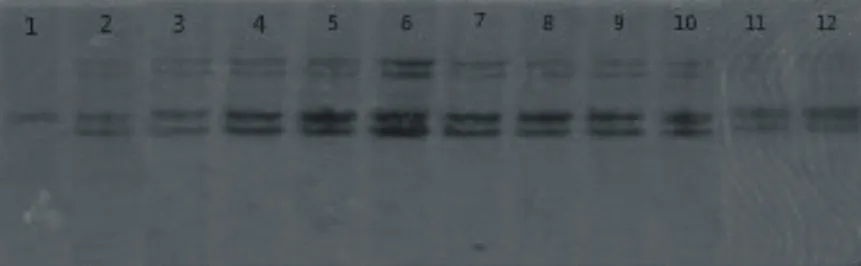
1-2: 54.0℃、3-4:54.5℃、5-6:55.0℃、7-8:55.5℃、
3.5 优化体系的验证
采用10份不同种质的桂郁金材料对优化得到的体系进行验证。扩增结果如图4所示,10份桂郁金材料均可以扩增出清晰、多态性高、重复性好的条带,由此也证明了该优化体系的合理性和适用性。
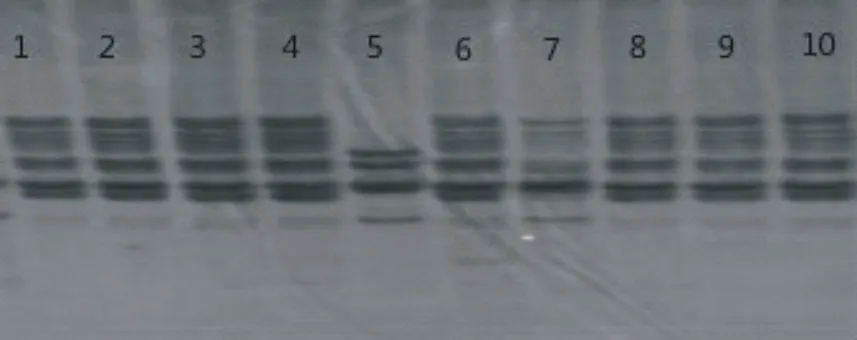
图4 10份桂郁金材料扩增效果
4 讨论
桂郁金遗传多样性分析以及种质筛选等研究是以SSR-PCR反应体系,反应程序,退火温度的建立与优化为前提和基础进行的。由于不同植物类别并没有一套通用的SSR-PCR反应体系,因此建立适合桂郁金的SSR-PCR反应体系是十分必要的。该体系受到了多方面的影响,包括DNA浓度,引物浓度以及2×Taq PCR MasterMix含量的相互作用。笔者实验与传统的SSR-PCR反应体系建立与优化略有不同,传统的SSR-PCR反应体系是采用单因素考察的方法,对体系内各种组分进行含量的确定,虽然结果直观,却忽略了系统的整体性,即各组分之间的相互影响与内在联系。笔者实验采用正交优化的方法,正好弥补了单因素考察的缺陷,充分权衡了组分内在的关联,而且缩短了实验周期,省时省力。传统的SSR-PCR反应体系的建立与优化,通常是考察5种因素对该体系的影响,包括(DNA模板,引物,Tap DNA聚合酶,Mg2+,dNTP),笔者实验采用了2×Taq PCR MasterMix,将原本复杂的5因素变成了3因素,使反应体系的建立与优化化繁为简,为后续的实验提供了便利。笔者实验建立了可用性高,稳定性好的桂郁金SSR-PCR反应体系,通过10份桂郁金材料得到验证。
在PCR反应中,适合的退火温度是确保引物以及目的序列可以顺利退火的关键因素。如果退火温度过低,就会增加非特异性结合的机率,从而使杂带数量增加;如果退火温度过高,那么就可能导致不能完全退火或者无法退火,从而导致无法扩增。为了加快实验进程,笔者实验采用的引物是国外已经公布的姜黄属通用引物,而引物碱基的组成,长度等因素恰恰影响着退火的时间和温度。在后续试验中,应该涉及到桂郁金引物开发的相关内容,在该体系的基础上继续优化,设计并筛选出多态性好,重复性高的引物,使桂郁金的SSR-PCR反应体系更加完善,适合于分析桂郁金的遗传多样性以及筛选优良种质资源等研究。
