基于Nrf2/HO-1通路研究芹菜素改善妊娠期糖尿病大鼠氧化应激损伤
2020-07-04杨丽赵岗樊秀梅吴玲玲田淑卿
杨丽 赵岗 樊秀梅 吴玲玲 田淑卿
[摘要] 目的 基于Nrf2/HO-1通路探討芹菜素对妊娠期糖尿病大鼠氧化应激损伤的影响。 方法 选用高脂喂养的36只妊娠SD大鼠,腹腔注射链脲佐菌素方法建立妊娠期糖尿病大鼠模型,按照随机数字表法将其分为模型组、芹菜素组(50 mg/kg)、ML385组(Nrf2/HO-1通路抑制剂,剂量为20 mg/kg)、芹菜素+ML385组(芹菜素剂量为50 mg/kg,ML385剂量为20 mg/kg),每组9只。另取9只设为对照组。分组处理后,测量各组大鼠空腹血清血糖(FSG)、三酰甘油(TG)、总胆固醇(TC)水平、肝组织病理变化;检测大鼠血清中白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)水平,肝组织超氧化物歧化酶(SOD)、丙二醛(MDA)水平和Nrf2/HO-1通路蛋白表达。 结果 与对照组比较,模型组大鼠肝组织呈现结构紊乱,伴有炎症细胞浸润,肝细胞变性、坏死,胞质固缩、深染等病理损伤,FSG、TG、TC、血清中TNF-α及IL-6水平、肝组织MDA水平显著升高(P < 0.05),肝组织SOD水平、Nrf2、HO-1蛋白表达显著降低(P < 0.05);与模型组比较,ML385组大鼠肝组织病理损伤加重,FSG、TG、TC、血清中TNF-α及IL-6水平、肝组织MDA水平升高(P < 0.05),肝组织SOD水平、Nrf2、HO-1蛋白表达降低(P < 0.05);与模型组比较,芹菜素组大鼠肝组织病理损伤减轻,FSG、TG、TC、血清中TNF-α及IL-6水平、肝组织MDA水平降低(P < 0.05),肝组织SOD水平、Nrf2、HO-1蛋白表达升高(P < 0.05);与ML385组比较,芹菜素+ML385组大鼠肝组织病理损伤减轻,FSG、TG、TC、血清中TNF-α及IL-6水平、肝组织MDA水平降低(P < 0.05),肝组织SOD水平、Nrf2、HO-1蛋白表达升高(P < 0.05)。 结论 芹菜素可通过激活Nrf2/HO-1通路改善妊娠期糖尿病大鼠氧化应激损伤。
[关键词] Nrf2/HO-1;芹菜素;妊娠期糖尿病;氧化应激损伤
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-7210(2020)05(a)-0027-05
Study on apigenin improvement of oxidative stress injury in diabetic rats based on Nrf2/HO-1 pathway
YANG Li1 ZHAO Gang2 FAN Xiumei2 WU Lingling3 TIAN Shuqing1
1.Department of Obstetrics, Xingtai Maternal and Child Health Hospital, Hebei Province, Xingtai 054000, China; 2.Department of Obstetrics, Xingtai Third Hospital, Hebei Province, Xingtai 054000, China; 3.Department of Gynecology, the Second Affiliated Hospital of Xingtai Medical College, Hebei Province, Xingtai 054000, China
[Abstract] Objective To study the effect of apigenin on oxidative stress injury in gestational diabetic rats based on Nrf2/HO-1 pathway. Methods Thirty-six pregnant SD rats of high-fat feeding were selected, the gestational diabetes rat model was established by intraperitoneal injection of chain urea with cephalosporins method, according to the random number table method they were divided into model group, apigenin group (50 mg/kg), ML385 group (Nrf2/HO-1 pathway inhibitor, dose of 20 mg/kg), apigenin + ML385 group (apigenin dose of 50 mg/kg, ML385 dose of 20 mg/kg), with 9 mice in each group. Another 9 mice were set as the control group. After grouping, the levels of fasting serum blood glucose (FSG), triglyceride (TG), total cholesterol (TC) and pathological changes of liver tissue were measured; the serum levels of interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) were measured, and the levels of superoxide dismutase (SOD), malonic dialdehyde (MDA) and Nrf2/HO-1 pathway protein expression of rats in each group were detected. Results Compared with the control group, the liver tissue of the model group showed structural disorder, accompanied by inflammatory cell infiltration, hepatocyte degeneration, necrosis, cytoplasm contraction, deep staining and other pathological damage, the levels of FSG, TG, TC, serum TNF-α and IL-6, and MDA in liver tissue increased significantly (P < 0.05), and SOD level, Nrf2, HO-1 protein expressions in liver tissue were significantly decreased (P < 0.05). Compared with the model group, the pathological damage of liver tissue in ML385 group was aggravated, the levels of FSG, TG, TC, serum TNF-α and IL-6, and MDA in liver tissue increased significantly (P < 0.05), and SOD level, Nrf2, HO-1 protein expressions in liver tissue were significantly decreased (P < 0.05). Compared with the model group, the pathological damage of liver tissue in the apigenin group was alleviated, the levels of FSG, TG, TC, serum TNF-α and IL-6, and MDA in liver tissue decreased significantly (P < 0.05), and SOD level, Nrf2 and HO-1 protein expressions in liver tissue were significantly increased (P < 0.05). Compared with ML385 group, the pathological damage of liver tissue in apigenin+ML385 group was alleviated, the levels of FSG, TG, TC, serum TNF-α and IL-6, and MDA in liver tissue decreased significantly (P < 0.05), and SOD level, Nrf2 and HO-1 protein expressions in liver tissue were significantly increased (P < 0.05). Conclusion Apigenin can improve oxidative stress injury in gestational diabetic rats by activating Nrf2/HO-1 pathway.
[Key words] Nrf2/HO-1; Apigenin; Gestational diabetes mellitus; Oxidative stress injury
妊娠期糖尿病(gestational diabetes mellitus,GDM)是妊娠期首次被发现的糖代谢异常现象,发病率较高,在中国约为7.0%,可造成高危妊娠,大大提高了早产、流产等的发生率,并可增加子代患肥胖、糖尿病及心血管疾病的风险,严重影响母婴健康[1-2]。GDM发病机制复杂,其中抗氧化能力下降导致的氧化应激损伤是其主要因素[3]。芹菜素是多种水果和蔬菜的重要活性成分,具有抗炎、抗氧化作用,可用于治疗糖尿病,并改善糖尿病引发的扩张型心肌病及肝损伤[4-5]。Nrf2/HO-1是机体内源性保护体系之一,当机体受到氧化应激等刺激时,Nrf2激活并上调下游HO-1的表达,进而发挥抗氧化应激损伤作用,在糖尿病氧化应激损伤病理过程中发挥着重要作用,上调Nrf2/HO-1通路,可抑制氧化应激,减轻糖尿病引发的肾脏炎症损伤[6-7],而芹菜素可通过上调Nrf2、HO-1基因表达、转录而抑制叔丁基过氧化氢诱导的氧化应激,保护大鼠原代肝细胞[8],因此推测芹菜素可通过上调Nrf2/HO-1通路改善GDM大鼠氧化应激损伤,本研究通过建立GDM大鼠模型,对此进行探讨。
1 对象与方法
1.1 实验动物
55只雌性SD大鼠(浙江维通利华实验动物技术有限公司),SPF级,6周龄,体重200~240 g,许可证号为SCXK(浙)2019-0001;邢台医专第二附属医院动物房中饲养,维持其环境安静清洁、通风良好,温度约为25℃,相对湿度约为50%,大鼠自由进食、饮水,定时清洗、消毒鼠笼。
1.2 主要仪器与试剂
普通飼料及高脂饲料均购自上海普路腾生物科技有限公司,高脂饲料配方:普通繁殖鼠料54.6%、猪油16.9%、蔗糖14%、酪蛋白10.2%、预混料2.1%、麦芽糊精2.2%。芹菜素(中国药品生物制品鉴定所,含量:99.6%,批号:111901-201206);链脲佐菌素(美国Sigma公司,货号:S0130);ML385(美国medchemexpress公司,货号:HY-100523);超氧化物歧化酶(SOD)检测试剂盒(上海钰博生物科技有限公司,货号:IC-SOD-Ra);丙二醛(MDA)检测试剂盒(上海信裕生物科技有限公司,货号:xy-30182);大鼠白细胞介素(IL)-6及肿瘤坏死因子-α(TNF-α)ELISA试剂盒、兔源GAPDH、Nrf2及HO-1一抗、羊抗兔二抗(美国Abcam公司,货号分别为:ab100772、ab100785、ab181602、ab137550、ab13243、ab150077);RIPA裂解液、BCA试剂盒、HE染色试剂盒(上海碧云天公司,货号分别为:P0013K、P0011、C0105)。
全自动生化分析仪:美国BECKMAN公司;RM2035轮转切片机:德国Leica公司;SMZ745光学显微镜:日本尼康公司,上海欣软信息科技有限公司;Elx800酶标仪:美国Perkin Elmer公司;1659001蛋白电泳仪、Trans-Blot SD转膜仪:美国Bio-Rad公司;2500凝胶成像系统:上海天能公司。
1.3 实验分组及处理
参照文献[9]制备妊娠期糖尿病大鼠模型:以高脂饲料喂养雌性SD大鼠8周后,检测空腹血清血糖(fasting serum glucose,FSG),将FSG≥6.67 mmol/L大鼠剔除。雌雄大鼠合笼,次日清晨阴道涂片镜检发现精子者为妊娠大鼠,以25 mg/kg剂量腹腔注射链脲佐菌素1次,72 h后检测FSG,6.67 mmol/L≤FSG≤16.67 mmol/L的大鼠为造模成功的大鼠。共造模42只,成功36只,采用随机数字表法将其分为模型组、芹菜素组、ML385组、芹菜素+ML385组,每组9只。另取9只正常饲料喂养的妊娠母鼠作为对照组,腹腔注射25 mg/kg生理盐水,最终用于实验的大鼠共45只。
芹菜素和ML385分别以生理盐水配制终浓度为5 mg/mL芹菜素溶液[10]、2 mg/mL ML385溶液[11]、芹菜素+ML385(浓度分别为5、2 mg/mL)混合溶液,芹菜素组、ML385组、芹菜素+ML385组大鼠每天以10 mL/kg剂量灌胃,模型组与对照组以等剂量生理盐水灌胃,持续14 d。
1.4 观察指标及检测方法
1.4.1 血糖、血脂测定及标本采集 用药结束24 h时,麻醉后处死大鼠,腹主动脉取血约4 mL。其中约3 mL血液全自动生化分析仪测定大鼠FSG、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)含量;剩余血液离心后收集上清液即为血清,-80℃备用待用。解剖后取出肝脏,剪取1 g组织加入蛋白裂解液,使用匀浆机制备为匀浆液,离心后收集上清液储存于-80℃备用;其余组织经生理盐水漂洗后,4%多聚甲醛固定、低浓度到高浓度的梯度酒精脱水、二甲苯透明、石蜡包埋,然后使用切片机做病理切片备用。
1.4.2 大鼠肝组织病理变化情况检测 选取“1.2.2”中完好切片经脱蜡、高浓度到低浓度梯度酒精处理后,参照苏木精-伊红(HE)染色试剂盒说明书进行染色,再次脱水、透明后封片,使用光学显微镜观察肝组织病理改变情况。
1.4.3 肝组织中SOD、MDA水平及血清TNF-α、IL-6水平测定 “1.2.2”项下蛋白裂解上清液、血清置于4℃冰箱中冻融,各取0.5 mL,参照说明书使用SOD、MDA检测试剂盒及TNF-α、IL-6 ELISA试剂盒分别测定其中MDA、SOD水平及TNF-α、IL-6水平。
1.4.4 肝组织中Nrf2、HO-1蛋白水平检测 参照说明书使用BCA试剂盒测定“1.2.4”项下冻融的各组蛋白裂解上清液中总蛋白浓度,根据测定结果调整各组蛋白样品浓度至相同,取相同体积的各组蛋白样品进行电泳分离蛋白,然后将其转移至PVDF膜上,置于5%脱脂奶粉溶液中,室温封闭2 h,根据目的蛋白分子量截取相应蛋白条带置于小盒中,加入兔源Nrf2、HO-1一抗,4℃孵育过夜,TBST缓冲液漂洗后加入羊抗兔二抗,室温孵育2 h,TBST缓冲液清洗后采用ECL显色,置于凝胶成像仪中拍照,并采用Quantity One软件分析各组蛋白的相对表达量。
1.5 统计学方法
采用SPSS 24.0软件进行数据分析,计量数据以平均数±标准差(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较行LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果
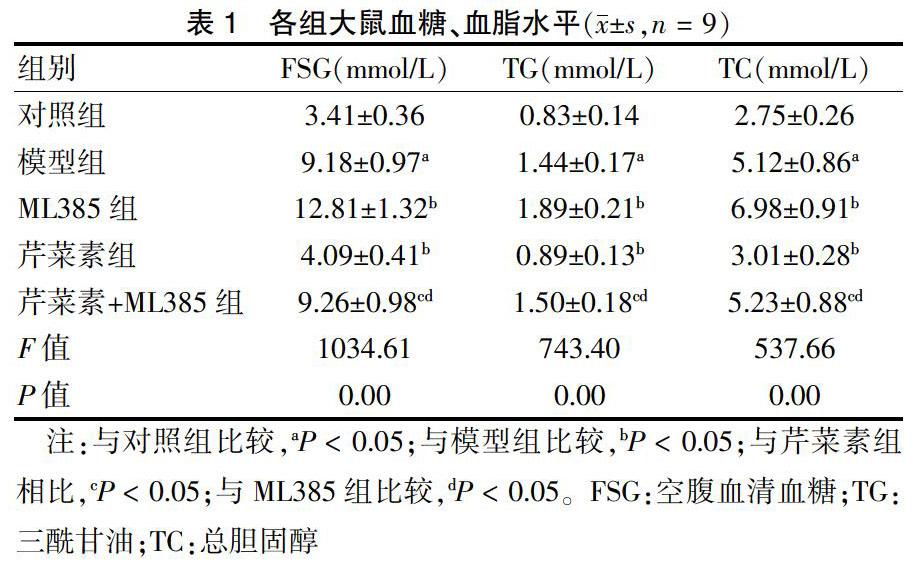
2.1 各组大鼠糖脂代谢情况比较
与对照组比较,模型组大鼠FSG、TG、TC水平显著升高(P < 0.05)。与模型组比较,ML385组大鼠FSG、TG、TC水平升高,芹菜素组大鼠FSG、TG、TC水平降低(P < 0.05)。与芹菜素组比较,芹菜素+ML385组大鼠FSG、TG、TC水平升高(P < 0.05)。与ML385组比较,芹菜素+ML385组大鼠FSG、TG、TC水平降低(P < 0.05)。见表1。
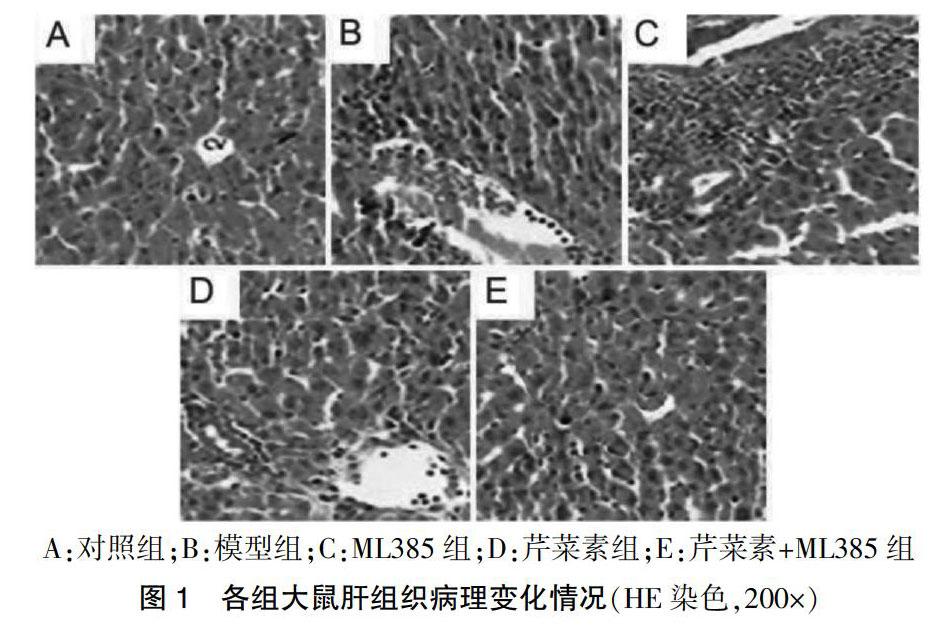
2.2 各组大鼠肝组织病理变化比较
对照组大鼠肝组织排列紧密,结构正常,肝细胞胞质丰富,无病理改变;模型组大鼠肝组织呈现结构紊乱,伴有炎症细胞浸润,肝细胞变性、坏死,胞质固缩、深染等病理损伤;ML385组大鼠上述病理损伤加重;芹菜素组大鼠上述病理损伤减轻;芹菜素+ML385组大鼠上述病理损伤重于芹菜素组,轻于ML385组。见图1。
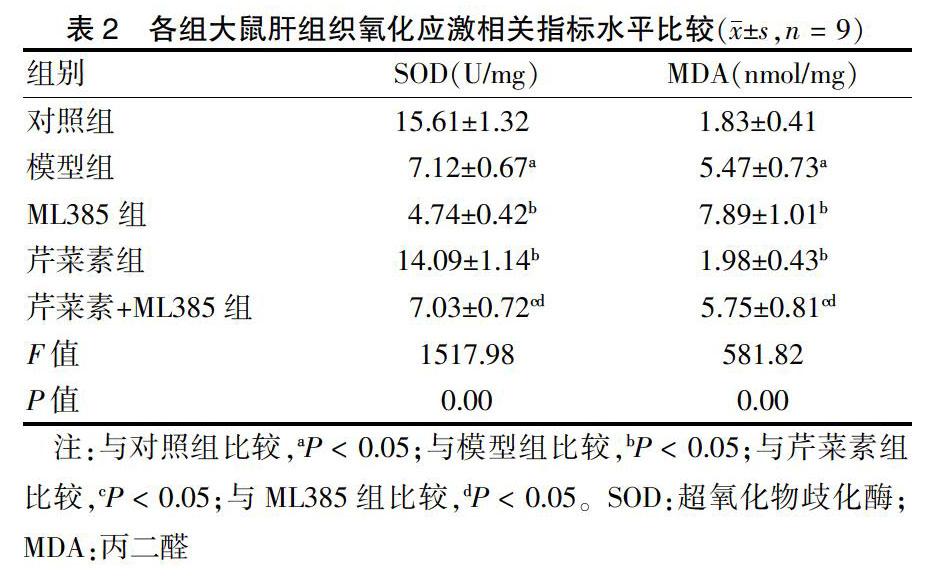
2.3 各组大鼠肝组织氧化应激相关指标比较
与对照组比较,模型组大鼠肝组织MDA水平显著升高(P < 0.05),SOD水平显著降低(P < 0.05)。与模型组比较,ML385组大鼠肝组织MDA水平升高,SOD水平降低(P < 0.05);芹菜素组大鼠肝组织MDA水平降低,SOD水平升高(P < 0.05)。与芹菜素组比较,芹菜素+ML385组大鼠肝组织MDA水平升高,SOD水平降低(P < 0.05)。与ML385组比较,芹菜素+ML385组大鼠肝组织MDA水平降低,SOD水平升高(P < 0.05)。见表2。
2.4 各组大鼠血清中TNF-α、IL-6水平比较
与对照组比较,模型组大鼠血清中TNF-α、IL-6水平显著升高(P < 0.05)。与模型组比较,ML385组大鼠血清中TNF-α、IL-6水平升高,芹菜素组大鼠血清中TNF-α、IL-6水平降低(P < 0.05)。与芹菜素组比较,芹菜素+ML385组大鼠血清中TNF-α、IL-6水平升高(P < 0.05)。与ML385组比较,芹菜素+ML385组大鼠血清中TNF-α、IL-6水平降低(P < 0.05)。见表3。
表3 各组大鼠血清中TNF-α、IL-6水平比较(x±s,n = 9)
注:与对照组比较,aP < 0.05;与模型组比较,bP < 0.05;与芹菜素组比较,cP < 0.05;与ML385组比较,dP < 0.05。TNF-α:肿瘤坏死因子-α;IL-6:白细胞介素-6
2.5 各组大鼠肝组织Nrf2/HO-1通路蛋白表达比较
与对照组比较,模型组大鼠肝组织Nrf2、HO-1蛋白表达显著降低(P < 0.05)。与模型组比较,ML385组大鼠肝组织Nrf2、HO-1蛋白表达降低,芹菜素组大鼠肝组织Nrf2、HO-1蛋白表达升高(P < 0.05)。与芹菜素组比较,芹菜素+ML385组大鼠肝组织Nrf2、HO-1蛋白表达降低(P < 0.05)。与ML385组比较,芹菜素+ML385组大鼠肝组织Nrf2、HO-1蛋白表达升高(P < 0.05),見图2、表4。
3 讨论
GDM是孕妇围生期常发疾病之一,严重影响母体及子代健康,近年来发病率呈上升趋势,目前临床治疗GMD以口服降糖药及注射胰岛素为主,但长期服药或注射胰岛素对母体健康及胎儿发育有一定危害,寻找更安全有效的治疗手段是临床亟需解决的问题[12]。GMD患者机体抗氧化能力下降,引发体内氧自由基过剩,造成细胞膜脂质过氧化损伤,肝脏作为机体调控糖脂代谢最重要的器官,对氧化应激反应很敏感。因此,妊娠期糖尿病患者极易出现肝损伤,影响肝功能,最终造成血糖、血脂升高[13-14]。SOD和MDA为检测氧化应激水平的指标,TNF-α、IL-6可引发炎性反应并促使其进展[15-16],经链脲佐菌素处理的孕鼠血清TNF-α及IL-6水平、肝组织MDA水平显著升高,肝组织SOD水平显著降低,提示链脲佐菌素引发大鼠炎症,造成肝脏氧化应激损伤,模型建立成功。
芹菜素能够增强链脲佐菌素所致糖尿病大鼠的抗氧化能力,降低血脂,减轻氧化应激造成的心肌损伤[17]。Nrf2/HO-1在糖尿病肾病、糖尿病大鼠脑缺血损伤病理过程中具有重要的调节作用,激活时可清除体内自由基,减轻炎症及氧化应激损伤[18-19],芹菜素可促进Nrf2、HO-1蛋白表达,抑制氧化应激反应,对衰老小鼠发挥保护作用[20],因而推测芹菜素可能通过激活Nrf2/HO-1信号增强机体抗氧化能力,进而改善GDM大鼠氧化应激损伤。以芹菜素处理模型大鼠后,可减轻大鼠肝组织病理损伤,降低血清FSG、TG、TC、TNF-α、IL-6水平及肝组织MDA水平,升高肝组织SOD水平、Nrf2及HO-1蛋白表达,提示芹菜素可上调Nrf2/HO-1信号表达,缓解氧化应激及炎症损伤,降低血糖、血脂水平。本研究发现,下调Nrf2/HO-1通路表达可减轻芹菜素对GMD大鼠的抗氧化应激作用,抑制其降低GDM大鼠血糖、血脂的作用,提示芹菜素是通过激活Nrf2/HO-1信号增强机体抗氧化作用,进而改善GDM大鼠氧化应激损伤。
综上所述,芹菜素可增强GDM大鼠抗氧化能力,抑制炎性反应,减轻肝脏氧化应激损伤,降低其血糖、血脂水平,激活Nrf2/HO-1信号通路是其药理机制之一,为临床GDM的治疗提供新的参考,但芹菜素对Nrf2/HO-1信号下游的影响本文未涉及,因而其改善GDM大鼠氧化应激损伤的更全面确切的作用机制并未完全阐明,还需后续深入研究。
[参考文献]
[1] Yan L,Feng J,Cheng F,et al. Circular RNA expression profiles in placental villi from women with gestational diabetes mellitus [J]. Biochem Biophys Res Commun,2018, 498(4):743-750.
[2] Liu J,Wang SZ,Wang QL,et al. Gestational diabetes mellitus is associated with changes in the concentration and bioactivity of placental exosomes in the maternal circulation across gestation [J]. Eur Rev Med Pharmacol Sci,2018,22(7):2036-2043.
[3] Hajifaraji M,Jahanjou F,Abbasalizadeh F,et al. Effect of probiotic supplements in women with gestational diabetes mellitus on inflammation and oxidative stress biomarkers: a randomized clinical trial [J]. Asia Pac J Clin Nutr,2018, 27(3):581-591.
[4] Liu HJ,Fan YL,Liao HH,et al. Apigenin alleviates STZ-induced diabetic cardiomyopathy [J]. Mol Cell Biochem,2017,428(1/2):9-21.
[5] 刘爽,崔卫正.芹菜素对链脲佐菌素诱导糖尿病大鼠肝损伤的影响[J].国际中医中药杂志,2015,37(4):335-338.
[6] 冯晓红,黄琦,金若晨,等.波动性高血糖对糖尿病大鼠肾脏HO-1γ-GCS及Nrf2表达影响[J].浙江临床医学,2017,19(19):2188.
[7] Shen X,Hu B,Xu G,et al. Activation of Nrf2/HO-1 Pathway by Glycogen Synthase Kinase-3?魴2 Inhibition Attenuates Renal Ischemia/Reperfusion Injury in Diabetic Rats [J]. Kidney Blood Press Res,2017,42(2):369-378.
[8] Huang CS,Lii CK,Lin AH,et al. Protection by chrysin,apigenin,and luteolin against oxidative stress;is mediated by the Nrf2-dependent up-regulation of heme oxygenase 1 and;glutamate cysteine ligase in rat primary hepatocytes [J]. Arch Toxicol,2013,87(1):167-178.
[9] 徐文婷,汤梦雨,王彩红,等.葛根素对妊娠期糖尿病大鼠糖脂代谢作用的研究[J].南京中醫药大学学报,2019, 35(4):448-452.
[10] 候丹,许光远,吴丽丽,等.芹菜素对2型糖尿病合并非酒精性脂肪肝小鼠脂代谢紊乱的作用及机制研究[J].上海中医药杂志,2018,52(11):64-68.
[11] Singh A,Venkannagari S,Oh KH,et al. Small Molecule Inhibitor of NRF2 Selectively Intervenes Therapeutic Resistance in KEAP1-Deficient NSCLC Tumors [J]. ACS Chem Biol,2016,11(11):3214-3225.
[12] Yamamoto JM,Kellett JE,Balsells M,et al. Gestational Diabetes Mellitus and Diet: A Systematic Review and Meta-analysis of Randomized Controlled Trials Examining the Impact of Modified Dietary Interventions on Maternal Glucose Control and Neonatal Birth Weight [J]. Diabetes Care,2018,41(7):1346-1361.
[13] Shang M,Dong X,Hou L. Correlation of adipokines and markers of oxidative stress in women with gestational diabetes mellitus and their newborns [J]. J Obstet Gynaecol Res,2018,44(4):637-646.
[14] Zheng ZP,Tian F,Zheng ZG,et al. Effect of metformin combined with Liuwei Dihuang pill on serum illness-related molecule contents in T2DM patients with NAFLD [J]. J Hainan Med Univ,2016,22(10):40-43.
[15] 罗浩,王娜,陈彩宇,等.氧化应激在孕期糖尿病致子代大鼠肾脏多巴胺D1受体功能障碍中的作用[J].中华心血管病杂志,2019,47(5):393-398.
[16] Xu H,Qin W,Hu X,et al. Lentivirus-mediated overexpression of OTULIN ameliorates microglia activation and neuroinflammation by depressing the activation of the NF-κB signaling pathway in cerebral ischemia/reperfusion rats [J]. J Neuroinflammation,2018,15(1):83-99.
[17] 刘爽,崔卫正.芹菜素对鏈脲佐菌素致糖尿病大鼠调节血脂和抗氧化作用研究[J].中国医药,2015,10(7):985-989.
[18] 孙倩,曾诚,段薇娜,等.DJ-1/Nrf2信号通路在不同时期糖尿病大鼠肾脏损伤中的机制[J].热带医学杂志,2017,17(10):13-16,157.
[19] Wang F,He Q,Wang J,et al. Neuroprotective effect of salvianolate lyophilized injection against cerebral ischemia in type 1 diabetic rats [J]. Bmc Complement Altern Med,2017,17(1):258-269.
[20] Sang Y,Zhang F,Wang H,et al. Apigenin exhibits protective effects in a mouse model of d-galactose-induced aging via activating the Nrf2 pathway [J]. Food Funct,2017,8(6):2331-2340.
(收稿日期:2019-12-03 本文编辑:刘永巧)
