动脉粥样硬化生物学标志物生物信息学技术分析
2020-07-04邵光耀杨军
邵光耀 杨军
[摘要] 目的 对动脉粥样硬化(AS)病人基因芯片数据进行分析,寻找AS发生发展相关的潜在基因。
方法 下载GEO数据库中高通量基因芯片数据集GSE43292和GSE28829,行GO基因功能注释和通路分析,然后进行蛋白相互作用网络分析并可视化。
结果 经过数据分析,将差异表达基因在不同的生物学过程中富集,共筛选出了24个关键基因,文献检索显示其中的MMP9、CXCR4、FABP4基因与AS相关。
结论 通过数据分析筛选出的24个差异表达基因,可为AS的分子诊断和治疗开发提供算法预测和数据分析支持。
[关键词] 动脉粥样硬化;生物标记;计算生物学;数据分析
[中图分类号] R543.5
[文献标志码] A
[文章编号] 2096-5532(2020)03-0347-05
doi:10.11712/jms.2096-5532.2020.56.123
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20200610.2131.016.html;2020-06-11 17:05
A BIOINFORMATICS ANALYSIS OF BIOMARKERS FOR ATHEROSCLEROSIS
SHAO Guangyao, YANG Jun
(Department of Cardiology, Yantai Yuhuangding Hospital Affiliated To Qingdao University, Yantai 264000, China)
[ABSTRACT]ObjectiveTo investigate the potential genes associated with the development and progression of atherosclerosis (AS) by analyzing the gene chip data of patients with AS.
MethodsHigh-throughput gene chip datasets GSE43292 and GSE28829 were downloaded from the GEO database. The gene ontology function annotation and pathway analysis were performed, followed by protein-protein interaction network analysis and visualization.
ResultsAfter data analysis, the differentially expressed genes were enriched in different biological processes, and 24 key genes were screened out. Literature search showed that MMP9, CXCR4, and FABP4 were associated with AS.
ConclusionThe 24 differentially expressed genes screened out by data analysis can provide the support of algorithmic prediction and data analysis for the development of molecular diagnosis and treatment of AS.
[KEY WORDS]atherosclerosis; biomarkers; computational biology; data analysis
動脉粥样硬化(AS)是由于动脉的变窄限制了富氧血液流向身体各个部位,从而引发AS相关临床表现的疾病。AS与血管壁的炎症过程、较高的低密度脂蛋白(LDL)水平具有相关性[1],但导致该疾病的分子机制仍不清楚。AS的风险因素有很多,如胆固醇异常、高血压、糖尿病、吸烟、肥胖、家族史和不健康的饮食等。传统的危险因素,如高血压、糖尿病等,在预测AS方面有一定作用[2],但不能完全预测AS风险,因此寻找更敏感的生物标志物,是当前研究急需解决的问题。寻找生物标志物有助于阐明疾病的分子机制,为疾病发生发展的预测提供更精确的证据。随着基因测序及芯片技术的发展和成本不断降低,生物信息学技术被广泛用于分析疾病的基因组层面的变化,这些技术有助于识别芯片数据涉及的差异表达基因和功能通路。虽然不同厂商的芯片数据差异较大,但不同研究间还是可能具有共同的差异表达基因。因此,本研究下载并分析了来自美国国家生物技术信息中心(NCBI)GEO数据库的2个芯片数据集,以获得AS组织和非AS组织的差异表达基因,寻找AS发生发展相关的潜在生物学标志物。
1 资料和方法
1.1 数据来源
以“atherosclerosis”作为关键词,在NCBI的GEO数据库(www.ncbi.nlm.nih.gov/geo)中检索已公布的AS的基因芯片数据集,获取分别于2013年4月和2011年4月发表的两个基因表达数据集GSE43292和GSE28829。GSE43292数据集来源于里昂第一大学和北奥斯陆大学,采用Affymetrix Human Gene 1.0 ST Array平台,含有32个AS样本和32个正常样本的表达矩阵;该数据集选择的是爱德华·赫里欧医院的32例患有AS的病人,男女
比例为29∶5,平均年龄为(70±10)岁,患有慢性肾脏疾病、糖尿病、自身免疫性疾病和正在进行类固醇或其他免疫抑制药物治疗的病人均被排除在外。GSE28829来源于马斯特里赫特大学,采用Affymetrix Human Genome U133 Plus 2.0 Array平台,含有14个AS样本和14个正常样本的表达矩阵;该数据集选择的是慕尼黑伊利诺伊州立医院的尸体和血管外科手术切除的颈动脉组织。
1.2 差异表达基因筛选及可视化
采用R语言的limma包进行基因的差异表达分析,差异表达基因的筛选条件为差异倍数log fold change>1.5、adjust<0.05;应用R语言的plot数据包进行画图与展示。
1.3 差异表达基因的功能富集分析
使用DAVID在线数据库进行GO基因功能分析[3],并用KEGG数据库进行差异表达基因的通路分析。以P<0.05为具有统计学差异的标准筛选基因并进行可视化展示。
1.4 蛋白相互作用网络分析
本研究使用STRING数据库(http://string-db.org)(版本10.0)进行蛋白相互作用网络分析,构建差异表达基因的蛋白相互作用网络,选择综合分数大于0.4的主要蛋白相互作用网络,将得到的蛋白相互作用网络导入Cytoscape软件中进一步分析。Cytoscape(3.4.0版)是一个开源生物信息学软件平台,用于可视化分子交互网络。使用Cytoscape软件绘制蛋白相互作用网络,并使用MCODE模块以MCODE scores>5、degree cut-off=2、node scorecut-off=0.2、Max depth=100、k-score=2为标准确定网络中重要的区域,并进行画图。
1.5 关键基因筛选
对上述网络进行画图得到可能与AS相关的基因。为了验证所得到的基因是否与AS有关,通过检索文献获得研究支持。
2 结果
2.1 原始数据的标准化
进行差异分析之前,为避免原始的基因矩阵中出现缺失值、基因对应多个探针等情况,应用R语言的limma包中normalize Between Arrays函数进行数据的标准化,随后进行可视化。经标准化处理后两个芯片数据集的数据分布效果较好(图1),可以进行下一步差异分析。
2.2 标准化数据的聚类分析
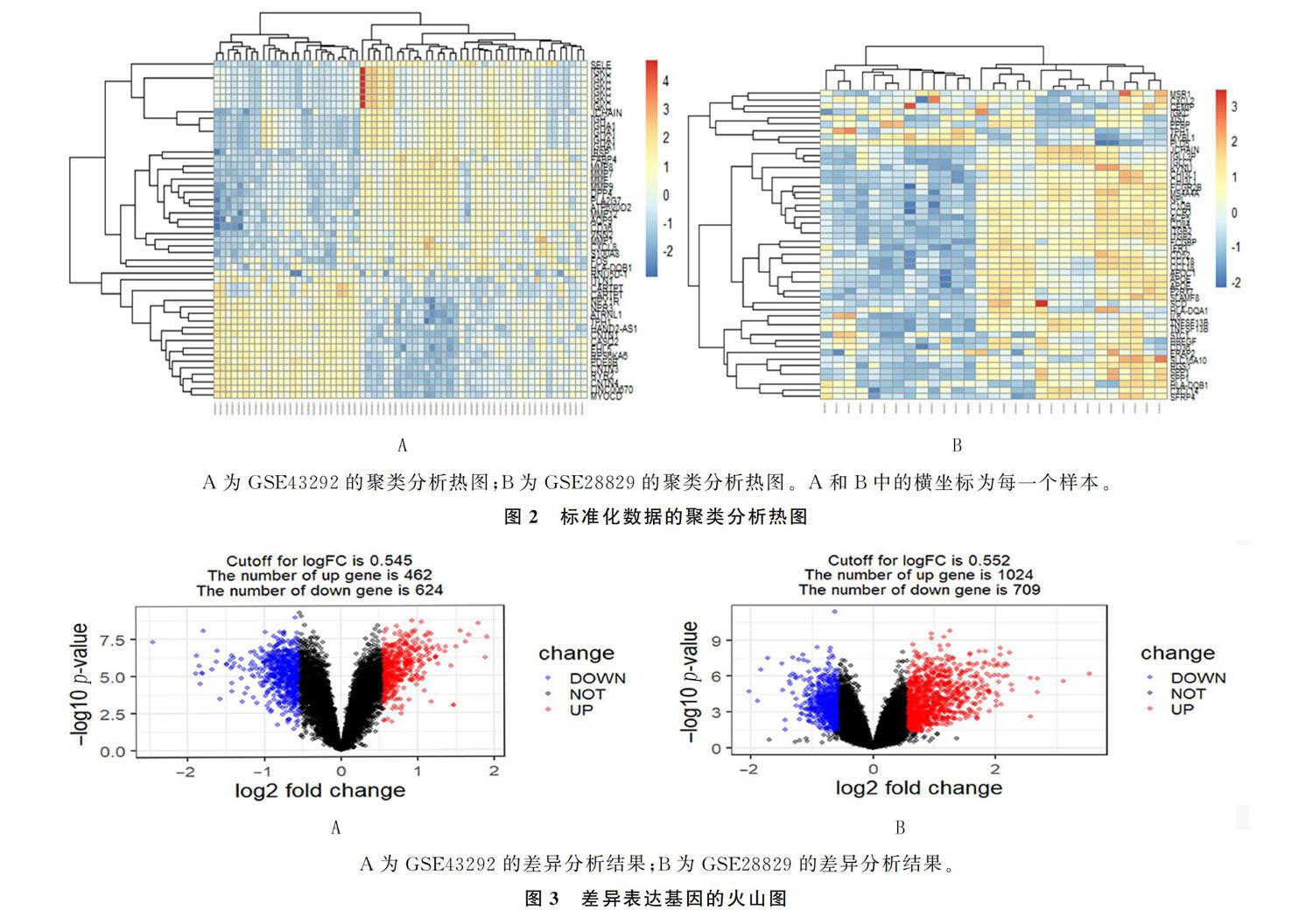
使用R语言对标准化的GSE43292、GSE28829数据集进行聚类分析并绘制热图(图2)。结果表明,GSE43292、GSE28829数据集中发现了聚类的现象,提示在样本中出现了某些基因的富集。
2.3 差异表达基因的筛选
GSE43292数据集经筛选后得到1 086个基因,其中上调基因462个,下调基因624个;GSE28829数据集经筛选后得到1 733个基因,其中上调基因1 024个,下调基因709个。基因筛选后制作火山图进行可视化,见图3。
2.4 差异表达基因的功能分析及通路分析
数据集GSE28829的富集分析表明,差异表达基因的细胞组分变化主要富集在细胞表面、血浆膜外侧、细胞外体、细胞外区域、细胞基质等,生物学过程主要富集在免疫球蛋白受体结合、免疫反应、炎症反应等。GSE43292的富集分析表明,差异表达基因的细胞组分变化主要富集于细胞外区域、细胞外基质、细胞基质等,生物学过程主要富集在cAMP信号通路、细胞黏附通路、环状体强化和色氨酸代谢通路等。见图4。
2.5 差异表达基因的蛋白相互作用网络分析
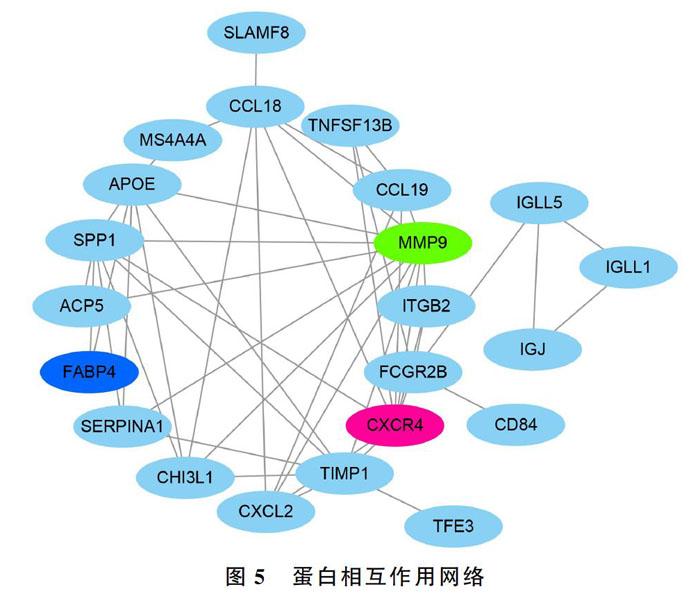
本研究得到可能導致AS的潜在关键基因共24个:MMP9、ACP5、SPP1、FABP4、CD84、ITGB2、CHI3L1、FCGR2B、KYNU、SLAMF8、CXCL2、CXCR4、CCL18、CCL19、PL2B、TNFSF13B、APOE、MS4A4A、TIMP1、SERPINA1、IGLL5、IGL5、IGJ、TFE3、IGLL5。进行相关文献检索结果显示,MMP9、FABP4、CXCR4基因与AS相关。见图5。
3 讨论
AS的主要病因因素有很多,包括血液中较高水平的胆固醇和LDL、血液中低水平的高密度脂蛋白(HDL)、高血压、烟草烟雾、糖尿病、肥胖、不健康的生活方式、家族心脏病史等。然而,该疾病的分子机制仍然没有被阐明。随着分子生物学发展和成本降低,基因分析、精准治疗成为新的诊断及治疗手段。本研究使用R语言对GSE43292和GSE28829数据集进行聚类分析并绘制热图,结果表明,在这两个数据集中发现了差异表达基因聚类的现象。通过功能富集及通路分析探索差异表达基因的功能注释信息,并使用R语言绘制功能分析及通路分析的条形图,结果显示,差异表达基因细胞组分主要集中在血浆膜外侧、细胞基质等,生物学过程主要富集在cAMP信号通路、细胞黏附通路等。再通过构建蛋白相互作用网络筛选出了24个关键基因,经文献检索显示,其中的MMP9、FABP4、CXCR4基因与AS相关。
3.1 MMP9基因与AS相关性
纤维帽的细胞外基质成分与冠状动脉AS斑块的稳定性有关,其厚度与斑块的稳定性呈正相关。MMPs是一种蛋白酶系,其作用可加速纤维帽细胞外基质分解,进而导致斑块破裂。MMPs可降解很多细胞外基质,如胶原、弹性蛋白、纤维连接蛋白等。MMP9是MMPs中的一种明胶酶,它可以分解粥样斑块和纤维帽中内皮基底膜的Ⅳ型胶原,增加斑块的不稳定性,进而引发斑块的破裂[4]。本研究结果表明,MMP9基因与AS的不稳定性相关。提示MMP9可能是AS的潜在生物标志物。
已有实验研究验证了MMP9和AS斑块破裂的相关性[5]。有研究表明,高脂肪摄入的动物相较于低脂肪摄入组具有更高水平的MMP9表达[6]。也有研究应用网络药理学方法预测一种治疗高脂血症的传统中药的作用靶基因可能为MMP9[7]。
3.2 FABP4基因與AS相关性
脂肪酸结合蛋白(FABPs)是游离脂肪酸的伴侣蛋白,可与胆固醇、花生四烯酸可逆性结合。该蛋白主要表达在脂肪和巨噬细胞中,参与脂肪酸的转运及脂肪分解,促进三酰甘油在脂肪细胞中的沉积,参与AS的病程。有研究显示,FABP4通过作用于脂蛋白酯酶,使血浆游离脂肪酸水平升高,而血浆游离脂肪酸水平升高又可以导致高三酰甘油血症的形成,进而参与斑块进展;在氧化低密度脂蛋白诱导的巨噬细胞形成泡沫细胞的过程中,FABP4基因表达上调,加速了泡沫细胞中胆固醇和三酰甘油的积累,从而参与斑块的进展[8]。另有研究结果显示,FABP4在代谢综合征的冠心病病人中表达升高,并且其表达与冠状动脉AS程度和表皮脂肪组织体积有相关性[9]。也有研究显示,FABP4可以成为AS的独立预测标志物[10]。有回顾性分析研究显示,血清FABP4水平与外周血管疾病的不良心血管事件具有相关性[11]。有成年小鼠的基因测序研究显示,心脏内皮细胞中FABP4的表达更高,FABP4可能成为未来AS的重要靶基因标志物[12]。
3.3 CXCR4基因与AS相关性
CXCR是基质细胞衍生因子-1的受体,参与内皮损伤、修复过程。业已证实,内皮细胞的损伤诱发的细胞黏附、血小板聚集等过程,参与了AS过程的开启。CXCR4可介导平滑肌细胞向损伤区域的动员,促进损伤区域血管内膜的增生,进而参与内膜的修复过程。有研究表明,内皮细胞中CXCR4的缺失,可降低细胞的增殖,进而影响创面的愈合,加速巨噬细胞浸润,从而导致AS过程的进展[13]。此外,有实验研究表明,小鼠CXCR4的敲除或抑制阻断了CXCL12对TCF21和ABCA1表达的影响,以及GSK3β和β-catenin的磷酸化,而小鼠中过度表达CXCL12可扩大AS病变区域,可能导致AS斑块中巨噬细胞的渗透[14]。
有研究表明,使用新型CXCR4定向正电子发射断层扫描示踪剂,相较于传统的正电子发射断层扫描示踪剂能够检测出更多的AS斑块[15-16]。另有研究表明,CXCR4在B-1细胞中的表达与血浆中针对malondialdehyde-modified LDL的IgM抗体呈正相关,与冠状动脉斑块的程度呈负相关[17]。有基因研究显示,BPIFB4可能调节CXCR4,参与小鼠AS和炎症进展,这为未来的基因治疗AS提供了可能[18]。有研究显示,CXCL12与CXCR4结合可能是AS的新治疗靶点[19]。也有研究显示,亚临床心血管疾病病人CXCR4表达降低,提示CXCR4可能是亚临床心血管疾病的保护基因[20]。
综上所述,本研究共确定了24个关键基因,其中文献支持MMP9、CXCR4和FABP4基因与AS相关,它们可能是AS的生物标志物。除MMP9、FABP4和CXCR4外,其他的21个基因在本研究中差异同样具有统计学意义,也可能与AS相关,但需要进一步的研究来阐明这些基因与AS发生发展的相关性。本研究结果可为AS的分子诊断和治疗开发提供算法预测和数据分析支持。
[参考文献]
[1]HIGHASHI Y, NOMA K, YOSHIZUMI M, et al. Endothelial function and oxidative stress in cardiovascular dieases[J]. Circulation Journal, 2009,73:411-418.
[2]李坤,唐震宇. 生物学标志物与颈动脉粥样硬化易损斑块关系的研究进展[J]. 实用临床医学, 2017,18(2):100-103.
[3]ASHBURNER M, BALL C A, BLAKE J A, et al. Gene ontology: tool for the unification of biology. The Gene Ontology Consortium[J]. Nature Genetics, 2000,25(1):25-29.
[4]李红平. 氨基末端脑钠肽前体和超敏心肌肌钙蛋白T在慢性心力衰竭患者中的检测意义[J]. 中国医药指南, 2012,10(11):201-202.
[5]CHEN Peipei, CHEN Yuexin, WU Wei, et al. Identification and validation of four hub genes involved in the plaque deterioration of atherosclerosis[J]. Aging, 2019,11(16):6469-6489.
[6]LUDVIGSEN T P, PEDERSEN S F, VEGGE A, et al. 18F-FDG PET/MR-imaging in a Gttingen Minipig model of athe-
rosclerosis: correlations with histology and quantitative gene expression[J]. Atherosclerosis, 2019,285:55-63.
[7]LEE A Y, PARK W, KANG T W, et al. Network pharmacology-based prediction of active compounds and molecular targets in Yijin-Tang acting on hyperlipidaemia and atherosclerosis[J]. Journal of Ethnopharmacology, 2018,221:151-159.
[8]FURUHASHI M, HOTAMISLIGIL G S. Fatty acid-binding proteins: role in metabolic diseases and potential as drug targets[J]. Nature Reviews Drug Discovery, 2008,7(6):489-503.
[9]GORMEZ S, ERDIM R, AKAN G, et al. Relationships between visceral/subcutaneous adipose tissue FABP4 expression and coronary atherosclerosis in patients with metabolic syndrome[J]. Cardiovasc Pathol, 2019,46:107192.
[10]FURUHASHI M, YUDA S, MURANAKA A, et al. Circulating fatty acid-binding protein 4 concentration predicts the progression of carotid atherosclerosis in a general population without medication[J]. Circ J, 2018,82(4):1121-1129.
[11]HOEBAUS C, HERZ C T, PESAU G, et al. FABP4 and cardiovascular events in peripheral arterial disease[J]. Angiology, 2018,69(5):424-430.
[12]LOTHER A, BERGEMANN S, DENG L, et al. Cardiac endothelial cell transcriptome[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2018,38(3):566-574.
[13]NOELS H, ZHOU B, TILSTAM P V, et al. Deficiency of endothelial CXCR4 reduces reendothelialization and enhances neointimal hyperplasia after vascular injury in atherosclerosis-prone mice[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2014,34(6):1209-1220.
[14]GAO J H, HE L H, YU X H, et al. CXCL12 promotes athe-
rosclerosis by downregulating ABCA1 expression via the CXCR4/GSK3β/β-cateninT120/TCF21 pathway[J]. Journal of Lipid Research, 2019,60(12):2020-2033.
[15]KIRCHER M, TRAN G J, KEMMER L, et al. Imaging inflammation in atherosclerosis with CXCR4-directed 68Ga-Pentixafor PET/CT-Correlation with 18F-FDG PET/CT[J]. Journal Nuclear Medicine, 2019,61(5):25.
[16]DERLIN T, SEDDING D G, DUTZMANN J, et al. Imaging of chemokine receptor CXCR4 expression in culprit and nonculprit coronary atherosclerotic plaque using motion-corrected[68Ga] pentixafor PET/CT[J]. European Journal of Nuclear Medicine and Molecular Imaging, 2018,45(11):1934-1944.
[17]UPADHYE A, SRIKAKULAPU P, GONEN A, et al. Diversification and CXCR4-dependent establishment of the bone marrow B-1a cell pool governs atheroprotective IgM production linked to human coronary atherosclerosis[J]. Circulation Research, 2019,125(10):e55-e70.
[18]PUCA A, CARRIZZO A, SPINELLI C, et al. Single systemic transfer of a human gene associated with exceptional longevity halts the progression of atherosclerosis and inflammation in ApoE knockout mice through a CXCR4-mediated mechanism[J]. Eur Heart J, 2019. doi:10.1093/eurheartj/ehz459.
[19]GAO Jiahui, YU Xiaohua, TANG Chaoke, et al. CXC chemokine ligand 12 (CXCL12) in atherosclerosis: an underlying therapeutic target[J]. Clinica Chimica Acta, 2019,495:538-544.
[20]MUELLER K, HANNA D B, EHINGER E, et al. Loss of CXCR4 on non-classical monocytes in participants of the Womens Interagency HIV Study (WIHS) with subclinical atherosclerosis[J]. Cardiovascular Research, 2019,115(6):1029-1040.
(本文編辑 马伟平)
[收稿日期]2019-12-04; [修订日期]2020-04-30
[基金项目]山东省自然科学基金资助项目(ZR2017LH004)
[第一作者]邵光耀(1993-),男,硕士研究生。
[通信作者]杨军(1964-),男,博士,主任医师,硕士生导师。E-mail:yangjunyhd@163.com。
