过表达MdCBF1基因提高植物抗冷性
2020-07-04毕思琦安建平郝玉金芮麟李彤韩月彭由春香
毕思琦 安建平 郝玉金 芮麟 李彤 韩月彭 由春香


摘要:本试验将从‘嘎啦苹果中克隆的MdCBF1转化到‘王林苹果愈伤组织和野生型拟南芥幼苗中,进行低温冷处理,观察并比较分析野生型与转MdCBF1材料在成活率和表达量间的差异,以研究MdCBF1基因对植株抗冷性的影响。结果显示,低温处理后,与野生型植株相比,转基因苹果愈伤组织抗冷性更高,转基因拟南芥成活率更高,抗冷性相关基因表达水平更高。可以看出,MdCBF1过表达能够显著提高植株的抗冷性,表明其在植物的冷胁迫响应过程中发挥着重要作用。
关键词:苹果;MdCBF1;冷胁迫;抗冷性
中图分类号:S661.103.4:Q786文献标识号:A文章编号:1001-4942(2020)04-0010-06
Abstract In order to explore the function of MdCBF1 in cold stress response at low temperature, we cloned the MdCBF1 gene from Gala apple (Malus×domestica) and transformed into Wanglin apple calli and wild Arabidopsis seedlings. After treated with low temperature, the changes in survival rate and gene expression levels were studied. The results showed that the cold tolerance of transgenic apple calli was higher than that of wild type; the survival rate and gene expression level of transgenic Arabidopsis seedlings were higher than those of wild type after low temperature treatment. In conclusion, the overexpression of MdCBF1 could significantly increase the cold tolerance of plants, which suggested that MdCBF1 play an important role in cold response of plant.
Keywords Apple;MdCBF1; Cold stress; Cold tolerance
低溫是一种重要的非生物胁迫,是影响植物生存和分布的重要因素之一。低温会使活性氧生成,导致植物产生氧化损伤[1],进而抑制植物的生长和发育,严重影响不耐寒作物的产量和品质[2],使植物遭受严重的伤害甚至死亡。但是,植物在面对低温胁迫时并不是完全被动的,它们能够快速感知逆境,并通过信号传递主动适应低温环境[3]。植物已经进化出了精确而有效的机制来感知和整合低温信号[4]。目前的研究表明,有超过1 000个基因诱导的冷胁迫响应,其中至少有170个基因编码转录因子(TFs)[5],包括MYB[4]、NAC[6]、bZIP和APETALA2/乙烯响应因子(AP2/ERF)家族[7,8]。在这些冷诱导转录因子中,CBF转录因子在调节下游冷响应基因中发挥着重要作用[9]。
植物中存在一个特殊的低温响应通路,由C重复序列结合因子/干旱应答元件结合蛋白(C-repeat binding factor/dehydration-responsive element binding factor,CBF/DREB1)这一植物特有的转录因子所主导[10],这类转录因子能与下游基因启动子中的CRT/DRE(C-repeat/dehydration responsive element)顺式作用元件相结合并激活下游抗逆基因的表达[11],引起脯氨酸、可溶性糖、叶绿素含量的提高[12],进而提高植物对低温非生物逆境胁迫的抗性[13]。CBF基因在冷胁迫响应中的调控已经得到了广泛的研究,KIN1、KIN2、RD29A和COR47等多种调节因子已被证明与CBF基因的转录相关[14,15]。CBF转录因子属于AP2/EREBP(apet-la2/ehylene responsive element binding protein)类转录因子亚家族[16],在高等植物中广泛存在,目前已从拟南芥、黑麦、水稻[17-19]等多个物种中分离得到了CBF基因。而在苹果中也已经分离得到5个CBF转录因子,即MdCBF1、MdCBF2、MdCBF3、MdCBF4、MdCBF5[20]。
苹果(Malus×domestica)是世界范围内最重要的水果作物之一,但是苹果品质和产量也容易受到低温的不良影响[21]。因此,研究苹果的低温响应机理,提高苹果植株对低温的适应性是十分必要的。先前的研究已经发现,[WTBX]MdDREB1[WTBZ]过表达能够增强植物对低温的耐受性[22]。鉴于CBF/DREB转录因子在低温胁迫中的重要性,为深入研究苹果抗冷调控基因,本研究将克隆自‘嘎啦苹果的MdCBF1基因转化到‘王林苹果愈伤组织和拟南芥中,初步探究MdCBF1表达对苹果和拟南芥抗冷性的影响,这将为研究植物低温冷胁迫响应过程提供一定的理论基础。
1 材料与方法
本试验于2018年6月—2019年5月在山东农业大学作物生物学国家重点实验室进行。
1.1 试验材料
试验所用植物材料有‘嘎拉(Royal Gala)幼苗,‘王林(Orin)苹果愈伤组织以及野生型拟南芥幼苗(Col-0)。从‘嘎拉苹果幼苗中提取cDNA用来克隆MdCBF1基因,‘王林苹果愈伤组织和拟南芥幼苗用来进行遗传转化。
1.2 试验方法
1.2.1 CBF蛋白序列获得和进化树分析 拟南芥(Arabidopsis thaliana)CBF基因及其蛋白序列来自TAIR数据库(http://www.arabidopsis.org),苹果CBF基因及其蛋白序列来自Apple GFDB数据库(http://gfdb.sdau.edu.cn/)。使用DNAMAN软件进行蛋白序列比对,使用MEGA软件进行进化树分析。
1.2.2 载体构建 根据之前已经报道的MdCBF1序列设计引物MdCBF1-F/R,以‘嘎拉苹果幼苗的cDNA为模板进行PCR扩增。之后将MdCBF1开放阅读框插入到转化后的pCAMBIA1300载体中,构造过表达载体MdCBF1-pCAMBIA1300。
1.2.3 获得转基因愈伤和拟南芥幼苗 将生长16 d的野生型苹果愈伤组织与携带MdCBF1-pCAMBIA1300的农杆菌共培养20 min,在共培养培养基(MS + 0.5 mg·L-1 IAA+1.5 mg·L-1 6-BA)上共培养1 d。用无菌水冲洗苹果愈伤组织三次,然后转移到添加300 mg·L-1羧苄青霉素和40 mg·L-1潮霉素的选择性培养基中进行转基因筛选。采用浸花法[23]转化野生型拟南芥获得转基因拟南芥。
1.2.4 冷胁迫处理 将培养8 d的野生型和转基因苹果愈伤组织在4℃条件下冷处理10 d,观察苹果愈伤组织的生长情况,并测定其鲜重。
生长10天的擬南芥幼苗在进行4℃低温驯化处理3 d后,将幼苗在-4℃条件下培养0.5 h;然后使幼苗在22℃条件下继续培养3 d。观察拟南芥植株的抗冻性,并统计其存活率[24]。
1.2.5 定量PCR分析 使用PlusReagent试剂盒(Tiangen,北京)提取RNA,使用PrimeScript 1st Strand cDNA Synthesis Kit(Takara,大连)试剂盒进行反转录。采用ABI7500型qRT-PCR系统进行定量PCR检测。
2 结果与分析
2.1 CBF蛋白序列比对和进化树分析
进化树分析表明,MdCBF1基因与其他CBF基因的亲缘关系均较近,尤其与AtCBF1亲缘关系更近(图1 A)。蛋白序列比对结果表明,AtCBF1、AtCBF2、AtCBF3、MdCBF1、MdCBF2、MdCBF3、MdCBF4和MdCBF5蛋白序列均含有保守的AP2结构域,符合AP2/EREBP类转录因子亚家族的特征(图1 B)。
2.2 MdCBF1在‘王林苹果愈伤组织中的表达情况
对野生型和转MdCBF1基因苹果愈伤组织进行4℃低温处理10 d,并以未进行低温处理的野生型和转基因苹果愈伤组织作对照,结果(图2)显示,在正常环境下,野生型和转 MdCBF1基因苹果愈伤组织形态上没有明显差别,鲜重差异也不显著;而4℃低温处理后,转基因苹果愈伤组织(MdCBF1-L1和MdCBF1-L2)的体积明显大于野生型苹果愈伤组织(WT),鲜重显著高于野生型。经实时荧光定量PCR检测(图2C),转MdCBF1基因苹果愈伤组织内抗冷性相关基因
(MdCBF1、MdRD29A、MdKIN1、MdCOR1)的表达水平显著高于野生型苹果愈伤组织,表明过表达MdCBF1能够显著提高抗冷性相关基因的表达,提高转基因愈伤组织的低温抗性。
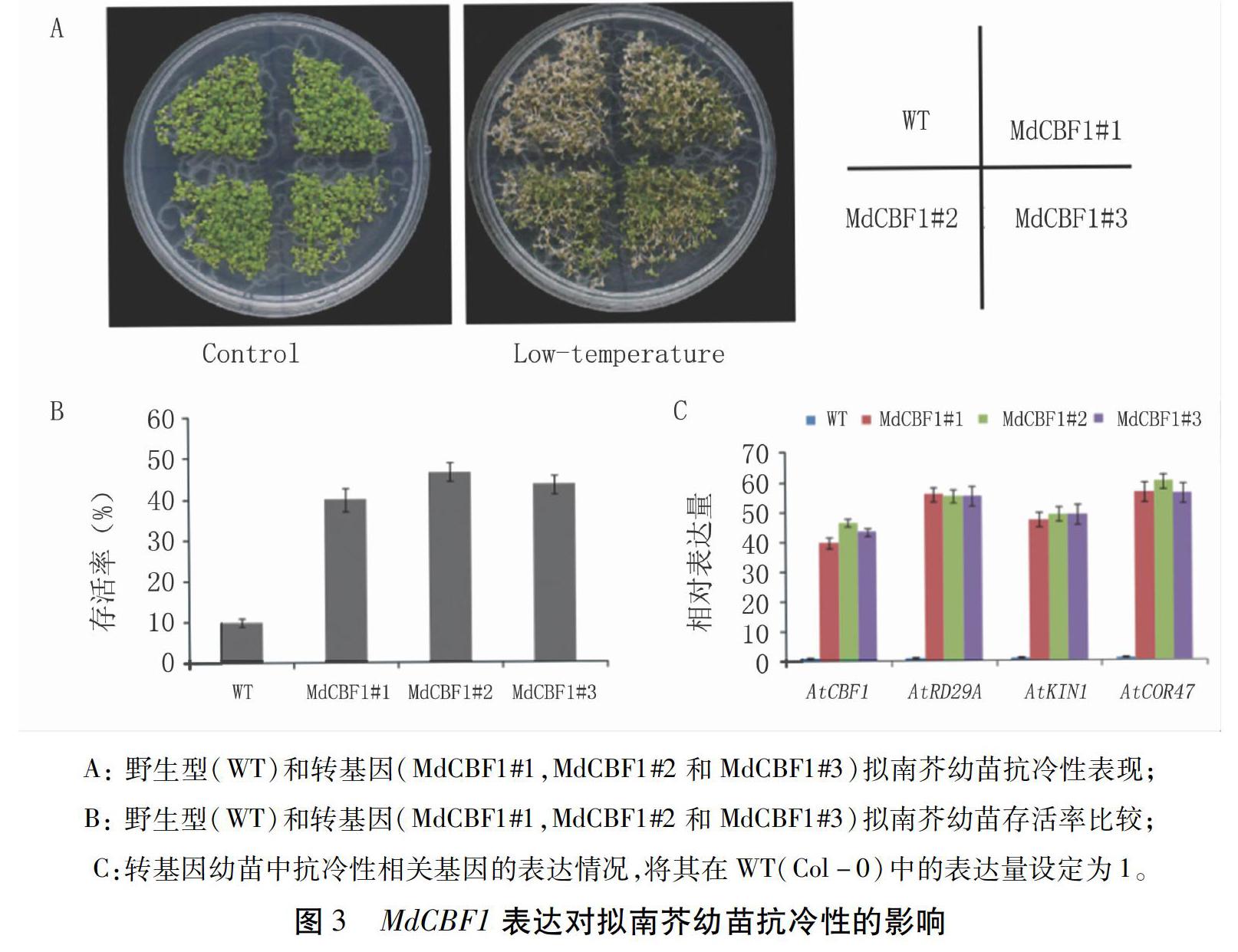
2.3 MdCBF1表达对拟南芥幼苗抗冷性的影响
为了进一步验证过表达MdCBF1对完整植株抗冷性的影响,对野生型及转MdCBF1基因拟南芥幼苗进行低温处理,并以未做低温处理的野生型和转 MdCBF1基因拟南芥幼苗作对照。可以看出,在正常环境下,转基因和野生型拟南芥幼苗表现没有明显差别;而在低温环境下,相比于野生型拟南芥的几乎全部死亡,转基因幼苗仍有大面积存活,转基因幼苗(MdCBF1#1、#2和#3)的存活率显著高于野生型(WT),达到40%~50%,而野生型拟南芥幼苗的存活率只有10%左右(图3A、B)。实时荧光定量PCR检测结果(图3C)显示,转MdCBF1基因拟南芥幼苗内抗冷性相关基因(AtCBF1、AtRD29A、AtKIN1、AtCOR47)表达水平显著高于野生型,表明过表达MdCBF1明显促进了拟南芥幼苗体内抗冷性相关基因的表达,提高了其抗冷性。
3 讨论与结论
在植物中,冷胁迫响应是一个复杂的过程,涉及许多冷响应基因,如KIN1、RD29A、COR47[25]等,这些基因被不同的转录因子调控。CBF转录因子作为一类关键的冷调节因子,直接调控冷响应基因的表达[5]。CBF信号通路在植物的冷胁迫响应中发挥重要作用,植物已经进化出精确的机制来传导这一信号通路[4]。除了CBF冷响应通路外,一些研究也发现,在冷响应中也存在不依赖于CBF的冷响应通路,这些不依赖于CBF的冷响应通路也在冷胁迫响应过程中发挥着不可忽视的作用[14]。在CBF冷响应通路中,冷信号激活耐冷基因COLD1的表达进而激活ICE1蛋白,而ICE1-CBF转录级联反应在植物的冷适应过程中起着重要作用,ICE1蛋白结合CBF转录因子促进其表达;CBF转录因子还可与COR基因启动子中的顺式元件结合并激活其表达[26]。这些研究都表明,CBF基因在参与植物逆境应答、提高植物抗逆性中发挥着关键作用。本试验中,过表达MdCBF1基因后,转基因苹果愈伤组织和拟南芥幼苗中的AtCBF1、AtRD29A、AtKIN1、AtCOR47等与抗冷性相关基因的表达水平显著升高,这表明MdCBF1能够直接调控这些基因的表达,很可能是通过调控这些基因的表达水平来参与植物低温冷胁迫响应过程的,这与前人的一些研究结果[14]相吻合。
CBF转录因子属于AP2/EREBP类转录因子亚家族[16],本试验结果显示MdCBF1蛋白序列中也含有保守的AP2结构域,也证明了这一点。在拟南芥CBF家族中,AtCBF1、AtCBF2和AtCBF3三个CBF基因受到低温的诱导表达[27],同时又调控着下游众多冷调节(cold-regulated,COR)基因的表达,它们构成了一个庞大的 CBF 调节组,在拟南芥低温响应过程中发挥着重要的作用[28]。在本研究中,MdCBF1基因与AtCBF1基因亲缘关系最近,表明MdCBF1基因与AtCBF1基因的功能类似;而后续的遗传转化试验结果也表明MdCBF1基因过表达显著提高了‘王林苹果愈伤和拟南芥幼苗的抗冷性,有效证明了MdCBF1基因在低温响应中同样起着不可忽视的作用。
综上所述,MdCBF1基因是苹果中的关键抗冷调控基因,其对于苹果抗冷性有着积极的影响,这为以后更深入地研究植物低温冷胁迫响应机制提供了一定的理论基础。
参 考 文 献:
[1] Suzuki N, Mittler R. Reactive oxygen species and temperature stresses: a delicate balance between signaling and destruction[J]. Physiologia Plantarum, 2006, 126: 45-51.
[2] Chinnusamy V, Zhu J H, Zhu J K, et al. Gene regulation during cold acclimation in plants[J]. Plant Physiology, 2006, 126 (1): 52-61.
[3] 李天忠, 張志宏. 现代果树生物学[M]. 北京: 科学出版社, 2008: 211.
[4] Chinnusamy V, Zhu J H, Zhu J K. Cold stress regulation of gene expression in plants[J]. Trends in Plant Science, 2007, 12: 444-451.
[5] Thomashow M F. Molecular basis of plant cold acclimation: insights gained from studying the CBF cold response pathway[J]. Plant Physiology, 2010, 154: 571-577.
[6] Nakashima K, Takasaki H, Mizoi J, et al. NAC transcription factors in plant abiotic stress responses[J]. Archives of Biochemistry and Biophysics, 2012, 1819: 97-103.
[7] Jakoby M, Weisshaar B, Droge-Laser W, et al. bZIP transcription factors in Arabidopsis[J]. Trends in Plant Science, 2002, 7: 106-111.
[8] Kizis D, Lumbreras V. Role of AP2/EREBP transcription factors in gene regulation during abiotic stress[J]. FEBS Letters, 2001, 498: 187-189.
[9] Gilmour S J, Fowler S G, Thomashow M F. Arabidopsis transcriptional activators CBF1, CBF2, and CBF3 have matching functional activities[J]. Plant Molecular Biology, 2004, 54: 767-781.
[10]成伟, 郑艳茹, 葛丹凤, 等. 甘蔗转录激活因子ScCBF1基因的克隆与表达分析[J]. 作物学报, 2015,41(5): 717-724.
[11]李春瑶, 何龙飞, 王爱勤. DREB转录因子提高植物抗非生物胁迫的研究新进展[J]. 安徽农业科学, 2015, 43 (30): 37-38.
[12]牛伟博. DREB 转录因子及其在植物抗逆育种中的应用进展[J]. 江苏农业科学, 2014,42(8):17-20.
[13]刘辉, 李德军, 邓治. 植物应答低温胁迫的转录调控网络研究进展[J]. 中国农业科学, 2014, 47(18):3523-3533.
[14]Fowler S, Thomashow M F. Arabidopsis transcriptome profiling indicates that multiple regulatory pathways are activated during cold acclimation in addition to the CBF cold response pathway[J]. The Plant Cell, 2002, 14(8):1675-1690.
[15]Provart N J, Gil P, Chen W, et al. Gene expression phenotypes of Arabidopsis associated with sensitivity to low temperatures[J]. Plant Physiology, 2003,132(2):893-906.
[16]丁咚, 陳亚娟, 崔进荣, 等. 毛果杨CBF/DREB1基因家族生物信息学分析[J]. 西南农业学报, 2018,31(3):457-461.
[17]Sakuma Y, Liu Q, Dubouzet J G, et al. DNA-binding specificity of the ERF/AP2 domain of Arabidopsis DREBs, transcription factors involved in dehydration-and cold-inducible gene expression[J]. Biochemical and Biophysical Research Communications, 2002, 290(3): 998-1009.
[18]Jung W J, Seo Y W. Identification of novel C-repeat binding factor (CBF) genes in rye (Secale cereale L.) and expression studies[J]. Gene, 2019, 684: 82-94.
[19]Dubouzet J G, Sakuma Y, Ito Y, et al. OsDREB genes in rice, Oryza sativa L., encode transcription activators that function in drought-, high-salt-and cold-responsive gene expression[J]. The Plant Journal, 2003,33(4):751-763.
[20]Wisniewski M, Nassuth A, Teulieres C, et al. Genomics of cold hardiness in woody plants[J]. Critical Reviews in Plant Sciences, 2014, 33(2/3):92-124.
[21]Farajzadeh M, Rahimi M, Kamali G A, et al. Modelling apple tree bud burst time and frost risk in Iran[J]. Meteorological Applications, 2010,17(1):45-52.
[22]Yang W, Liu X D, Chi X J, et al. Dwarf apple MbDREB1 enhances plant tolerance to low temperature, drought, and salt stress via both ABA-dependent and ABA-independent pathways[J]. Planta, 2011,233(2):219-229.
[23]An J P, Li R, Qu F J, et al. R2R3-MYB transcription factor MdMYB23 is involved in the cold tolerance and proanthocyanidin accumulation in apple[J]. The Plant Journal, 2018, 96: 562-577.
[24]An J P, Yao J F, Wang X N, et al. MdHY5 positively regulates cold tolerance via CBF-dependent and CBF-independent pathways in apple[J]. Journal of Plant Physiology, 2017, 218: 275-281.
[25]Shinozaki K, Yamaguchi-Shinozaki K, Seki M. Regulatory net-work of gene expression in the drought and cold stress responses[J]. [JP]Current Opinion in Plant Biology, 2003, 6:410-417.
[26]Wang D Z, Jin Y N, Ding X H, et al. Gene regulation and signal transduction in the ICE-CBF-COR signaling pathway during cold stress in plants[J]. Biochemistry (Moscow), 2017, 82(10):1103-1117.
[27]Jaglo K R, Kleff S, Amundsen K L, et al. Components of the Arabidopsis C-repeat/dehydration-responsive element binding factor cold-response pathway are conserved in Brassica napus and other plant species[J]. Plant Physiology, 2001, 127(3): 910-917.
[28]Kim Y S, Lee M, Lee J H, et al. The unified ICE-CBF pathway provides a transcriptional feedback control of freezing tolerance during cold acclimation in Arabidopsis[J]. Plant Molecular Biology, 2015, 89 (1/2): 187-201.
