小鼠嗜肺巴斯德杆菌PCR 检测方法的优化及在不同样本处理中初步应用
2020-07-04彭丽娜潘雅君谷佳男徐汪节
彭丽娜, 潘雅君, 张 曼, 谷佳男, 徐汪节
(1. 上海交通大学实验动物中心, 上海 200240;2. 上海市西南位育中学国际部, 上海 200233)
嗜肺巴斯德杆菌(Pasteurella pneumophila)在自然界中分布广泛,它有两种生物型,分别被命名为“Jawetz”和“Heyl”,主要感染啮齿类动物,对实验小鼠、大鼠和豚鼠的危害较大[1]。嗜肺巴斯德杆菌作为一种条件致病菌,能够引起免疫缺陷动物或免疫功能低下的动物产生严重的肺炎,并可能导致动物死亡。该菌也是人兽共患病原,可引起人的局部和全身感染[2-3]。实验动物及其设施内污染嗜肺巴斯德杆菌后很难去除,给饲养管理和动物实验带来了很多干扰[4]。该菌是国家标准《实验动物 微生物学等级及监测》14922.2—2011 中SPF 级啮齿类实验动物必须排除的病原菌之一[5]。
国家标准检测嗜肺巴斯德杆菌的方法为传统的细菌分离培养、生化鉴定以及血清学方法。因国家标准检测方法费时费力、操作繁琐,需要综合上述几种方法的检测结果才能得出结论,且检测周期比较长,不适用于对大规模活体实验动物感染嗜肺巴斯德杆菌的实时快速监测。
PCR 方法由于其操作简便、敏感性高、特异性强且重复性好,已被广泛应用于实验动物的微生物检测。邢进等[6]对经测序确认的227 株嗜肺巴斯德杆菌菌株,用BD 自动生化鉴定的阳性率为53.6%,用Benga PCR 方法可检出所有菌株,表明PCR 方法对病原菌的阳性检出率较高。本文采用PCR 方法,通过摸索前期采样及样本的处理方法,建立快速、准确、简便和实时监测嗜肺巴斯德杆菌的方法。
1 材料与方法
1.1 实验动物
本实验所用动物饲养于上海交通大学实验动物中心屏障设施[SYXK(沪)2018-0028]隔离检疫区隔离包内,包括经第三方检测机构(苏州西山生物技术有限公司)检测确认感染嗜肺巴斯德杆菌 Heyl型阳性[清洁级,C57BL/6,16 ♂13 ♀,6 周龄,18~20 g,共5 笼,SCXK(沪)2017-001]和嗜肺巴斯德杆菌Jawetz 型阳性[清洁级,C57BL/6,1 ♂2 ♀,9 周龄,25~30 g,共1 笼,SCXK(沪)2017-001]的待生物净化的实验小鼠,以及饲养于本设施SPF 屏障内的哨兵鼠[SPF 级,ICR,116 ♀,17周龄,40~45 g,共58 笼, SCXK(京)2016-0006]。
1.2 菌株
嗜肺巴斯德杆菌Jawetz型和Heyl型标准株基因组DNA购自苏州西山生物技术有限公司。嗜肺巴斯德杆菌Jawetz 型和Heyl 型菌株分离自实验室购买的转基因小鼠,并和Jawetz 型、Heyl 型的标准菌株基因组DNA 作比对,最终测序验证。
1.3 主要试剂与仪器
营养肉汤培养基购自杭州滨河微生物试剂有限公司;细菌基因组DNA 提取试剂盒、PCR 纯化试剂盒和100 bp DNA Ladder 均购自生工生物工程(上海)股份有限公司;粪便基因组DNA 提取试剂盒购自天根生化科技有限公司;2× ES Tag Master Mix(Dye)购自北京康为世纪生物科技有限公司;琼脂糖和Sybr Safe 核酸染料购自英潍捷基(上海)贸易有限公司。
新加坡ESCO Class Ⅱ BSC 生物安全柜;德国Eppendorf Innova 40 恒温摇床;美国Thermo NanoDrop 2000 分光光度计;美国ABI Pro Flex PCR 仪;美国Bio-Rad Gel Doc XR+核酸电泳及凝胶成像系统;德国Eppendorf 高速冷冻离心机;上海一恒医疗器械有限公司LRH-150 生化培养箱。
1.4 实验方法
本研究方案经上海交通大学实验动物伦理与使用委员会(IACUC)批准,并获取研究计划编号(A2017012)。
1.4.1 引物设计与合成 根据嗜肺巴斯德杆菌Jawetz 型和Heyl 型基因序列的特异性区域,参照文献[7]设计引物(表1)。引物由生工生物工程(上海)股份有限公司合成。
1.4.2 PCR 反应条件的优化 用嗜肺巴斯德杆菌Jawetz 型和Heyl 型标准株基因组DNA 分别摸索PCR 引物的特异性和灵敏度。PCR 反应体系为20 µL,包括:2× ES Tag Master Mix(Dye) 10 µL,引物浓度分别为0.10 µmol/L、0.15 µmol/L、0.20 µmol/L、0.25 µmol/L 和0.30 µmol/L,DNA模板20 ng。反应条件:95 ℃ 5 min;94 ℃ 30 s,55~60 ℃退火30 s,72 ℃ 30 s,共30 个循环;72 ℃ 10 min。PCR 扩增产物用1.5%琼脂糖凝胶电泳检测并切胶回收后测序验证。

表1 引物序列Table 1 The primer sequences
1.4.3 PCR 灵敏度测试 将嗜肺巴斯德杆菌Jawetz型和Heyl 型基因组DNA 的模板终质量浓度分别调整为100ng/µL、10-2ng/µL、10-4ng/µL、10-6ng/µL、10-8ng/µL、10-10ng/µL、10-11ng/µL、10-12ng/µL、10-13ng/µL 和10-14ng/µL,每个梯度各取1 µL 进行PCR 灵敏度测试。
1.4.4 实验动物的不同采样及处理方法 将嗜肺巴斯德杆菌Heyl 型感染阳性的实验小鼠每笼取2 只,分别采集饮水、口腔、新鲜粪便和肠道内容物样本。2 只小鼠的样本均匀混合后,分别用培养煮沸法和试剂盒方法提取各类样本中的DNA,并于-20 ℃保存备用。
培养煮沸法:各种采集样本分别接种于5 mL普通营养肉汤培养液,其中饮水和口腔样本接种量均为100 µL ,粪便和肠道内容物样本均用无菌枪头沾取少许接种。所有接种样本经37 ℃,180 r/min 培养16~18 h,取1 mL 菌液经4 ℃、8 000 r/min 离心3 min 后弃上清液,加入100 µL TE 缓冲液,100 ℃分别煮沸1 min、2 min、5 min 和10 min 后放冰上5 min,4 ℃、12 000 r/min离心5 min 后取上清液,于-20 ℃保存备用。
1.4.5 样本的PCR 方法检测 将实验动物的检测样本通过不同采样以及处理方法,获取基因组DNA,然后用摸索好的PCR 条件进行PCR 扩增。
1.4.6 实验动物样本采集及处理方法的重复性实验 将嗜肺巴斯德杆菌Jawetz 型感染阳性的1 笼实验小鼠按照1.4.4 的方法处理后,通过PCR 扩增验证嗜肺巴斯德杆菌Jawetz 型是否和Heyl 型的检测效果一致。
1.4.7 在实验动物检测样本中的应用 采集本中心SPF屏障设施内58笼(每笼2只)共116 只ICR哨兵鼠的口腔样本,用培养煮沸1 min 的方法提取样本DNA,分别进行嗜肺巴斯德杆菌Jawetz 型和Heyl 型PCR 扩增。另外将15 笼(每笼抽检1 只)哨兵鼠送第三方检测机构按照SPF 级实验小鼠国家标准规定的检测项目进行全项检测。
2 结果
2.1 PCR 引物浓度的优化
PCR 结果显示,嗜肺巴斯德杆菌Jawetz 型和Heyl型菌株DNA在引物浓度0.15~0.30 µmol/L的扩增条件下扩增效果较好(图1)。
2.2 PCR 退火温度的优化
PCR 结果显示,嗜肺巴斯德杆菌Jawetz 型和Heyl 型菌株DNA 在退火温度56~60 ℃的扩增条件下扩增效果较好(图2)。
2.3 PCR 灵敏度
PCR 结果显示,嗜肺巴斯德杆菌 Jawetz 型和Heyl型的DNA模板最低检出量均为10~13 ng,灵敏度较高(图3)。
2.4 实验动物的不同采样方法比较
PCR 结果显示,饮水和粪便样本中各只有2 个样本扩出目的基因,且扩增的目的条带较弱;口腔和肠道内容物的5 个样本均能扩出目的基因,扩增效果较好(图4)。
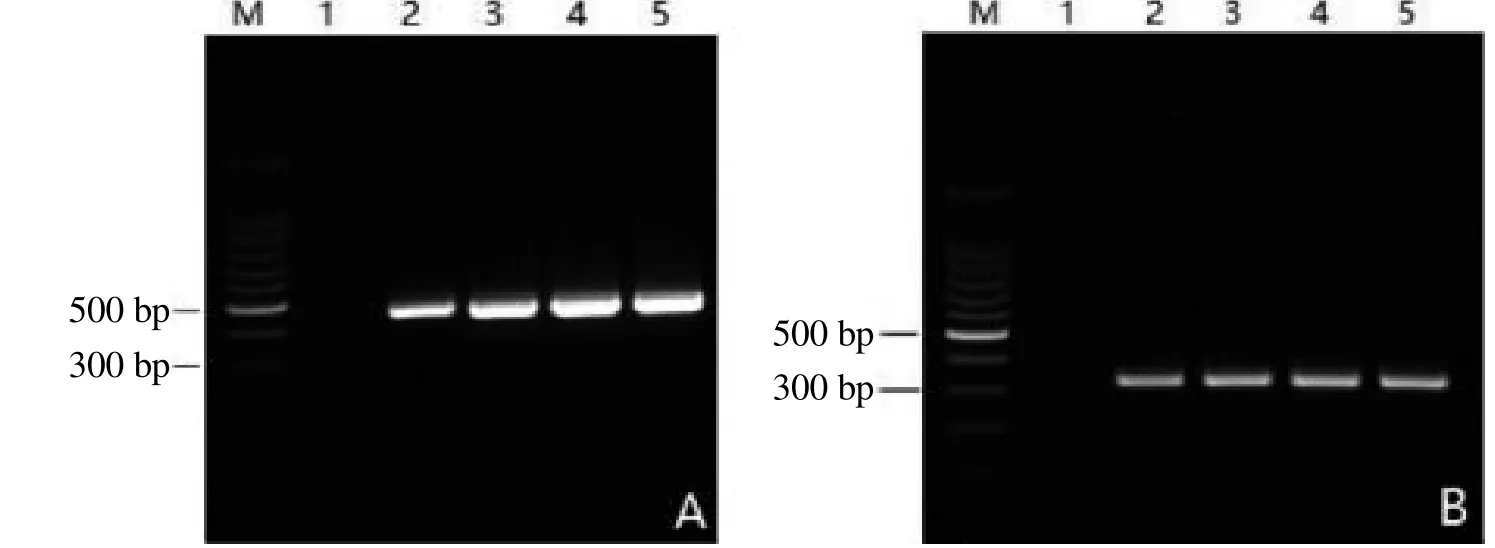
图1 PCR引物浓度的优化Figure 1 Optimization of PCR primer concentration

图2 PCR退火温度的优化Figure 2 Optimization of PCR annealing temperature

图3 PCR灵敏度实验Figure 3 Sensitivity of the PCR assay

图4 不同采样方法的比较Figure 4 Comparison of different sampling methods
2.5 不同煮沸时间处理DNA 方法的比较
PCR 结果显示,5 笼实验小鼠的口腔样本用培养煮沸法分别煮沸1 min、2 min、5 min 和10 min后均能扩出目的基因,且扩增效果较好(图5)。
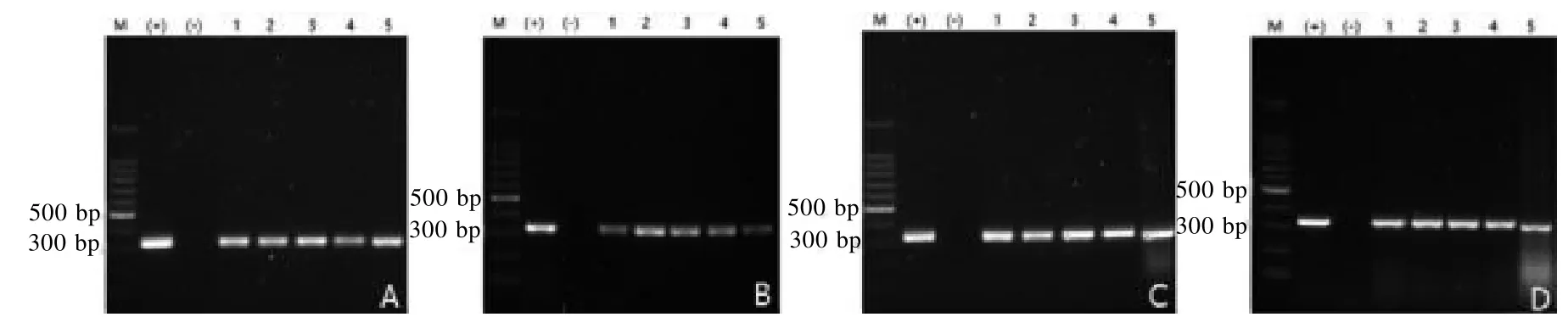
图5 不同煮沸时间提取DNA 的比较Figure 5 Comparison of different boiling time for DNA extraction
2.6 样本采集及处理方法的重复性实验
PCR 结果显示, Jawetz 型感染阳性小鼠的饮水样本用两种处理方式均未扩增出目的基因(图6A);粪便样本用3 种方法处理,有两种能扩增出目的基因(图6B);口腔样本用两种方法均能扩出目的基因,且扩增效果较好(图6C)。
2.7 检测样本中的应用
所有检测小鼠的PCR结果和送检的结果均为阴性,检测结果一致。
3 讨论

图6 不同采样及处理方法的重复性实验Figure 6 Repeated experiments of different sampling and processing methods
嗜肺巴斯德杆菌是目前啮齿类实验动物感染率最高的病原菌之一,主要感染实验动物的咽、气管、肺、子宫、眼部以及肠道等器官[8]。国家标准实验室检测该菌的传统方法是,一般采集实验动物的呼吸道分泌物、病灶组织、脓汁或者肠道内容物,在血琼脂平皿上划线培养后进行后续分离纯化和生化鉴定。当遇到菌落形态等表型特征与嗜肺巴斯德杆菌接近的菌株时,容易混淆,造成假阳性结果[6]。另外,由于国家标准检测方法与检测试剂、检测程序、硬件条件以及检测人员的业务水平和主观判断均有密切关系[9],因此该方法存在一定的局限性,需要借助一些其他手段,如PCR 和基因测序等[10]。
本研究用PCR方法对嗜肺巴斯德杆菌Heyl型和Jawetz 型两对引物的特异性进行了验证,并通过灵敏度测试实验测出两对引物的最低模板DNA的检出量均为10~13 ng,能够高效检出嗜肺巴斯德杆菌感染的低菌量实验动物样本。通过比较实验小鼠饮水、口腔、粪便以及肠道内容物等4种采样方法以及培养煮沸法和试剂盒法两种不同的样本DNA提取方法,对传统的样品采集和处理方式均进行了优化和改进。最终通过培养煮沸1 min的方法快速提取实验动物口腔样本中的细菌基因组DNA 作为PCR 模板,可有效检出嗜肺巴斯德杆菌的两种基因型。
本研究方法具有快速简便、灵敏、特异、稳定性高和成本低等优点,且对动物不会造成任何伤害,能够为高校和研究机构等实验动物使用单位在大规模实验动物日常监测、感染早期诊断、生物净化和隔离检疫时快速检测嗜肺巴斯德杆菌提供借鉴。
